Активация тромбоцитов является следствием развития каскада сложных взаимосвязанных реакций, приводящих к изменению метаболизма кровяных пластинок и их ультраструктурной организации. Внутренние процессы активации завершаются осуществлением специфических тромбоцитарных функций – гемостатической, репаративной, защитной и других [7]. К механизмам активации тромбоцитов относятся: перестройка плазматической мембраны, мобилизация и движение ионов, гидролиз инозитольных фосфолипидов, высвобождение и окисление мембранной арахидоновой кислоты, изменение метаболизма циклических нуклеотидов и другие явления. Обнаружение систем ферментного синтеза активных форм кислорода в тромбоцитах позволяет предположить возможность их участия в активации кровяных пластинок. При активации тромбоцитов тромбином, аденозиндифосфатом (АДФ) – основными индукторами агрегации кровяных пластинок – происходит активация фосфолипазы А2, инициирующей метаболизм арахидоновой кислоты и производство малонового диальдегида. Активные формы кислорода являются новыми модуляторами тромбоцитарной активности. Показано, что их экзогенная или внутритромбоцитарная продукция влияет на тромбоцитарную функцию [12].
Цель исследования – определить интенсивность производства свободных радикалов в интактных и активированных тромбоцитах, используя метод хемилюминесценции.
Материалы и методы исследования
Работа выполнена на крови здоровых людей – доноров областной станции переливания крови (n = 75). Забор крови осуществлялся согласно правилам для гемостазиологических исследований. Кровь стабилизировали 3,8 % раствором цитрата натрия (5:1). Обогащенную тромбоцитами плазму (ОТП) получали центрифугированием цитратной крови при 200 g в течение 5 минут при комнатной температуре. Бедную тромбоцитами плазму (БТП) получали после отбора из пробирок ОТП и последующего центрифугирования при 650 g в течение 25 мин. Количество тромбоцитов в ОТП доводили до 300000 кл/мкл добавлением бедной тромбоцитами плазмы. В качестве опытной пробы брали ОТП, контролем служили пробы с БТП. АДФ-индуцированную агрегацию тромбоцитов исследовали по методу Борна: определяли первую волну агрегации (на 2-й минуте), вторую волну (10-я минута) и завершение агрегации (30-я минута).
Исследование выполнено на приборе хемилюминометре ХЛ-003. Объем пробы составлял 5 мл, использовали медленное перемешивание, температурный режим – 37 °С, время регистрации 30 минут. Для усиления ХЛ добавляли 1 мл рабочего люминола. Люминол (м.в. 177) готовили на диметил сульфоксиде из расчета 10–4 и хранили в холодильнике. Рабочий раствор готовили из маточного раствора разведением на стерильном физиологическом растворе в 1000 раз (рН 7,0–7,2) [5]. Индуктором активации кровяных пластинок служил АДФ в конечной концентрации 6,4×10–7 М, в дозе, используемой для исследования агрегационной способности тромбоцитов.
Результаты считывались на компьютере и отображались графически (рисунок). При оценке интенсивности ХЛ учитывали светосумму свечения и максимальную светимость. О генерации активных форм кислорода судили по интенсивности базисной (без люминола), люминолзависимой и АДФ-индуцированной хемилюминесценции тромбоцитов (в присутствии люминола) [4]. На метод собственного свечения тромбоцитов получено авторское свидетельство [5].
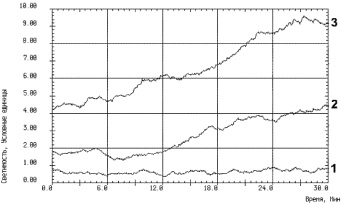
Хемилюминесценция тромбоцитов: 1 – базисная хемилюминесценция (без люминола); 2 – люминолзависимое свечение тромбоцитов; 3 – АДФ-индуцированная хемилюминесценция тромбоцитов (в присутствии люминола)
Продукты перекисного окисления липидов (ПОЛ) определяли спектрофотометрическим методом в изопропанольной фракции [2]; уровень малонового диальдегида (МДА) определяли в цветной реакции с тиобарбитуровой кислотой [3]; общую антиокислительную активность (ОАО) оценивали по степени подавления липопероксидации in vitro в присутствии суспензии мембран эритроцитов [6].
Статистическая обработка данных проводилась на персональном компьютере с помощью пакета программ Statistica 6, использован непараметрический критерий Манна ‒ Уитни.
Результаты исследования и их обсуждение
Процессы свободнорадикального окисления, протекающие с образованием радикалов RО‒ и RO2‒, можно оценивать посредством измерения хемилюминесценции (ХЛ). Биохемилюминесцентный метод не выступает в качестве прямого количественного метода определения свободных радикалов, методом ХЛ непосредственно определяется не концентрация радикалов, а интенсивность и скорость реакции, в которой они образуются. Метод хемилюминесценции обладает тем преимуществом, что, во-первых, он обычно не связан с изменением хода процессов в растворах, клетках или даже целых тканях, где регистрируется свечение, а во-вторых, весьма чувствителен при обнаружении именно высокореакционных радикалов кислорода [8]. Собственная хемилюминесценция, сопровождающая биохимические реакции в клетках и тканях, обладает, как правило, очень низкой интенсивностью и получила название «сверхслабого свечения». Поэтому применяются специальные вещества, которые усиливают процессы хемилюминесценции. В качестве подобного усилителя применяется люминол – это соединение, вступающее в реакции с образовавшимися активными формами кислорода или органическими свободными радикалами [1].
На первом этапе исследования ставилась задача выявления базисного свечения интактных тромбоцитов. Сравнивая показатели базисной хемилюминесценции обогащенной и бедной тромбоцитами плазмы, достоверно значимых отличий не выявили. Показатели хемилюминесценции тромбоцитов: базисной (без люминола), люминолзависимой и АДФ-индуцированной хемилюминесценции тромбоцитов представлены в табл. 1.
Таблица 1
Показатели хемилюминесценции тромбоцитов
|
Показатели |
Базисное свечение без люминола |
Базисное свечение с люминолом |
АДФ-индуцированная ХЛ |
||
|
БТП |
ОТП |
БТП |
ОТП |
ОТП |
|
|
Светосумма, у.е.∙мин |
1,73 ± 0,46 |
1,72 ± 0,42 р1 > 0,05 |
3,20 ± 0,56 |
84,6 ± 21,1 р1 < 0,01 р2 < 0,01 |
267,7 ± 47,7 р3 < 0,01 |
|
Макс. свет., у.е |
0,43 ± 0,07 |
0,55 ± 0,06 р1 > 0,05 |
0,60 ± 0,07 |
8,97 ± 2,56 р1 < 0,01 р2 < 0,01 |
14,38 ± 2,8 р3 > 0,05 |
Примечания: р1 – между базисной светимостью в ОТП и в БТП; р2 – между ОТП без люминола и с люминолом; р3 – между базисной светимостью с люминолом и АДФ-индуцированной хемилюминесценцией.
Добавление люминола в БТП не приводило к достоверно значимому повышению показателей ХЛ, но внесение люминола в ОТП увеличивало ХЛ тромбоцитов – максимальная светимость возрастала более чем в 16 раз, светосумма свечения более чем в 50 раз. Добавление АДФ в ОТП в дозе, используемой для исследования агрегационной способности тромбоцитов, приводило к активации процессов свободнорадикального окисления в кровяных пластинках: светосумма свечения возрастала в 3,2 раза, максимальная светимость – в 1,5 раза. Известно, что АДФ является физиологическим индуктором агрегации тромбоцитов, следовательно, процесс агрегации связан с активацией свободнорадикального окисления (СРО) в тромбоцитах. Следствием активации СРО в тромбоцитах может быть накопление вторичных (МДА) и конечных (Шиффовы основания) продуктов ПОЛ. Уровень ПОЛ в процессе АДФ-индуцированной агрегации тромбоцитов определяли на 2-й, 10-й минуте агрегации и на 30-й минуте агрегации, то есть после ее завершения (табл. 2).
Таблица 2
Содержание продуктов ПОЛ в ОТП в процессе АДФ-индуцированной агрегации тромбоцитов
|
Продукты ПОЛ |
Интактные (ОТП) |
2-я минута агрегации |
10-я минута агрегации |
30-я минута агрегации |
|
МДА, нмоль/л |
3,89 ± 0,13 |
4,02 ± 0,21 р > 0,05 |
2,89 ± 0,04 р < 0,001 р1 < 0,001 |
2,66 ± 0,06 р < 0,001 р1 < 0,01 р2 < 0,01 |
|
Σ 400 ед./мл |
1,06 ± 0,29 |
1,36 ± 0,21 р > 0,05 |
0,72 ± 0,10 р > 0,05 р1 < 0,01 |
0,60 ± 0,07 р > 0,05 р1 < 0,001 р2 > 0,05 |
Примечания: р – достоверность с ОТП (интактными); р1 – с ОТП (2 мин. агр.); р2 – достоверность с ОТП (10 мин. агр.).
В процессе агрегации на 2-й минуте в ОТП проявляется тенденция к возрастанию МДА и Шиффовых оснований, но при завершении процесса агрегации (30-я минута) вторичные и конечные продукты ПОЛ достоверно снижаются либо относительно начала агрегации, либо интактных тромбоцитов. Это может быть связано с постепенным повышением мощности общей антиокислительной активности (АОА) (табл. 3).
Таблица 3
Общая антиокислительная активность в ОТП в процессе АДФ-индуцированной агрегации тромбоцитов
|
Общая АОА |
Интактные (ОТП) |
2-я минута агрегации |
10-я минута агрегации |
30-я минута агрегации |
|
% |
51,25 ± 2,07 |
51,56 ± 2,25 р > 0,05 |
54,69 ± 1,20 р > 0,05 р1 < 0,01 |
65,00 ± 1,87 р < 0,001 р1 < 0,01 р2 < 0,01 |
Примечания: р – достоверность с ОТП (интактными); р1 – с ОТП (2 мин. агр.); р2 – достоверность с ОТП (10 мин. агр.).
Действительно, со 2-й минуты агрегации начинается постепенное повышение антиокислительной активности с достоверным ее повышением на 30-й минуте агрегации.
Наше исследование показало, что тромбоциты, как в состоянии покоя, так и при АДФ-индуцированной активации вырабатывают свободные радикалы, которые можно зарегистрировать методом хемилюминесценции. Активация тромбоцитов АДФ, следствием которой будет процесс агрегации, приводит к повышению образования свободных радикалов и увеличению хемилюминесценции тромбоцитов более чем в 3 раза. Внутриклеточная сигнализация, необходимая для реорганизации цитоскелета и гранулярной секреции, связана с активацией образования свободных радикалов и осуществляется через фосфоинозитидный путь, за счет метаболизма эйкозаноидов и т.д. Образование эйкозаноидов из арахидоновой кислоты катализируется ферментами циклооксигеназа 1 и 2 (ЦОГ1; ЦОГ2). ЦОГ1 вовлечена в тромбоцитарную функцию; ЦОГ2 преимущественно представлена при воспалении. Наличие в тромбоцитах микропероксисом, обеспечивающих эндогенный синтез пероксида водорода и его выделение в кровь в ходе реакции освобождения [7], указывает на важную роль АФК в регуляции агрегации-дезагрегации тромбоцитов. Предполагается, что активные метаболиты кислорода являются новыми модуляторами тромбоцитарной активности [9]. Показано, что их экзогенная или внутритромбоцитарная продукция влияет на тромбоцитарную функцию. Это реализуется различными АФК, включая O2–, HO – и H2O2, из тромбоцитарного происхождения, выходящих из тромбоцитов после их стимуляции коллагеном или тромбином. Активация пластинок коллагеном достаточно специфична особенно относительно гидроксильных радикалов и перекиси водорода. Более низкий уровень СРО в тромбоцитах был найден при активации АДФ и тромбином [12]. Активация тромбоцитов и вовлечение их в процесс адгезии и агрегации обусловлены трансформацией арахидоновой кислоты в простагландиновые эндопероксиды, которые тромбоксан-синтетазой превращаются в тромбоксан А2, малоновый диальдегид (МДА) и 12(L)-гидроксигептадека-5,8, 10-триеновая кислота в соотношении 1:1:1 [11]. На фоне возрастания ХЛ тромбоцитов мы не получили достоверно повышения МДА и Шиффовых оснований в процессе их агрегации. Прослеживалась лишь тенденция к возрастанию МДА и Шиффовых оснований на 2-й минуте агрегации, что соответствует первой волне агрегации, в конце агрегации (30 мин) эти метаболиты достоверно снижались относительно первой волны. На наш взгляд, это обусловлено постепенным возрастанием мощности антиокислительной системы, достигающих максимальных величин при завершении агрегации. В доступной нам литературе мы не нашли сведений об изменениях антиокислительной защиты тромбоцитов в процессе их агрегации. Известно, что на функцию тромбоцитов влияет состояние их окислительного статуса, наличие эндогенных или экзогенных радикалов, образования активных продуктов кислорода и азота. Экзогенные антиоксиданты могут модулировать тромбоцитарную активность [12]. Антиоксиданты, в частности тролокс и ресвератрол, потенциальные ингибиторы тромбоцитарной активации. Ингибиторный эффект ресвератрола, возможно, обусловлен ингибицией p38 MAP киназы, цитозольной фосфолипазы А2, арахидоновой кислоты, кальциевого каскада, активации NO, ингибиции фосфолипазы С и активатора протеин киназы С [10]. Указывается, что антиокислители, кроме неспецифических радикально подавляющих механизмов, могут ингибировать СРО за счет взаимодействия со специфическими белками. Подобная регуляция обозначается как рецептор-редокс регуляция.
Таким образом, АДФ-индуцированная активация тромбоцитов сопровождается активацией свободнорадикальных процессов с одновременной активацией антиокислительных систем. Тромбоциты, как в состоянии покоя, так и при АДФ-индуцированной агрегации, вырабатывают свободные радикалы, которые можно зарегистрировать методом хемилюминесценции.
Заключение
Регистрация собственного свечения тромбоцитов в присутствии люминола позволяет оценивать исходное состояние тромбоцитов. АДФ-индуцированная хемилюминесценция тромбоцитов позволяет установить функциональное состояние тромбоцитов, оценивая их способность образовывать свободные радикалы в процессе активации клеток.
Рецензенты:
Головлева Е.С., д.м.н., профессор кафедры нормальной физиологии, ГБОУ ВПО ЮУГМУ Министерства здравоохранения РФ, г. Челябинск;
Цейликман В.Э., д.б.н., профессор, заведующий кафедрой биохимии, ГБОУ ВПО ЮУГМУ Министерства здравоохранения РФ, г. Челябинск.
Работа поступила в редакцию 18.04.2014.
Библиографическая ссылка
Ермолаева Е.Н., Кривохижина Л.В., Кантюков С.А., Сурина-Марышева Е.Ф. СВОБОДНОРАДИКАЛЬНОЕ ОКИСЛЕНИЕ В ИНТАКТНЫХ И АКТИВИРОВАННЫХ ТРОМБОЦИТАХ // Фундаментальные исследования. 2014. № 7-1. С. 61-65;URL: https://fundamental-research.ru/ru/article/view?id=34392 (дата обращения: 13.02.2026).



