Белок CSPα (cysteine string protein) является везикулярным белком синапсов центральной и периферической нервной системы, обладающий ко-шаперонной активностью. CSPα взаимодействует с белками SNARE-комплекса, образование которого является ключевым в процессе нейротрансмиссии [12]. Нарушение функции CSPα препятствует эффективному формированию SNARE-комплексов и приводит к существенному снижению содержания белка SNAP-25 [5; 14]. И хотя CSPα принимает активное участие в целом ряде процессов, связанных с функционированием синаптических везикул и оборотом нейротрансмиттера [15], было выдвинуто предположение, что именно ко-шаперонная способность CSPα поддерживать правильную конформацию и задерживать деградацию белка SNAP-25 в процессах синаптической активности, стимулирует сборку SNARE-комплексов и, таким образом, предотвращает накопление токсичных форм SNARE-белков, имеющих развернутую конформацию, что в свою очередь препятствует синапсов [13–14]. Таким образом, стабилизация SNARE-комплексов и ингибирование процессов деградации белка SNAP-25 являются принципиально важными механизмами защиты синапсов от дегенерации, а поиск факторов, способных стимулировать эти защитные механизмы, рассматривается как перспективное направление разработки патогенетической терапии нейродегенераций. Поэтому исключительно важными представляются данные исследований, проведенных в лаборатории Т. Sudhof [5], в которых было обнаружено, что повышенная экспрессия альфа–синуклеина предотвращает развитие нейродегенеративного процесса, вызванного нарушением функции белка CSPα в модельных мышах. Более того, при выключении гена альфа-синуклеина в генетических нокаутах, отсутствие в нервной системе белка CSPα приводит к еще более стремительному развитию нейродегенеративного процесса у таких двойных нокаутных животных [5]. В линии мышей, у которых генетически инактивирован белок CSPα, развивается агрессивная форма нейродегенеративного процесса с неизбежным летальным исходом. CSPα нокаутные животные погибают в раннем постнатальном периоде с выраженной неврологической симптоматикой [6]. Также было показано, что экспрессия мутантной формы альфа-синуклеина, связанной с наследственными формами болезни Паркинсона, при которых имеет место замена аланина в 30 положении белковой молекулы на фенилаланин, не способна предотвращать развитие нейродегенеративного процесса в CSPα нокаутных мышах, поскольку такая мутантная форма белка не способна эффективно связываться с биологическими мембранами. Таким образом, было установлено, что в нейрональных синапсах альфа-синуклеин и CSPα вовлечены в общий каскадный механизм, при этом маловероятной считается их способность напрямую заменять функцию один другого. Эта гипотеза подтверждается данными Burre с соавторами [4], которые показали, что в мозге модельных животных с инактивацией функции всех трех альфа-, бета- и гамма-синуклеинов обнаруживается повышенный уровень белка CSPα.
Альфа- и гамма-синуклеины имеют исключительно высокую степень гомологии [8]. В работах целого ряда авторов [1; 4–5; 7; 11] независимо было показано, что у модельных животных с нарушенной функцией всех трех синуклеинов с возрастом развивается синаптическая дисфункция, которая не была отмечена ни у альфа-синуклеиновых, ни у бета-синуклеиновых, ни у гамма-синуклеиновых нокаутов, что указывало на принципиальную возможность замещения функции одного синуклеина другим. С другой стороны, альфа- и бета-синуклеины имеют отличную от гамма-синуклеина анатомическую картину экспрессии и обнаруживается в других популяциях центральных и периферических нейронов [3; 9]
Цель: провести сравнительный анализ способности гамма-синуклеина влиять на прогрессию нейродегенерации, обусловленной нарушением функции белка CSP-a в генетически модифицированных мышах.
Материалы и методы исследования
В работе использовали чистые линии животных на генетическом фоне линии C57Bl/6J (Charles River Laboratories, США). Мыши с делецией гена белка CSPα были получены из лаборатории T. Sudhof (Genentech, США) [6]. Линия трансгенных мышей Thy1mγtg была получена из лаборатории V. Buchman [10]. Работы с животными проводили в соответствии с «Правилами лабораторной практики в Российской Федерации» от 2003 г. Геномную ДНК выделяли из биопсии уха животных с помощью набора DiatomTM DNA Prep 200 (ООО «Лаборатория ИзоГен», Россия). Детекцию мутированных аллелей проводили методом полимеразной цепной реакции (ПЦР) с помощью набора GenePak® PCR Core (ООО «Лаборатория ИзоГен», Россия). Для генотипирования потомства от скрещивания мышей трансгенной линии Thy1mγtg с нокаутными мышами линии CSPα–/– проводили идентификацию гомозиготных и гемизиготных по трансгенной кассете особей с использованием ПЦР в реальном времени, которую проводили на установке StepOne Real-Time PCR System (Applied Biosystems, США). При анализе соответствующих последовательностей генов использовали праймеры для CSPα: D (5’ AAAGTCCTATCGGTAAGCAGC), E (5’ CTGCTGGCATACTAATTGCAG), C (5’ GAGCGCGCGCGGCGGAGTTGTTGAC), для трансгенных животных по γ-синуклеину: Psn_up (CCA-TGG-ACG-TCT-TCA-AGA-AAGG), Gsex2_rev (CGT-TCT-CCT-TGG-TTT-TGG-TG). Для постановки иммуноблоттинга использовали следующие антитела: к γ-синуклеину – кроличьи поликлональные, клон SK23 [2], к синаптофизину – мышиные моноклональные, клон 2, BD Transduction Laboratories.
Результаты исследования и их обсуждение
Получение повышенной экспрессии гамма-синуклеина в нервной системе CSPα нокаутных мышей. CSPα нокаутные мыши были скрещены с трансгенными мышами по гену гамма-синуклеина, чтобы создать линию мышей, у которых в геноме отсутствует ген белка CSPα и в то же время на высоком уровне экспрессируется ген белка гамма-синуклеина в нейронах. Для получения такой линии нами была проведена серия скрещиваний CSPα нокаутных мышей с линией трансгенных по гамма-синуклеину мышей [10]. Всех, полученных в первом поколении самок (n = 40) от скрещивания CSPα нокаутных мышей с мышами, трансгенными по гамма-синуклеину, скрещивали с самцами первого поколения. Результатом такого скрещивания является формирование девяти возможных генотипов, которые были определены анализом ДНК из биопсий уха всех потомков методом обычной ПЦР для гена белка CSPα и ПЦР в реальном времени для трансгенной кассеты гамма-синуклеина. В результате генотипирования животных (n = 279), полученных во втором поколении, были идентифицированы потомки со следующими генотипами:
CSPα+/+ / Thy1mγWT/WT - 19 особей; CSPα+/+ / Thy1mγtg/WT - 35 особей; CSPα+/- / Thy1mγWT/WT - 41 особь; CSPα+/- / Thy1mγtg/WT - 69 особей; CSPα+/+ / Thy1mγtg/tg - 33 особи; CSPα+/- / Thy1mγtg/tg - 14 особей; CSPα-/- / Thy1mγWT/WT - 23 особи; CSPα-/- / Thy1mγ tg /WT - 29 особей; CSPα-/- / Thy1mγtg/tg - 16 особей.
В результате проведенных скрещиваний нами было получено 16 особей с генотипом CSPα–/– / Thy1mγ tg/tg, что составляет 5,7 % от общего числа (n = 279) прогенотипированных, выживших до половозрелого возраста потомков и соответствует ожидаемому количеству при менделевском типе наследования.
Повышенная экспрессия экзогенного гамма-синуклеина в нервной системе CSPα нокаутных мышей не влияет на прогрессию нейродегенеративного процесса. Нокаутные по гену белка CSPα мыши прекращали расти и набирать вес между 10 и 20 днями постнатального периода, в отличие от контрольных мышей дикого типа. С этого момента общее состояние нокаутных животных постепенно ухудшалось и, начиная с трехнедельного возраста, регистрировалась их гибель. Около половины всех нокаутных по CSPα мышей не доживали до 35-го постнатального дня, а к 52-му дню погибали все животные. Чтобы определить, будет ли сверхэкспрессия гамма-синуклеина в нокаутных мышах по CSPα влиять на выживаемость этих мышей, мы создали когорты животных дикого типа (WT) и нокаутных CSPα мышей, экспрессирующих высокий уровень гамма-синуклеина в нейронах, благодаря наличию трансгенного аллеля Thy1mγ в их геноме в гомозиготном состоянии, то есть получили экспериментальные группы животных с генотипами: CSPα–/– / Thy1mγtg и CSPα+/+ / Thy1mγtg. Далее мы исследовали фенотипы мышей полученных линий, регистрируя вес в раннем постнатальном периоде и продолжительность жизни. Мыши с генотипом CSPα+/+ / Thy1mγtg набирали вес и развивались нормально и не отличались от контрольных животных C57Bl/6J дикого типа в течение первых двух месяцев постнатального развития. Смертность этих животных в этом периоде была наравне с таковыми в контрольных группах животных дикого типа линии C57Bl/6J, которых содержали в таких же условиях. Мыши линии CSPα–/– / Thy1mγtg, напротив, не набирали вес, начиная с 10 дня постнатального периода так же, как мыши линии CSPα–/– , не несущие трансгенную кассету гамма-синуклеина. На этой стадии мыши обеих групп становились постепенно апатичными, хотя способны были реагировать в ответ на внешний раздражитель. Причем это было показано как для самцов, так и самок (таблица).
Масса тела животных разных генотипов в раннем постнатальном периоде, X±m
|
Дни |
WT♀ |
Thy1mγtg♀ |
CSPα–/–♀ |
CSPα–/–/ Thy1mγtg♀ |
WT♂ |
Thy1mγtg♂ |
CSPα–/–♂ |
CSPα–/–/ Thy1mγtg♂ |
|
10 |
4,98 ± 0,2 |
4,71 ± 0,3 |
4,70 ± 0,1 |
4,41 ± 0,2 |
4,74 ± 0,1 |
4,92 ± 0,2 |
4,57 ± 0,2 |
4,67 ± 0,1 |
|
20 |
7,67 ± 0,3 |
7,30 ± 0,3 |
5,32 ± 0,3 |
5,93 ± 0,4 |
7,98 ± 0,2 |
7,25 ± 0,2 |
6,91 ± 0,4 |
6,09 ± 0,2 |
|
30 |
14,16 ± 0,2 |
13,8 ± 0,7 |
5,47 ± 0,5 |
6,43 ± 0,3 |
16,83 ± 0,1 |
15,98 ± 1,1 |
7,13 ± 0,4 |
6,25 ± 0,2 |
|
40 |
17,36 ± 0,1 |
17,28 ± 0,7 |
6,81 ± 0,2 |
6,28 ± 0,6 |
21,0 ± 0,3 |
20,54 ± 0,8 |
7,56 ± 0,2 |
6,58 ± 0,3 |
|
50 |
19,09 ± 0,5 |
18,75 ± 0,7 |
6,90 ± 0,2 |
7,25 ± 0,1 |
23,12 ± 0,4 |
23,65 ± 0,5 |
7,34 ± 0,1 |
6,48 ± 0,7 |
|
60 |
21,01 ± 0,3 |
20,47 ± 0,9 |
– |
7,23 ± 0,1 |
27,34 ± 0,1 |
26,41 ± 0,5 |
± |
7,01 ± 0,5 |
Генотипы: WT (wild type) – контрольная группа с немодифицированным геномом; Thy1mγtg – линия трансгенных мышей со сверхэкспрессией гамма-синуклеина; CSPα–/– – нокаутные мыши по CSPα, CSPα–/– / Thy1mγtg – нокаутные мыши по CSPα со сверхэкспрессией гамма-синуклеина (масса в граммах, X – средняя арифметическая; m – ошибка средней арифметической).
Статистически значимых отличий в возрасте наступления смерти между животными групп CSPα–/– / Thy1mγtg и CSPα–/– выявлено не было. Так же, как и в группе CSPα–/– мышей, 50 % мышей линии CSPα–/– / Thy1mγtg погибали к 35 постнатальному дню и к 50 дню погибали почти все мыши (рис. 1).
Таким образом, показатели динамики постнатального развития мышей CSPα–/– / Thy1mγtg, которое было охарактеризовано регулярной регистрацией массы тела животных, не отличались от показателей линии нокаутных по CSPα мышей с нормальной экспрессией гамма-синуклеина.
Анализ уровня гамма-синуклеина в синаптических везикулах CSPα–/– / Thy1mγtg мышей. Ранее было установлено, что увеличение внутриклеточной концентрации альфа-синуклеина, причем не только в синапсах, но и в цитоплазме нейронов, путем его эктопической экспрессии позволяет остановить нейродегенеративный процесс, вызванный недостаточностью функции белка CSPα, участвующего в образовании SNARE-комплекса при нейротрансмиссии [5]. Для того чтобы оценить, влияет ли сверхэкспрессия гамма-синуклеина на синаптическую дисфункцию, причиной которой является отсутствие в геноме ко-шаперонного белка CSPα, очень важным представлялся вопрос, достаточно ли высокая концентрация эктопического гамма-синуклеина в синапсах полученных нами мышей. То, что уровень эктопического гамма-синуклеина высок в телах и в отростках нейронов, ранее было показано в работах, посвященных анализу этой линии мышей [10]. Однако не было показано наличие эктопического гамма-синуклеина в синапсах. Для того чтобы доказать, что гамма-синуклеин присутствует в синапсах в повышенном количестве у трансгенных мышей, мы анализировали с помощью иммуноблоттинга белковые фракции печени, коры головного мозга, спинного мозга, а также синаптосомальную и везикулярную фракции (выделенные из полосатого тела мозга) девятимесячных мышей дикого типа и трансгенных по гену гамма-синуклеина. В результате мы показали, что гамма-синуклеин действительно присутствует в больших количествах во фракции синаптических везикул и в грубой синаптосомальной фракции. Также мы показали, что эктопический гамма-синуклеин экспрессировался исключительно в нервной ткани. В контрольных препаратах, полученных от мышей дикого типа, его количество было существенно ниже, поскольку там присутствовал только эндогенный гамма-синуклеин (рис. 2).
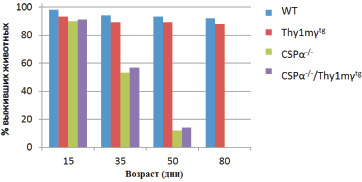
Рис. 1. Процент выживших животных разных генотипов в различные периоды постнатального развития
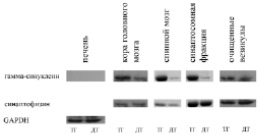
Рис. 2. Детекция эктопического гамма-синуклеина в лизатах нервной ткани и печени Thy1mγtg мышей: ТГ – трансгенные мыши; ДТ – дикий тип, контрольная группа с немодифицированным геномом
В данном эксперименте в качестве контроля был выбран синаптофизин – синаптический белок, который использовали для нормализации значений тотального синаптического белка в исследуемых образцах.
Таким образом, можно сделать вывод, что высокие количества гамма-синуклеина в синапсах не обеспечивают реверсию фенотипа CSPα нокаутных мышей, и этим он отличается от альфа-синуклеина. Несмотря на структурные сходства между альфа- и гамма-синуклеином, их функции в пресинаптических окончаниях разделены и не дублируются.
Рецензенты:
Кинзирский А.С., д.м.н., профессор, заведующий лабораторией фармакологии, Институт физиологически активных веществ РАН, г. Черноголовка;
Григорьев В.В., д.б.н., заведующий лабораторией нейрорецепции, Институт физиологически активных веществ РАН, г. Черноголовка.
Работа поступила в редакцию 30.04.2014.Библиографическая ссылка
Лыткина О.А., Тарасова Т.В., Анохин П.К., Кухарский М.С., Устюгов A.A., Бачурин С.О. ИССЛЕДОВАНИЕ ЭФФЕКТА ПОВЫШЕННОГО ОБРАЗОВАНИЯ ГАММА-СИНУКЛЕИНА НА ДЕГЕНЕРАЦИЮ СИНАПСОВ, ВЫЗВАННУЮ НАРУШЕНИЕМ ФУНКЦИИ БЕЛКА CSPα // Фундаментальные исследования. 2014. № 6-6. С. 1214-1218;URL: https://fundamental-research.ru/ru/article/view?id=34316 (дата обращения: 24.01.2026).



