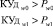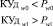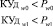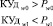В настоящее время актуальна проблема диагностики онкологических заболеваний желудка на ранней стадии. В странах с большим количеством населения территориально отдаленного последних от специализированных центров своевременной диагностики и лечения, диагностика осуществляется, как правило, в процессе скрининга или средств телемедицины [1]. В основе предлагаемого диагностического подхода ранней диагностики рака желудка предлагается применять концепцию рассмотрения крови как соединительной ткани, системно присутствующей во всех участках внутренних и внешних физиологических систем и органов и несущей в значениях регистрируемых характеристик информацию об изменениях в организме [2].
В процессе скрининг-диагностики или общей диспансеризации осуществляется лабораторный анализ крови. Определим их как частные, первично регистрируемые, принадлежащие некоторому множеству {Х}. Для решения задач доклинической диагностики на основе анализа указанных показателей в процессе скрининга предлагается применять следующую информационно-аналитическую модель (рисунок).
На принятие управленческого решения о необходимости проведения клинического обследования на предмет выявления рака желудка оказывают влияние различные факторы: образ жизни (прежде всего характер питания и стрессовость), жалобы пациента и другие показатели функционирования определенных физиологических систем. Эти показатели группируются в блоке «Жалобы больного, образ жизни, наследственность».
Основной группой анализируемых показателей доклинической диагностики возможности наличия онкологических заболеваний желудка являются значения показателей, полученных в процессе анализа крови (включая значения показателей онкомаркеров) – в информационно-аналитической модели представлены блоком «База показателей крови». В этом блоке весь информационный архив показателей лабораторного анализа крови состоит из двух групп. В первую – включены показатели крови людей с клинически подтвержденным диагнозом рака желудка. Вторую группу составляют значения тех же показателей у людей, не больных раком желудка. Таким образом, в базе показателей крови представлены показатели для двух альтернативных классов. Под альтернативным классом будем понимать не больных онкологическими заболеваниями людей – класс w0, больных раком желудка – класс w1.
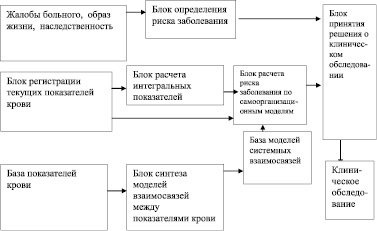
Информационно-аналитическая модель доклинической диагностики рака желудка
Результаты лабораторного анализа крови людей, по которым решается задача ранней диагностики, представлены «Блоком регистрации текущих показателей крови».
Для построения классификационных правил формируются обучающие выборки, по которым синтезируются правила принятия решений с использованием самоорганизационных алгоритмов, основанных на математических моделях, идентифицированных с помощью программных средств метода группового учета аргументов (МГУА) [3, 4].
Процедура обучения реализуется в «Блоке синтеза моделей взаимосвязей между показателями крови». В качестве исходных данных для этого блока используются как традиционные показатели анализа состава крови (вектор Х = х1, …, хn), так и комплекс интегральных показателей (вектор Y = y1, …, ym). Значения интегральных показателей определяются по формуле вида:
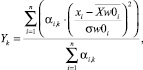 (1),
(1),
где k – индекс интегрального показателя; Yk – интегральный показатель; xi – значение i-го частного показателя крови у пациента, 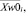 σw0i – соответственно, модальное значение (в случае нормального распределения совпадает с математическим ожиданием и средними значениями) и средне-квадратичное отклонение (СКО) i-го частного показателя крови, полученное на обучающей выборке для класса «здоровые»,
σw0i – соответственно, модальное значение (в случае нормального распределения совпадает с математическим ожиданием и средними значениями) и средне-квадратичное отклонение (СКО) i-го частного показателя крови, полученное на обучающей выборке для класса «здоровые», 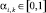 – весовые коэффициенты, определяющие информационный вклад показателя xi в формирование интегрального показателя Yk.
– весовые коэффициенты, определяющие информационный вклад показателя xi в формирование интегрального показателя Yk.
В предлагаемой информационно-аналитической модели предусмотрено несколько вариантов определения указанных коэффициентов: экспертное; заключение, на основе дисперсионного анализа; использование информационного критерия Кульбака.
Интегральные показатели используются для решения задач ранней диагностики рака желудка и вычисляются для анализируемого пациента в «Блоке расчета интегральных показателей».
Результатом работы «Блока синтеза моделей взаимосвязей между показателями крови» является набор математических моделей, характеризующих множественные связи между векторами признаков 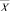 и интегральных показателей
и интегральных показателей 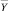 для основного (рак желудка) и альтернативного классов.
для основного (рак желудка) и альтернативного классов.
В целях оптимизации применения моделей формируется «База моделей системных взаимосвязей».
В «Блоке расчета риска заболевания по самоорганизационным моделям» основного класса заболеваний w1, используя вектора 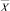 и
и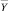 , определяются модифицированные вектора
, определяются модифицированные вектора 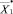 и
и 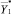 как значения аппроксимантов идентифицированных моделей. Аналогично по моделям альтернативного класса w0, используя те же вектора
как значения аппроксимантов идентифицированных моделей. Аналогично по моделям альтернативного класса w0, используя те же вектора 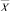 и
и 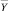 , определяются вектора
, определяются вектора 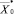 и
и 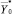 . По полученным векторам определяются меры близостей – вектора:
. По полученным векторам определяются меры близостей – вектора: 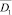 и
и 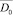 соответственно между векторами
соответственно между векторами 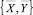 , и
, и 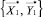 и
и 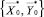 .
.
Полученные значения мер близости являются базовыми переменными для решения задачи расчета рисков соотнесения состояния пациента к различным альтернативным классам Rkw0 и Rkw1 в блоке расчета риска заболевания по самоорганизационным моделям.
С целью улучшения качества классификации кроме показателей крови используются значения признаков, формируемых в блоке «Жалобы больного, образ жизни, наследственность». По этой группе признаков в блоке оценки риска заболевания рассчитываются показатели Rtw0 и Rtw1, характеризующиe степени риска возникновения рака желудка (или не возникновения соответственно), значения которого выбираются из «Блока оценки риска заболевания».
Окончательное решение о проведении клинического обследования осуществляется путем агрегации указанных показателей риска в «Блоке принятия решения о клиническом обследовании».
Учитывая факт наличия малых выборок при решении рассматриваемой диагностической задачи, предлагается использовать самоорганизационный алгоритм структурно-параметрической идентификации МГУА, синтезирующий модели вида (2):
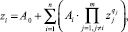 (2)
(2)
где Ai – весовой коэффициент; zj – переменная (из множеств {X},{Y}); qj – степень аргумента; n – количество рядов селекции (термов полинома); m – количество переменных.
Затем в каждом из альтернативных классов формируются наборы адекватных моделей, не пересекающихся друг с другом по параметрам или структурам.
Таким образом, согласно предлагаемой информационно-аналитической модели доклинической диагностики рака желудка предлагается следующая методика классификации:
1. Формируется репрезентативная выборка исходных данных (частные и интегральные показатели крови – множества {X} и {Y} соответственно), на основе которой после селекции артефактной информации осуществляется формирование из нее обучающей и экзаменационной подвыборок.
2. Для каждого диагностируемого альтернативного класса формируются пакеты математических моделей, отражающих связи между показателями соответственно:
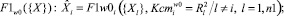 (3)
(3)
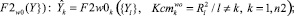 (4)
(4)
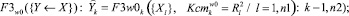 (5)
(5)
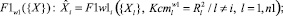 (6)
(6)
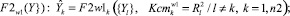 (7)
(7)
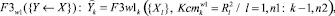 (8)
(8)
где n1 – количество частных показателей; n2 – количество интегральных показателей; F1 – аппроксиманты, построенные на множестве {X}; F2 – аппроксиманты, построенные на множестве {Y}; F3 – аппроксиманты, построенные на множествах {X} и {Y}, Ксm – коэффициенты уверенности в адекватности применения аппроксимантов в качестве моделей (в соответствующих альтернативных классах w0, w1); R2 – коэффициенты детерминации для соответствующих моделей-аппроксимантов.
В пакеты моделей включаются только те, у которых значения коэффициентов детерминации превышает определенный исследователем пороговый уровень.
Уверенность в адекватности применения сформированных пакетов математических моделей в альтернативных классах определяются по формулам (9) и (10) соответственно.
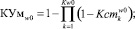 (9)
(9)
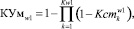 (10)
(10)
где Кw0 = n1, Кw1 = n2.
Значение коэффициента уверенности одновременного применения обоих пакетов моделей вычисляется по формуле (11).
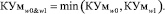 (11)
(11)
3. На экзаменационной подвыборке определяется уверенность квалификационных возможностей для каждого альтернативного класса КУквw0 и КУквw1 как (1 - βw0) и (1 - βw1), где βw0, βw1 - ошибки второго рода классификации.
В случае недостаточности объемов экзаменационных подвыборок в каждом из альтернативных классов осуществляется экспертный анализ для построения функции принадлежности на базовой переменной Zb, вычисляемой по формуле (12). Затем значение функции принадлежности используется для вычисления соответствующих значений коэффициентов уверенности:
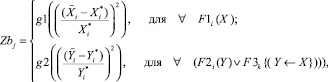 (12)
(12)
где g1, g2 – некоторые функции, определяющие мерность носителя; 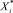 ,
, 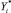 – значения частных и интегральных показателей для диагностируемого пациента.
– значения частных и интегральных показателей для диагностируемого пациента.
В этом случае функция принадлежности рассматривается в виде формулы:
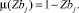 (13)
(13)
4. Процесс диагностики возможного заболевания раком желудка осуществляется следующим образом.
В ходе осуществления анализа крови формируется экспериментальный вектор (включая значения онкомаркеров) 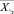 (размер вектора m1) и характеристики образа жизни – пациента – вектор
(размер вектора m1) и характеристики образа жизни – пациента – вектор  . По последнему в блоке определения риска заболевания (рисунок) рассчитывается значение показателя риска Rt (по табличным данным, заранее определенным экспертами с учетом личного опыта и/или рекомендаций научно-практических исследований по данным публикаций). По вектору
. По последнему в блоке определения риска заболевания (рисунок) рассчитывается значение показателя риска Rt (по табличным данным, заранее определенным экспертами с учетом личного опыта и/или рекомендаций научно-практических исследований по данным публикаций). По вектору 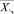 рассчитывается вектор экспериментальных интегральных показателей
рассчитывается вектор экспериментальных интегральных показателей 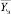 (размерность вектора m2).
(размерность вектора m2).
Полученные вектора 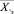 и
и 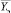 поступают в «Блок расчета риска заболеваний по самоорганизационным моделям», в котором определяются коэффициенты уверенности КУмw0, КУмw1, КУквw0, КУквw1, КУв. По данным коэффициентам уверенности определяются обобщенные классификационные коэффициенты уверенности соотнесения к альтернативным классам КУw0 и КУw1 – формулы (14) и (15), соответственно.
поступают в «Блок расчета риска заболеваний по самоорганизационным моделям», в котором определяются коэффициенты уверенности КУмw0, КУмw1, КУквw0, КУквw1, КУв. По данным коэффициентам уверенности определяются обобщенные классификационные коэффициенты уверенности соотнесения к альтернативным классам КУw0 и КУw1 – формулы (14) и (15), соответственно.
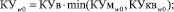 (14)
(14)
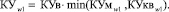 (15)
(15)
Далее, используя формулы (3)–(8), вычисляются для каждого из альтернативных классов множества: 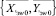 и
и 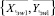 соответственно. Затем определяются меры близости по формулам (16) и (17) соответственно.
соответственно. Затем определяются меры близости по формулам (16) и (17) соответственно.
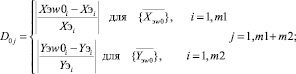 (16)
(16)
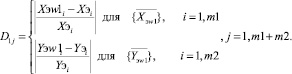 (17)
(17)
По полученным значениям мер и предварительно заданным экспертным путем (клиницистами) функциям принадлежностей к альтернативным классам w0 и w1 (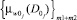 и
и 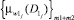 соответственно), определяются показатели уверенности принадлежности к альтернативным классам по мерам близости КУмбw0 и КУмбw1 по формулам (18) и (19) соответственно.
соответственно), определяются показатели уверенности принадлежности к альтернативным классам по мерам близости КУмбw0 и КУмбw1 по формулам (18) и (19) соответственно.
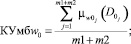 (18)
(18)
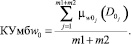 (19)
(19)
Примечание. Функции принадлежности рекомендуется строить по формуле (20). (Эксперт определяет численные значения a и b – рекомендуется: a = 0,1 –0,15, b > 0,5)
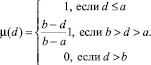 (20)
(20)
По полученным значениям показателей уверенности определяются показатели риска Rkw0 и Rkw1 по формулам (21) и (22) соответственно:
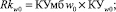 (21)
(21)
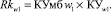 (22)
(22)
Для принятия решения о принадлежности пациента к одному из альтернативных классов в блоке принятия решения о клиническом обследовании осуществляется расчет коэффициентов уверенности в диагностике КУдw0 и КУдw1 по формулам (23) и (24) соответственно.
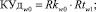 (23)
(23)
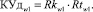 (24)
(24)
Для каждого из показателей уверенности задаются пороговые отношения Pw0 и Pw1 и составляется таблица. Если значение соответствующего показателя не превышает порогового уровня, то значение элемента таблицы равно «0», в противном случае – «1». Каждому соотношению соответствует определенная ситуация.
Диагностические ситуации (р – пороговые значения – определяются экспертно)
|
|
|
|
|
Идентификатор (№ ) ситуации |
Описание ситуации |
|
0 |
0 |
0 |
0 |
1 |
Дополнительное обследование |
|
0 |
0 |
0 |
1 |
2 |
Здоров – класс w0 |
|
0 |
0 |
1 |
0 |
1 |
Дополнительное обследование |
|
0 |
1 |
0 |
0 |
3 |
Болен – класс w1 |
|
1 |
0 |
0 |
0 |
1 |
Дополнительное обследование |
Таким образом, выделяются 3 ситуации, возникающие в процессе применения предлагаемой информационно-аналитической модели: 1 – пациент нуждается в дополнительном обследовании; 2 – вероятность присутствия рака желудка низка (пациент здоров); 3 – высока вероятность присутствия заболевания рака желудка.
Заметим, что для решения классификационных задач возможного развития заболевания в процессе мониторинга изменений определенных физиологических сигналов, представленных временными рядами и отражающих системные изменения в организме, возможно применение искусственных иммунных сетей (по методике, например, рассмотренной в работе [5]).
Таким образом, предлагаемый метод доклинической диагностики рака желудка, основываясь на самоорганизационных алгоритмах идентификации математических моделей, отличается анализом межсистемных связей между различными показателями крови, несущей информацию о происходящих в организме системных изменениях в процессе возникновения онкологических заболеваний, в первую очередь внутренних органов – в частности рака желудка.
Библиографическая ссылка
Артеменко М.В., Серебровский В.В., Бабков А.С. ИНФОРМАЦИОННО-АНАЛИТИЧЕСКАЯ МОДЕЛЬ ПОДДЕРЖКИ ПРИНЯТИЯ РЕШЕНИЙ В ПРОЦЕССЕ ДИАГНОСТИКИ РАКА ЖЕЛУДКА // Фундаментальные исследования. 2014. № 6-1. С. 18-23;URL: https://fundamental-research.ru/ru/article/view?id=34100 (дата обращения: 01.02.2026).