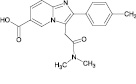
Золпидем – это небензодиазепиновый снотворный препарат, химическое название –N,N,6-триметил-2-(4-метилфенил)имидазо[1,2-а]пиридин-3-ацетамид. Золпидем быстро всасывается в тонком кишечнике, имеет короткий период полувыведения (0,7–3,5 ч) [2], метаболизируется до фармакологически неактивных метаболитов и экскретируется в неизменном виде менее чем на 1 % [1, 4]. Поэтому очевидна необходимость определения именно метаболитов для эффективного выявления факта приема золпидема при проведении химико-токсикологического анализа (ХТА).
Золпидем в своей структуре содержит амидную связь, которая способна гидролизоваться с образованием продукта гидролиза золпидема. Обнаружение этого продукта может иметь большое значение при анализе длительно хранившейся мочи, когда за счет разложения мочевины происходит увеличение pH образца и, как следствие – гидролиз золпидема, что приводит к значительному снижению концентрации нативного вещества [3], которое и так выводится в следовых количествах.
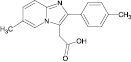
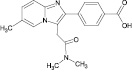
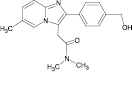
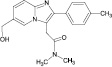
Сведения по анализу метаболитов золпидема в мировой научной литературе единичны и представляют собой разрозненные и несистематизированные материалы. Метаболиты золпидема и продукт его гидролиза содержат в своей структуре полярные функциональные группы (–OH и –COOH), придающие аналитам свойства труднолетучих в условиях газовой хроматографии (ГХ) веществ (табл. 1).
Таблица 1
Метаболиты золпидема, продукт его гидролиза и их некоторые физико-химические характеристики
|
Структурная формула |
Название |
pKa (-COOH) |
LogP (цвиттер-ион) |
|
|
Продукт гидролиза золпидема (ЗГ) |
6,46 ± 0,70 (3,85 ± 0,10) |
2,82 ± 0,61 (0,32 ± 1,0) |
|
|
4’-(карбокси)-золпидем (4’-КЗ) |
5,02 ± 0,70 (3,23 ± 0,10) |
1,46 ± 0,64 (1,01 ± 1,0) |
|
|
4’-(гидроксиметил)-золпидем (4’-ГМЗ) |
4,96 ± 0,70 |
0,71 ± 0,64 |
|
|
6-(гидроксиметил)-золпидем (6-ГМЗ) |
5,15 ± 0,70 |
1,15 ± 0,64 |
|
|
6-(карбокси)-золпидем (6-КЗ) |
5,62 ± 0,50 (2,30 ± 0,20) |
1,54 ± 0,65 (‒0,96 ± 1,0) |
Поэтому для их исследования требуется получение летучих дериватов. В литературе описаны данные только о масс-фрагментации этильного деривата главного метаболита золпидема (4’-КЗ) [5], а также триметилсилильных производных 4’-ГМЗ, 6-ГМЗ, 4’-КЗ и 6-КЗ [6]. Данных о масс-спектрах различных производных продукта гидролиза золпидема в литературе не представлено.
Целью настоящей работы явилось изучение газохроматографических и масс-спектральных характеристик различных производных метаболитов золпидема и продукта его гидролиза после дериватизации с применением алкилирования метилйодидом, этанолом, изопропилйодидом, пентафторпропанолом, ацетилирования, получения триметилсилильных эфиров.
Материалы и методы исследования
Золпидема тартрат (порошок-субстанция, Испания, НД 42-13447-05); β-глюкуронидаза (Type HP-2, From Helix Pomatia, 101400 ЕД/мл, Sigma-ALDRICH Inc.); 2,2,3,3,3-пентафторпропанол и 2,2,3,3,3-пентафторпропионовый ангидрид («ICN Biomedicals», США); бис-триметилсилил-трифторацетамид (BSTFA), содержащий 1 % триметилхлорсилана (Sigma Chemical, Co; Sigma-ALDRICH CHEMI, Germany); метилйодид (Вектон, Шосткинский завод химреактивов), изопропилйодид (Вектон, Шосткинский завод химреактивов). Все используемые прочие растворители и реактивы имели чистоту х.ч. Применялись картриджи для ТФЭ AccuBond II EVIDEX и SampliQ Evidex – 200 мг – 3 мл (Agilent, США). Оборудование: газовый хроматограф Agilent 6850, оснащенный капиллярной кварцевой колонкой НР-5MS длиной 30 м с внутренним диаметром 0,25 мм и толщиной пленки неподвижной фазы 0,25 мкм. Масс-селективный детектор Agilent 5973N (Agilent, США). Для твердофазной экстракции применяли: систему с вакуумной камерой (манифолд) на 12 позиций (Supelico), насос низкого вакуума (AIR CADET, США). Для выполнения реакции гидролиза и процедур дериватизации использовались термоблок ПЭ-4030 (ОАО «Экрос», Россия) и микроволновая печь Rolsen MS 1770 SA (Россия). При выполнении работы также применялись: микровстряхиватель ПЭ-2 (ОАО «Экрос», Россия), полуавтоматические пипетки-дозаторы, позволяющие отбирать объемы жидкостей 4–40, 40–200, 200–1000 мкл и 1–5 мл. Исследовали образцы мочи испытуемых лиц, полученные после перорального приема однократной терапевтической дозы золпидема тартрата (10 мг). Параллельно анализировали контрольные образцы мочи, собранные у тех же лиц до приема золпидема тартрата. Полученные образцы мочи хранились при –20 °С, перед исследованиями мочу согревали до комнатной температуры.
Пробоподготовка образцов мочи: к 2 мл мочи прибавляют 0,5 мл 1/15 М фосфатного буфера рН 6,0, 0,1 мл β-глюкуронидазы (10140 ЕД), перемешивают, герметично укупоривают и экспонируют в течение 2 часов при 45 °С. Полученный гидролизат центрифугируют при 2000 об/мин в течение 5 минут. Центрифугат отделяют от осадка, прибавляют 2,5 мл 1/15 М фосфатного буфера (pH 5,4) и подвергают ТФЭ по схеме: кондиционирование сорбента осуществляют последовательным промыванием 2 мл 95 % этанола и 2 мл 1/15 М фосфатного буфера рН 5,4. Загрузку анализируемого образца мочи осуществляют со скоростью 1,0 мл/мин, после чего промывают сорбент последовательным пропусканием через него растворов объемами по 1 мл: 1/15 М фосфатного буфера рН 5,4; 0,1 М раствора уксусной кислоты и 3 мл 50 % раствора метанола в воде. Элюирование осуществляют в отдельный флакон со скоростью 1,0 мл/мин смесью дихлорметан–2-пропанол–25 % раствор аммиака (2:1:0,1) дважды порциями по 2 мл. Элюат испаряют досуха в токе азота при 60 °С.
Дериватизация метаболитов золпидема и продукта его гидролиза
Алкилирование метилйодидом (метилирование). К сухому остатку в реакционной виале прибавляли 20–25 мг прокаленного калия карбоната, 500 мкл безводного ацетона, 40 мкл йодистого метила и выдерживали в термоблоке в течение 45 минут при 60 °С. После охлаждения виалы вскрывали, 200 мкл ацетонового раствора испаряли досуха в токе азота при 60 °С.
Алкилирование изопропилйодидом. К сухому остатку в реакционной виале прибавляли 20–25 мг прокаленного калия карбоната, 500 мкл безводного ацетона, 40 мкл изопропилйодида и выдерживали в термоблоке в течение 45 минут при 60 °С. После охлаждения виалы вскрывали, 200 мкл ацетонового раствора испаряли досуха в токе азота при 60 °С.
Алкилирование пентафторпропанолом. К сухому остатку в реакционной виале прибавляли 25 мкл 2,2,3,3,3-пентафторпропанола и 75 мкл 2,2,3,3,3-пентафторпропионового ангидрида и далее реакционную смесь подвергали СВЧ-излучению мощностью 560 Вт в течение 5 мин. После охлаждения реагенты испаряли досуха в токе азота при 60 °С. Сухой остаток растворяли в 200 мкл безводного этилацетата.
Ацетилирование. К сухому остатку в реакционной виале прибавляли 40 мкл безводного пиридина и 60 мкл уксусного ангидрида; реакционную смесь подвергали СВЧ-излучению мощностью 560 Вт в течение 5 мин. После охлаждения реагенты испаряли досуха в токе азота при 60 °С. Сухой остаток растворяли в 200 мкл безводного этилацетата.
Силилирование. К сухому остатку в реакционной виале прибавляли 100 мкл бис-триметилсилил-трифторацетамида (БСТФА), содержащего 1 % триметилхлорсилана, герметично укупоривали и помещали в термоблок на 30 минут при 80 °С. После охлаждения виалы вскрывали и 1 мкл исследуемого раствора вводили в хромато-масс-спектрометр с использованием устройства для автоматического ввода проб.
Алкилирование этанолом проводили действием пентафторпропионового ангидрида при добавлении к образцу этанола; процедуру дериватизации осуществляли под действием СВЧ-излучения мощностью 560 Вт в течение 4 минут.
Газохроматографические и масс-спектральные условия: Режим работы ГХ/МС для проб в условиях скрининга: температура инжектора и интерфейса 250 и 280 °С, температура колонки: начальная 70 °С в течение 2 мин и прогрев до 280 °С со скоростью программирования 20 град/мин; выдержка при температуре 280 °С в течение 12 минут, затем прогрев до 300 °С со скоростью программирования 20 град/мин; выдержка при конечной температуре 5 мин. Ввод без деления потока газа-носителя. Регистрация масс-спектров в режиме полного сканирования масс 45–450 а.е.
Результаты исследования и их обсуждение
Этап дериватизации сухих остатков после проведения ТФЭ из мочи необходим для дальнейшего определения методом ГХ полученных летучих производных метаболитов золпидема и продукта его гидролиза. Для определения гидроксиметаболитов золпидема возможно проведение ацетилирования, для карбоксиметаболитов и продукта гидролиза – алкилирования. Для всех метаболитов золпидема и продукта его гидролиза возможно получение их триметилсилильных эфиров.
В результате проведенных исследований стало возможным обнаружение метаболитов золпидема и продукта его гидролиза по полученным их газохроматографическим и масс-спектральным характеристикам, которые представлены в табл. 2.
Таблица 2
Газохроматографические и масс-спектральные характеристики производных метаболитов золпидема и продукта его гидролиза|
Метаболит |
Производное |
tR , мин |
Характеристические ионы, m/z (интенсивность, %) |
|
4'-ГМЗ |
СН3С(О)- |
20,60 |
293 (100); 233 (53); 294 (19,7); 365 (17,8); 271 (19,7); |
|
(СН3)3Si- |
19,46 |
323 (100); 324 (27,3); 73 (19,3); 233 (17,6); 395 (15,5); 234 (8,3); 249 (8); 154 (6,1); 293 (5,7); 396 (5,7); 219 (4,9); |
|
|
6-ГМЗ |
СН3С(О)- |
19,41 |
293 (100); 294 (15,9); 365 (9,4); 234 (7,5); 72 (5,5); 233 (5,4); 251 (5,1); 249 (4,5); 219 (3,9) |
|
(СН3)3Si- |
18,39 |
323 (100); 324 (27,1); 73 (10,8); 395 (9,4); 325 (7); 234 (5,9); 219 (5,2); 233 (4,9); 72 (3,1); 218 (3,1); 396 (2,8) |
|
|
4'-КЗ |
СН3- |
20,00 |
279 (100); 219 (29,1); 280 (21,5); 220 (15); 351 (13,1); 92 (4,7); 72 (4,1); 65 (4,1) |
|
СF3CF2СН2- |
17,28 |
397 (100); 219 (23,3); 398 (22); 220 (12,5); 469 (9,4); |
|
|
(СН3)3Si- |
22,08 |
337 (100); 338 (26,7); 73 (24); 219 (17); 220 (14,3); 409 (13); 161 (11,6); 221 (8,4); 339 (7,8); 394 (7,8); 110 (7,7); 124 (7,4) |
|
|
6-КЗ |
СН3- |
18,97 |
279 (100); 280 (20,3); 351 (11,1); 219 (6,4); 263 (4,5); 264 (3,9); 72 (3,5); 277 (3,2); 220 (2,9) |
|
СF3CF2СН2- |
16,52 |
397 (100); 398 (21,2); 469 (9,6); 219 (6,3); 72 (5,4); 381 (4,6); 220 (4,5); 205 (2,7) |
|
|
(СН3)3Si- |
19,96 |
337 (100); 338 (26,5); 409 (8,7); 339 (7,1); 219 (6,4); 220 (6,1); 72 (5,6); 73 (5,5); 205 (3,2); 394 (3,1); 321 (2,8); |
|
|
ЗГ |
СН3- |
8,62 |
235(100), 294(24), 219(12) |
|
СН3СН2- |
13,96 |
235(100), 308(27), 219(11) |
|
|
(СН3)2СН2- |
13,93 |
235(100), 322(19), 219(9) |
|
|
СF3CF2СН2- |
12,80 |
235(100), 412(25), 219(9) |
|
|
(СН3)3Si- |
13,76 |
235(100), 352(16), 219(10) |
При интерпретации масс-спектров полученных производных была выявлена закономерность, характерная для производных основных метаболитов золпидема, заключающаяся в том, что при их масс-фрагментации образуются соответствующие молекулярные ион-радикалы и фрагментные ионы [M-72]+, имеющие выраженные пики на хроматограммах (рисунок).
Применение того или иного вида дериватизации в каждой отдельно взятой химико-токсикологической или судебно-химической лаборатории зависит от ее технического и материального оснащения, сложившихся традиционных предпочтений и имеющихся в наличии масс-спектральных библиотек. Но необходимо отметить, что получение ТМС-производных удобно на практике, т.к. силилирование позволяет одновременно в одной пробе получить триметилсилильные эфиры гидрокси- и карбоксиметаболитов золпидема, а также продукта его гидролиза.
Заключение
Применение различных способов дериватизации в сочетании с ТФЭ для последующего ГХ/МС анализа позволяет выявить при совместном присутствии золпидем, его метаболиты, а также продукт гидролиза, которые значительно различаются по физико-химическим свойствам. Без дериватизации продукт гидролиза золпидема и ни один из его метаболитов не обнаруживается. Методики могут быть использованы на практике врачами клинической лабораторной диагностики химико-токсикологических лабораторий и врачами судебно-медицинскими экспертами бюро судебно-медицинской экспертизы.
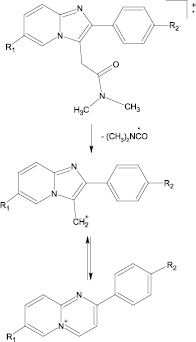
Схема образования и стабилизации иона [M-72]+ из молекулярного ион-радикала золпидема и производных его основных метаболитов (4’-ГМЗ, 6-ГМЗ, 4’-КЗ, 6-КЗ)
Рецензенты:
Михалев А.И., д.фарм.н., профессор, зав. кафедрой биологической химии, ГБОУ ВПО ПГФА Минздрава России, г. Пермь;
Гейн В.Л., д.х.н., профессор, зав. кафедрой общей и органической химии, ГБОУ ВПО ПГФА Минздрава России, г. Пермь.
Работа поступила в редакцию 26.03.2014.
Библиографическая ссылка
Крылова Е.А., Катаев С.С., Хомов Ю.А. ПРИМЕНЕНИЕ МЕТОДА ГАЗОВОЙ ХРОМАТОГРАФИИ – МАСС-СПЕКТРОМЕТРИИ ДЛЯ ОПРЕДЕЛЕНИЯ РАЗЛИЧНЫХ ДЕРИВАТОВ МЕТАБОЛИТОВ ЗОЛПИДЕМА И ПРОДУКТА ЕГО ГИДРОЛИЗА // Фундаментальные исследования. 2014. № 5-5. С. 1044-1048;URL: https://fundamental-research.ru/ru/article/view?id=34042 (дата обращения: 28.02.2026).