Ткани различных органов, как известно, не только осуществляют барьерные функции, но и содержат клетки и их продукты, обеспечивающие врожденный и адаптивный иммунитет, в частности участвующие в противоопухолевом иммунном надзоре. Иммунная система реализует свои эффекты в организме опухоленосителя не только на организменном, но и на локальном уровне. Участие в противоопухолевой защите различных клеточных и гуморальных факторов в настоящее время несомненно, при этом роль локального иммунитета остается недостаточно исследованной, хотя межклеточные контакты, включающие взаимодействия между иммунокомпетентными клетками и их возможными опухолевыми мишенями, осуществляются именно на локальном уровне. Данные литературы о патогенетическом и прогностическом значении лимфоцитарной инфильтрации злокачественных опухолей противоречивы; есть сообщения о том, что она может способствовать не только регрессии, но и росту опухоли [1, 10, 11, 13]. Практически не проводилось изучения факторов локального иммунитета при доброкачественных новообразованиях, считающихся предраковыми, а также их возможной роли в предотвращении или развитии процесса малигнизации.
Поскольку цитокины, продуцируемые активированными моноцитами, макрофагами, дендритными клетками, естественными киллерами, Т- и В-лимфоцитами и многими нелимфоидными клетками, участвуют в регуляции ангиогенеза, регенерации, пролиферации, апоптоза, метаболизма [1, 8, 9], они способны оказывать влияние на процессы, потенциально значимые для развития дисплазии и озлокачествления интенсивно пролиферирующей ткани. Продуцентами цитокинов могут быть клетки опухоли [1], а также ее микроокружения [8, 14]. Так, в настоящее время известно, что многие цитокины вырабатываются как моноцитами и/или лимфоцитами, так и опухолевыми клетками. IL-6, IL-8, IL-10, IL-1α и его рецепторный антагонист проявляют себя как факторы усиления опухолевой прогрессии, активирующие ангиогенез и миграцию опухолевых клеток; ТNF-α, способен демонстрировать как анти-, так и проонкогенные эффекты и, будучи индуктором неоангиогенеза и апоптоза, может вызывать усиление гибели лимфоцитов, находящихся на данной территории, и распространение туда опухолевых клеток. Напротив, интерфероны α и γ не только играют центральную роль в противовирусной защите организма, но и являются необходимыми компонентами системы иммунного надзора и регуляции опухолевого роста. Их эффекты осуществляются как прямым (индукция апоптоза опухолевых клеток, повышение экспрессии антигенов главного комплекса гистосовместимости МНС I класса на их мембране), так и опосредованным (активация NК-клеток, цитотоксических Т-лимфоцитов, макрофагов, подавление неоангиогенеза) путем [2]. Поскольку цитокины являются молекулами короткодистантного взаимодействия, их локальное содержание играет немаловажную роль в реализации межклеточных взаимодействий при развитии новообразований.
Полипы толстой кишки обоснованно считаются предраковыми заболеваниями. Частота их малигнизации, по данным различных авторов, колеблется от 1–4 % (одиночные полипы) до 20 % (множественные полипы); ворсинчатые аденомы малигнизируются в среднем в 40 % случаев [4, 6, 7, 12]. Основным методом лечения является хирургический с помощью иссечения или электроэксцизии при использовании лапаротомического или эндоскопического, в т.ч. трансанального доступа. Рецидивирование полипов в течение нескольких лет после их удаления достигает 4–5 %, а множественных, крупных, располагающихся на широком основании или ворсинчатых – до 14 %, причем описано возникновение рецидивов как на прежнем, так и в других местах. Такие результаты дают основание предположить, что причина рецидивирования и тем более малигнизации состоит не только в неполном удалении полипа и его травматизации, но и носит системный характер. Например, известен семейный полипоз толстой кишки, рассматривается роль вирусной инфекции в развитии полипов. С учетом вышеуказанных свойств цитокинов представляет интерес изучение возможной роли их локального содержания в развитии и малигнизации полипов толстой кишки, при этом следует учитывать, что влияние на их содержание может оказывать бактериальная и вирусная микрофлора, воспалительные процессы и пр. Кроме того, полипы и рак толстой кишки могут выявляться сочетанно в одном и том же ее отделе, и влияние злокачественной опухоли на состав тканевых цитокинов доброкачественной также представляется вероятным.
В данной работе было проведено сравнительное изучение содержания локального уровня некоторых цитокинов в ткани полипов и неизмененных участков толстой кишки.
Материалы и методы исследования
Исследовали ткани 67 больных (37 мужчин и 30 женщин), возраст 35–75 лет, метод и объем операции: эндоскопическая электроэксцизия при размере полипов до 2–3 см (45 больных), лапароскопическая колотомия при размере полипов больше 3 см (6 больных). Большинство полипов были одиночными, на широком основании, располагались в поперечно-ободочной кишке и ректосигмоидном отделе, по гистологическому строению – тубулярно-ворсинчнатая аденома I–III степени дисплазии. У 16 больных наблюдались сочетания полипов и рака толстой кишки (РТК), их оперировали, используя лапаротомический доступ. От каждого больного брали по 2 образца тканей: полип и перифокальную зону (ПЗ) – участок слизистой на расстоянии 0,5–1 см от полипа. Образцы тканей отмывали от крови, гомогенизировали, центрифугировали, в супернатантах определяли уровни интерферонов-α и -γ, интерлейкинов IL-1ß, IL-6, IL-8, TNF-α. ИФА-методом с помощью тест-систем фирмы «Вектор-Бест». В пробах гомогенатов определяли белок биуретовым методом; количество цитокинов, полученное в пг/мл, пересчитывали на 1 г белка, вычисляя таким образом удельное содержание каждого из них. Статистическую обработку проводили параметрическими (критерий Стьюдента) и непараметрическими (критерий Уилкоксона ‒ Манна ‒ Уитни) методами.
Результаты исследования и их обсуждение
Результаты представлены в табл. 1, 2. Применение различных методов удаления полипа отражается на содержании в его ткани регистрируемого количества цитокинов, что показано на примере интерферонов (табл. 1).
При применении метода эндоскопической электроэксцизии наблюдается более низкое их содержание, чем при лапаротомическом методе.
Сравнение показателей тканевого содержания интерферонов у больных, прооперированных различными методами, показало, что при лапаротомическом доступе содержание IFN-α и IFN-γ в ткани полипа статистически достоверно выше, чем при эндоскопической электроэксцизии, что можно объяснить большей травматизацией тканей. В обеих группах количество IFN-α в ткани полипа было статистически значимо выше, чем в ПЗ, а IFN-γ – не отличалось от нее.
Сопоставление показателей содержания цитокинов в ткани полипа и перифокальной зоны у больных при наличии или отсутствии рака в том же отделе толстой кишки, где найден полип, приведено в табл. 2.
Таблица 1
Удельное содержание интерферонов в тканях полипов и ПЗ при различных методах удаления полипов
|
Образцы тканей |
Количество (пг/г белка) |
||||
|
IFN-α |
IFN-γ |
||||
|
по группам |
суммарно |
по группам |
суммарно |
||
|
Полип при эндоскопической электроэксцизии (n = 45) |
Мin-max |
0,23–24,2 |
6,47 ± 0,54* |
0,74–50,2 |
3,52 ± 0,53 |
|
M ± m |
5,19 ± 0,8* ** |
3,16 ± 1,66** |
|||
|
Полип при лапаротомии (n = 6) |
Мin-max |
3,15-34,2 |
2,15–13,8 |
||
|
M ± m |
16,7 ± 5,49* ** |
7,43 ± 1,06** |
|||
|
ПЗ при эндоскопической электроэксцизии (n = 45) |
Мin-max |
0,16–8,56 |
1,39 ± 0,13 |
1,3–45,2 |
2,78 ± 0,69 |
|
M ± m |
0,89 ± 0,28** |
2,78 ± 0,69 |
|||
|
ПЗ при лапаротомии (n = 6) |
Мin-max |
0,17–8,3 |
1,79–9,3 |
||
|
M ± m |
4,48 ± 1,44** |
5,55 ± 1,33 |
|||
Примечания: * – статистически достоверные отличия от показателя перифокальной зоны; ** – статистически достоверные отличия в зависимости от способа удаления (Р < 0,05).
Таблица 2
Сравнительная характеристика удельного содержания тканевых цитокинов в полипах больных с наличием и отсутствием рака толстой кишки
|
Образцы тканей |
Удельное содержание цитокинов (пг/г белка) |
||||||||
|
IL-1ß |
IL-2 |
IL-6 |
IL-8 |
IL-10 |
TNF-α |
IFN-α |
IFN-γ |
||
|
Полипы при РТК (n = 16) |
Полип |
12,23 ± 3,3* |
1,8 ± 0,47 |
2,5 ± 0,8* |
8,9 ± 2,5 |
1,27 ± 0,28 |
0,79 ± 0,29 |
2,89 ± 0,89* |
1,12 ± 0,32* |
|
ПЗ |
9,76 ± 3,0 |
1,82 ± 0,30 |
1,69 ± 0,38** |
12,8 ± 6,2 |
1,13 ± 0,40 |
0,985 ± 0,56 |
2,65 ± 1,1 |
1,0 ± 0,29** |
|
|
Полипы без РТК (n = 51) |
Полип |
2,53 ± 1,4* |
1,28 ± 0,24 |
0,68 ± 0,33* |
9,55 ± 1,54 |
0,665 ± 0,36 |
1,02 ± 0,32 |
6,47 ± 0,54* |
3,52 ± 0,53* |
|
ПЗ |
4,4 ± 1,5 |
1,4 ± 0,55 |
0,46 ± 0,20** |
7,5 ± 2,3 |
1,08 ± 0,4 |
1,04 ± 0,26 |
1,39 ± 0,13 |
2,78 ± 0,69** |
|
Примечания: * – статистически достоверные различия между показателями больных обеих групп в ткани полипа; ** – статистически достоверные различия между показателями больных обеих групп в ткани перифокальной зоны (Р < 0,05).
При сравнении тканевого содержания цитокинов в полипах указанных больных обнаружен ряд различий (табл. 2). Так, в ткани полипов, выявленных на фоне рака, отмечены более высокие уровни IL-1ß и IL-6, последнего содержалось больше и в перифокальной зоне. Частота встречаемости IL-6 также была выше у больных с полипами и раком: в ткани полипа он выявлен во всех пробах таких больных, тогда как у больных с полипами без рака он был обнаружен в 2/3 образцов. Напротив, тканевые интерфероны при полипах на фоне рака толстой кишки выявлялись не у всех больных: из 16 больных IFN-α присутствовал у 11 в количестве 0,1–8,92 пг/г белка, IFN-γ – у 12 больных в количестве 0,11–3,16 пг/г белка в ткани полипа. В перифокальной зоне IFN-α найден у 13 больных в количестве 0,03–10,65 пг/г белка, а IFN-γ 0,1–3,27 пг/г белка соответственно. При полипах без рака оба вида интерферонов выявлены во всех исследованных образцах ткани как полипа, так и перифокальной зоны; их содержание было статистически достоверно выше, как представлено в табл. 2 (Р < 0,05). При выделении в отдельную группу 6 больных с полипами, прооперированных методом лапаротомии, аналогичным вмешательству при раке толстой кишки, различия по содержанию интерферонов оказались еще более выраженными (рисунок).
В перифокальной зоне удельное тканевое содержание интерферонов у больных при наличии, кроме полипа, верифицированного РТК, оказалось ниже, чем в соответствующем образце больных с полипами без рака, хотя статистически достоверные различия (Р < 0,05) обнаружены только для IFN-γ (табл. 2, рисунок).
Итак, ткань полипа у больных раком толстой кишки характеризуется более высоким локальным содержанием IL-1ß и IL-6 при более низком количестве интерферонов по сравнению с полипом, развившимся в отсутствии рака. Подобные особенности были ранее показаны нами для злокачественной опухоли по сравнению с окружающими ее тканями: в ткани рака толстой кишки находятся значительно более высокие уровни цитокинов, особенно провоспалительных (TNF-α, IL-1, IL-6, IL-8), чем в перитуморальной области и неизмененной ткани, взятой по линии резекции [3]. В ткани аденоматозных полипов по сравнению с тканью рака толстой кишки содержание данных цитокинов существенно меньше; кроме того, в перифокальной зоне при полипе уровень IL-6 ниже, а IL-2 выше, чем в соответствующей области рака толстой кишки [5].
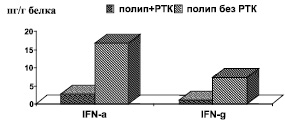

Сравнительная характеристика удельного содержания интерферонов в полипе толстой кишки и его перифокальной зоне при наличии и при отсутствии рака
Заключение
Полученные в настоящей работе данные свидетельствуют о возможности дистантного влияния злокачественной опухоли на одновременно развивающуюся в том же отделе толстой кишки доброкачественную, приводящего к повышению в ткани полипа уровня цитокинов, способствующих пролиферации, прогрессии и распространению, наряду со снижением содержания противовирусных и антиангиогенных факторов. Результаты позволяют предположить, что локальный цитокиновый статус формируется и/или контролируется более агрессивно растущей опухолью.
Рецензенты:
Каймакчи О.Ю., д.м.н., ассистент кафедры онкологии Ростовского государственного медицинского университета, г. Ростов-на-Дону;
Шихлярова А.И., д.б.н., профессор, главный научный сотрудник Южного научного центра РАН, г. Ростов-на-Дону.
Работа поступила в редакцию 26.03.2014.
Библиографическая ссылка
Златник Е.Ю., Никипелова Е.А., Терпугов А.Л., Максимов А.Ю., Селютина О.Н., Закора Г.И. ЦИТОКИНОВЫЙ СОСТАВ ТКАНИ ПОЛИПОВ ТОЛСТОЙ КИШКИ // Фундаментальные исследования. 2014. № 5-5. С. 1016-1020;URL: https://fundamental-research.ru/ru/article/view?id=34036 (дата обращения: 28.02.2026).



