Увеличение количества кардиохирургических операций на открытом сердце, проводимых для коррекции клапанных пороков различной этиологии, влечет за собой необходимость поиска маркеров прогноза и оценки качества течения раннего послеоперационного периода у данной категории пациентов. Системный воспалительный ответ (СВО) является одним из типовых патофизиологических процессов, направленных на репарацию тканей после массивного повреждения, в том числе и после операций на открытом сердце, проводимых в условиях искусственного кровообращения.
Определение уровня провоспалительных и противовоспалительных цитокинов в настоящее время широко применяется с исследовательской и практической целью. Другим, широко используемым биохимическим маркером системной воспалительной реакции, является прокальцитонин. Прокальцитонин (ПКТ) традиционно трактуется как маркер развития инфекционного процесса [1, 6], а также индикатор полиорганной недостаточности при осложнённом течении СВО [3, 7]. Однако наибольшую диагностическую ценность представляет только динамическое наблюдение за уровнем этих биологически активных веществ [2].
Исходя из вышеизложенного, целью нашего исследования явилась оценка значимости определения концентраций маркеров острого воспаления: прокальцитонина (ПКТ) и интерлейкина 1β (ИЛ1β) в раннем послеоперационном периоде у пациентов, перенесших операцию по протезированию клапанов сердца в условиях искусственного кровообращения.
Материалы и методы исследования
В исследование включены пациенты с верифицированным диагнозом инфекционного эндокардита, подвергшихся оперативному вмешательству на открытом сердце в условиях искусственного кровообращения в объёме клапанного протезирования на базе ФГБУ «НИИ КПССЗ» СО РАМН г. Кемерово, Россия, с 2010 по 2013 годы.
Критериями включения в группу исследования являлись установленный клинически и инструментально диагноз инфекционного эндокардита, возраст не менее 20 и не более 70 лет, подписанное информированное согласие на участие в исследовании; критериями исключения служили: смена диагноза по результатам морфологического исследования удаленных тканей, сочетанные операции, молодой (младше 20 лет) и преклонный (старше 70 лет) возраст, наличие в анамнезе злокачественных новообразований, отказ от участия в исследовании, развитие в послеоперационном госпитальном периоде (до момента выписки) осложнений инфекционного генеза (сепсис и другие похожие состояния).
Диагноз инфекционного эндокардита установлен на основании клинической картины, анамнестических данных и клинико-лабораторных методов исследования (трехкратные посевы гемокультур, данные ЭХО-кардиографии, результаты гистологического исследования удалённых во время операции тканей клапанов сердца).
Всего в группу исследования включено 110 пациентов (71 мужчина (64,5 %) и 39 женщин (35,5 %). Средний возраст пациентов составил 49 лет (от 20 до 70 лет).
Все пациенты прошли предоперационную подготовку (в том числе курс антибиотикотерапии), находились в «холодном периоде» основного заболевания (степень активности инфекционного эндокардита на момент операции была минимальна), были компенсированы по степени ХСН (не более IIБ стадии по Василенко-Стражеско, ФК ХСН от I до III) и подверглись оперативному вмешательству в объеме протезирования клапана сердца в условиях искусственного кровообращения (ИК). Летальность во всей анализируемой группе составила 3,6 % (4 человека). Летальные исходы являлись результатом прогрессирования осложнений синдрома системного воспалительного ответа, развития необратимых вариантов полиорганной недостаточности и зарегистрированы на 12, 13, 15 и 17 сутки после операции.
По характеру течения раннего послеоперационного периода пациенты были разделены на три группы. Наличие СВО в послеоперационном периоде оценивали по критериям R.Bone [4], степень тяжести состояния пациента – по шкале APACHE II (Acute Physiology And Chronic Helth Evalution) [4], степень органной дисфункции по шкале SOFA (Sepsis-Related Organ Failure Assessment) [9].
1-ю группу (без осложнений) сформировали из 38 (34,6 %) пациентов с неосложненным течением послеоперационного периода – не более двух признаков СВО по Bone R.С., оценка по APACHE II не более 1 балла, SOFA – 0–1 балл. Во 2-ю группу (осложненный СВО) вошли 47 (42,7 %) пациентов с клинической картиной осложнённого течения СВО (3 и более критерия по Bone R.С.), APACHE II 2–3 балла в первые сутки после операции, SOFA – 1–2 балла (проявления компенсированной органной недостаточности, которая разрешилась к 7-м суткам послеоперативного периода). И 25 человек (22,7 %) (включая 4-х пациентов с летальным исходом) составили 3-ю группу (СВО с СПОН), характеризующуюся проявлениями СВО и декомпенсированной полиорганной дисфункцией (3 и более признака СВО по Bone R.С., APACHE II 3–4 балла и более 3 баллов по шкале SOFA, в период до 7-х суток после операции).
Кровь забирали из центральной локтевой вены в вакуумные коммерческие пробирки с активатором свёртывания. После отделения сыворотки методом центрифугирования производили аликвотирование в стерильные микроцентрифужные пластиковые пробирки типа «Эппендорф», хранили до проведения исследования в морозильной камере при –70 °C. Концентрацию ИЛ1β и ПКТ в сыворотке крови определяли методом твердофазного иммуноферментного анализа с использованием коммерческих наборов «Human-IL1β» BenderMedSystems (USA) и «Human Procalcitonin» Ray Biotech (USA), предназначенных для научных исследований. Измерение концентраций производилось трёхкратно: 1-я точка контроля ‒ на дооперационном этапе, 2-я в 1-е и 3-я на 7-е сутки после операции. В работе применялся пакет программного обеспечения Statistica 6.0. (StatSoftInc., США Серийный номер: AXXR003E608729FAN10). Статистический анализ проводили непараметрическими методами: Фридмана ANOVA, Вилкоксона, Крускала–Уолиса, Манн–Уитни U-тест. Результаты выражали в виде медианы (МЕ) и 25 и 27 % межквартильных отклонений (25Q; 75Q). Различия приняли считать значимыми при уровне р < 0,01.
Результаты исследования и их обсуждение
До операции концентрации ПКТ во всех группах исследования находились на одном уровне (Н = 0,86, р = 0,65). Полученные концентрации отражены в таблице.
Полученные результаты могут свидетельствовать об отсутствии системной инфекции [6] у всех обследованных пациентов на дооперационном этапе наблюдения. Однако активность воспалительного статуса в первой группе в этот момент была ниже. Это отражается на определяемых в дооперационном периоде уровнях ИЛ1β. Так, во 2-й и в 3-й группах концентрации ИЛ1β значимо (р < 0,001; р < 0,001) превышали таковые группы без осложнений.
В дальнейшем динамика уровней ПКТ для 1-й группы характеризовалась значимым (р = 0,0089) увеличением концентрации в 1-е сутки по отношению к дооперационному уровню. На 7-е сутки концентрации возвращались к исходным (р = 0,97).
Колебания уровней ИЛ1β в этой группе имели сходный с динамикой ПКТ характер (рисунок). Так, концентрации ИЛ1β в 1-е сутки после операции значимо (р < 0,001) увеличивались, а на седьмые сутки возвращались к исходным значениям (р = 0,32).
Концентрации ПКТ, определяемые на всем протяжении периода наблюдения в трёх анализируемых группах, в нг/мл
|
Группа |
До операции |
1-е сутки |
7-е сутки |
|
Без осложнений (n = 29) |
0,45 (0,29; 0,63) |
0,45 (0,38; 0,52) |
0,39 (0,35; 0,52) |
|
Осложненного СВО (n = 33) |
0,72 (0,41; 1,32) |
0,44 (0,40; 0,65) |
0,68 (0,46; 0,85) |
|
СВО с СПОН (n = 16) |
0,38 (0,25; 0,79) |
0,44 (0,39; 0,52) |
6,07 (3,25; 9,24) */**/***/**** |
Примечания:
* – значимые (р < 0,01) отличия от группы без осложнений в данное время;
** – значимые (р < 0,01) отличия от группы осложненного СВО в данное время;
*** – значимые (р < 0,01) отличия от значений в группе до операции;
**** – значимые (р < 0,01) отличия от группы в группе на 1-е сутки.
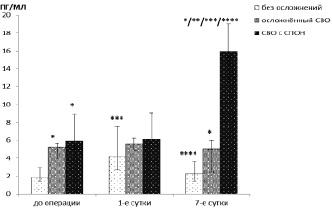
Рис. 1. Динамика ИЛ-1 в раннем послеоперационном периоде, пг/мл. Примечание: * – значимые (р < 0,01) отличия от группы без осложнений в данное время; ** – значимые (р < 0,01) отличия от группы осложненного СВО в данное время; ** – значимые (р < 0,01) отличия от значений в группе до операции; **** – значимые (р < 0,01) отличия от группы в группе на 1-е сутки
При этом известно, что полостная операция и ИК служат факторами индукции синтеза и повышения концентрации ПКТ в плазме крови [8], а изменение продукции ИЛ1β иммунокомпетентными клетками в сторону увеличения играет ключевую роль в патогенезе формирования воспаления. Соответственно, выявленная в анализируемой группе волнообразная динамика изменений ПКТ и ИЛ1β, с достоверным приростом в 1-е сутки после операции и возвращением к исходным уровням на 7-е, является показателем фазовости воспаления и закономерна в патогенезе СВО как процесса, направленного на восстановление гомеостаза.
В отношении уровней ПКТ и ИЛ1β в группе с клиническими проявлениями осложнённого СВО нами было выявлено отсутствие динамических изменений обоих анализируемых параметров на всем протяжении наблюдения. Так, для ПКТ χ2 = 1,27, р = 0,52, а для ИЛ1β в этой группе χ2 = 3,58, р = 0,17 (5,18 (3,96; 5,57) пг/мл, 5,69 (5,13; 6,35) пг/мл и 5,02 (2,47; 5,86) пг/мл в хронологическом порядке.
Отсутствие лабораторных данных за развитие воспалительной реакции в 1-е сутки послеоперационного периода у этих пациентов позволяет предположить неадекватность иммунного ответа, его анергию, что находит подтверждение в клинических проявлениях и затяжном характере течения воспалительного ответа.
В группе с СПОН в первые сутки после операции ПКТ и ИЛ1β оставались на уровне, определяемом до операции (р = 0,093 и р = 0,81 соответственно). На седьмые сутки определялось значимое (р = 0,0051) 9-кратное увеличение концентраций ПКТ с 0,39 (0,35; 0,52) мг/мл до операции и 0,68 (0,46; 0,85) мг/мл в 1-е сутки до 6,08 (3,25; 9,24) мг/мл). Однако концентрации ПКТ не достигали уровней наблюдаемых при септических состояниях (более 25 мг/мл) [1]. Сходная динамика отмечалась и для концентраций ИЛ1β. Так, в первые сутки уровень ИЛ1β не превышал дооперационный (6,12 (5,67;9,08) пг/мл, р = 0,81), а на седьмые сутки значимо (р = 0,005) возрастал. Прирост концентраций ИЛ1β был трёхкратным по отношению к концентрациям до операции и находился в диапазоне 15,96 (12,45; 18,98) пг/мл.
Сопоставляя концентрации, определяемые в разных группах, определили, что уровни ИЛ1β имели значимые различия на всем протяжении послеоперационного периода (Н = 26,18, < 0,0001 на дооперационном этапе, Н = 7,33, р = 0,026 в 1-е сутки после операции и Н = 34,87, р < 0,0001 на 7-е сутки). При этом в 1-й группе концентрации были самыми низкими (р < 0,0001, р = 0,012, р < 0,0001 относительно второй группы и р < 0,0001, р = 0,011, р = 0,0018, р < 0,0001 относительно группы со СПОН, соответственно трем временным точкам наблюдения). Тогда, как отличия в концентрациях между группой с осложнённым СВО и группой со СПОН наблюдались только на седьмые сутки (р < 0,0001).
Отсутствие разницы в уровнях ПКТ между всеми группами в 1-ю точку наблюдения (Н = 0,86, р = 0,65) позволяет предположить, что пациенты этих групп до операции находились в одинаковом противоинфекционном статусе. Достоверное отличие в определяемых концентрациях мы наблюдали на 7-е сутки, когда уровни ПКТ в группе СВО с СПОН в 16 раз превысили концентрации в группе без осложнений и в 14 раз – в группе с осложненным СВО (р < 0,0001 и р < 0,0001 в обоих случаях).
Выводы
Определение уровней ПКТ и ИЛ1β в динамике и анализ колебаний концентраций этих аналитов в раннем периоде у пациентов с ИЭ после протезирования клапанов сердца в условиях ИК имеют прогностическую значимость в мониторинге течения СВО.
Информационную ценность представляет определение концентраций ИЛ1β более 5,0 пг/мл на этапе обследования до проведения хирургического лечения, а также отсутствие положительной динамики данного маркера в 1-е сутки после операции.
Величина уровня концентраций ПКТ в первые сутки после операции у пациентов без системной инфекции не достигает критических значений. Однако одновременное определение высоких, относительно уровней дооперационного периода, уровней как ПКТ, так и ИЛ1β имеет прогностическое значение в отношении формирования неконтролируемого системного воспалительного ответа с последствиями в виде органных дисфункций.
Рецензенты:
Лисаченко Г.В., д.м.н., профессор кафедры патологической физиологии, ГОУ ВПО «Кемеровская государственная медицинская академия» Минздрава Российской Федерации, г. Кемерово;
Коростелёв А.А., д.м.н., профессор кафедры оториноларингологии и клинической иммунологии, ГОУ ВПО «Кемеровская государственная медицинская академия» Минздрава Российской Федерации, г. Кемерово.
Работа поступила в редакцию 03.04.2014.
Библиографическая ссылка
Понасенко А.В., Хуторная М.В., Головкин А.С., Кондюкова Н.В., Сардин Е.С., Григорьев Е.В. ПРОКАЛЬЦИТОНИН И ИНТЕРЛЕЙКИН 1β КАК МАРКЕРЫ ТЕЧЕНИЯ ПОСЛЕОПЕРАЦИОННОГО ПЕРИОДА У ПАЦИЕНТОВ С ПРОТЕЗИРОВАННЫМИ КЛАПАНАМИ СЕРДЦА // Фундаментальные исследования. 2014. № 4-3. С. 589-592;URL: https://fundamental-research.ru/ru/article/view?id=33966 (дата обращения: 28.02.2026).



