Болевой синдром сопровождает значительное количество заболеваний и является, по данным ВОЗ, наиболее частой причиной (от 11 до 40 %) обращения человека за медицинской помощью [2, 3].
Несмотря на существование достаточно широкого выбора различных методов медикаментозного и немедикаментозного обезболивания, при хирургических вмешательствах под общей анестезией боль возникает в зоне операционной раны сразу после пробуждения и сохраняется в послеоперационном периоде. Известно, что на данном этапе оперативного лечения на наличие боли средней и сильной интенсивности жалуется от 33 до 75 % пациентов [1,3]. Распространенность же психоэмоциональных нарушений среди пациентов с хронической болью находится в пределах от 30 до 87 %[1].
Цель исследования – изучить эффективность используемых схем послеоперационной анальгезии во взаимосвязи с психоэмоциональным статусом и уровнем цитокинемии пациентов после эндопротезирования коленного и тазобедренного суставов.
Материалы и методы исследования
В ходе проспективного сравнительного клинического исследования 54-м пациентам выполнено эндопротезирование коленного (n = 26) или тазобедренного (n = 28) сустава в условиях спинальной анестезии с дополнительной седацией. Пациенты в обеих группах были сопоставимы по полу, возрасту и сопутствующим заболеваниям. В качестве седативного компонента использовались бензодиазепины (диазепам в средней дозе 0,2–0,1 мг/кг). Через 30 минут после премедикации в стерильных условиях, под местной анестезией 2 % раствором лидокаина выполнялсь спинальная пункция с одномоментной катетеризацией эпидурального пространства. Для спинальной анестезии использовали 0,5 % раствор бупивакаина (маркаин spinal) – 15–20 мг. У всех пациентов достигнут удовлетворительный спинальный блок. В течение операции никому из больных, включённых в исследование, местный анестетик в эпидуральное пространство не вводился.
Продолжительность спинального блока в среднем составила 4,2 ± 1,1 ч, а оперативного вмешательства 2,3 ± 0,7 ч. Согласно дизайну исследования сформировано 2 группы. В контрольной группе (группа № 1) пациентам (n = 27) проводилась послеоперационная в/м анальгезия НПВП (кеторол 30 мг 3 раза в сутки в/м) в сочетании с опиатами (промедол 20 мг в/м по требованию) и продленной эпидуральной анальгезией (0,2 % раствор ропивакаина интраэпидурально микроструйно 6–14 мл/ч, после окончания спинального блока и выполнения тестовой дозы 0,5 % раствора ропивакаина в объеме 2 мл). Пациентам основной группы (n = 27) (группа № 2) дополнительно проводилась местная однократная анальгезия послеоперационной раны раствором ропивакаина 0,5 % – 20 мл (100 мг) в конце операции.
Критерии оценки и контроль эффективности
Для контроля эффективности анальгезии использовались следующие методики:
1. Оценка интенсивности боли по визуально-аналоговой шкале (ВАШ), измеряется в баллах (1 сантиметр = 1 балл), выполнялась 4 раза (перед операцией, сразу после операции, через 4 часа после операции, 1-е сутки после операции).
2. Расход использованного опиоидного анальгетика тримеперидина (промедола) в миллиграммах.
3. Плазменная концентрация интерлейкинов (IL-1 бета, raIL-1, TNF-a) исследовалась 4 раза (перед операцией, сразу после операции, через 4 часа после операции, 1-е сутки после операции);
4. Уровень кортизола сыворотки (перед операцией и на 1-е сутки после эндопротезирования).
Результаты исследования и их обсуждение
При анальгезии пациентов после ЭТС и ЭКС (рис. 1) средний исходный уровень интенсивности боли по шкале ВАШ достоверно не различался и составил: в 1-й группе 3,5 ± 5,7 балла, а во 2-й группе – 3,7 ± 0,13 балла. После окончания операции интенсивность боли оказалась достоверно меньше на 80 % у пациентов с инфильтрацией послеоперационной раны (2-я группа) – 0,2 ± 0,04 балла, чем у пациентов 1-й группы – 1,0 ± 0,47 балла. Через 4 часа значимая разница в интенсивности болевого синдрома сохранялась: 2,4 ± 0,43 балла в 1-й и 1,3 ± 0,25 балла в 2-й группе (p < 0,05). К окончанию первых суток после операции сила болевых ощущений по ВАШ в 1-й группе оценивалась в 3,5 ± 0,52 балла, а в группе с местной анальгезией послеоперационной раны на 45,7 % меньше – 1,9 ± 0,37 балла (p < 0,05). Введение в схему мультимодальной анальгезии инфильтрации послеоперационной раны позволяет достоверно снизить интенсивность болевого синдрома [8, 9].
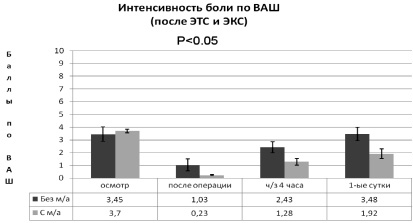
Рис. 1. Динамика интенсивности боли по шкале ВАШ в зависимости от схемы послеоперационной анальгезии
Количество использованного опиоидного анальгетика (рис. 2) в 1-й группе за первые сутки составило 50,4 ± 3,95 мг. При применении однократной местной анальгезии послеоперационной раны в схеме мультимодального обезболивания количество опиоидного анальгетика (промедол) во 2-й группе составило 32,3 ± 5,84 мг. Таким образом, болюсная инфильтрация краев послеоперационной раны 0,5 % раствором ропивакаина обеспечивала более адекватную анальгезию и заметное снижение потребности в парентеральном введении промедола на 35,9 % (p < 0,05).
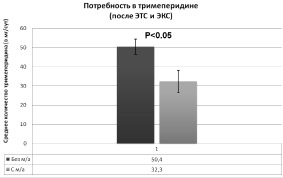
Рис. 2. Зависимость потребности в опиоидных анальгетиках (тримеперидин) от схемы послеоперационного обезболивания
Анализ динамики содержания IL-1 бета в периферической крови пациентов после ЭТС и ЭКС (рис. 3) выявил различный исходный уровень IL-1 бета (1-я группа – 0,48 ± 0,23 pg/ml, 2-я группа – 1,49 ± 0,52 pg/ml). Однако сразу после операции концентрация IL-1 бета в группе № 1 достоверно не изменилась (снижение на 6,3 %, до 0,45 ± 0,23 pg/ml), а в основной группе № 2 – на 23,5 % (до 1,14 ± 0,36 pg/ml, p < 0,05). Через 4 часа после ортопедического вмешательства в группе пациентов без местной анальгезии раны уровень IL-1 бета снизился до 0,26 ± 0,19 pg/ml (на 42,2 %) (p < 0,05). В группе № 2 уменьшение составило 27,2 %, до уровня 0,83 ± 0,29 pg/ml (p < 0,05). На 1-е сутки концентрация IL-1 бета в периферической крови пациентов после ЭТС и ЭКС в группе № 2 достоверно не изменилась, уменьшение до 0,82 ± 0,32 pg/ml, на 1,2 %, p > 0,05. Однако в группе без местной анальгезии к 1-м суткам уровень IL-1 бета увеличился на 36,6 %, до 0,41 ± 0,2 pg/ml (p < 0,05). Использование инфильтрационной анальгезии раны вызывает достоверное уменьшение системной концентрации IL-1 бета в первые 4 часа после ЭТС и ЭКС [6, 7].
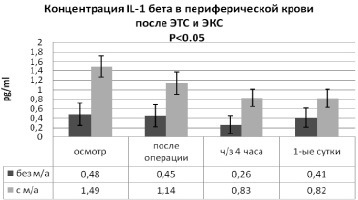
Рис. 3. Сравнительный анализ динамики концентрации IL-1 в периферической крови пациентов после ЭТС и ЭКС
Исходный уровень raIL-1 в периферической крови пациентов (рис. 4) 1-й группы перед операцией составила 1340,89 ± 655,32 pg/ml, а у пациентов 2-й группы на 32,4 % больше (1983,34 ± 478,4 pg/ml). После хирургического вмешательства концентрация raIL-1 в 1-й группе снизилась на 26,5 % (до 985,57 ± 214,44 pg/ml), а при использовании однократной местной анальгезии – увеличилась на 32,3 % (до 2930,32 ± 773,65 pg/ml) (p < 0,05). Данный факт свидетельствует о том, что на фоне болюсной инфильтрации тканей операционной раны 0,5 % раствором ропивакаина уже сразу после операционной травмы регистрируется тенденция к повышению содержания в крови рецепторного антагониста противовоспалительного медиатора raIL-1, уровень которого через 4 часа увеличивался уже статистически значимо. Содержание антагониста рецептора IL-1 через 4 часа после операции повышается в обеих группах: в 1-й – до 1403,31 ± 303,98 pg/ml, во 2-й – до 3275,39 ± 650,33 pg/ml (p < 0,05). Пик концентрации raIL-1 приходится на 3-ю контрольную точку (через 4 часа после эндопротезирования). У пациентов группы сравнения уровень данного цитокина повышается на 4,4 % (p < 0,05), а при использовании местной анальгезии – на 39,4 % (p > 0,05). К концу 1-х суток после хирургического вмешательства у пациентов 1-й группы концентрация raIL-1 снизилась на 13,2 % (до 1217,97 ± 274,35 pg/ml), а у 2-й группы на 16,6 % (до 2731,19 ± 317,15 pg/ml). Таким образом, уровень данного противовоспалительного медиатора у пациентов, получавших однократную инфильтрационную анальгезию послеоперационной раны, на данном этапе исследования оказался в 2,24 раза выше, чем в 1-й группе (p < 0,05) [5, 6].
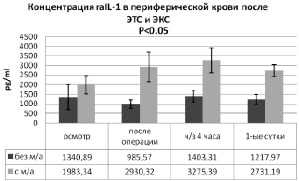
Рис. 4. Сравнительный анализ динамики концентрации raIL-1 в периферической крови пациентов после ЭТС и ЭКС
При анализе значений уровня TNF-a (рис. 5) в группе пациентов с местной анальгезией (2-я группа) наблюдалась более высокая исходная концентрация (1,52 ± 0,54 pg/ml) данного провоспалительного цитокина по сравнению с контрольной группой – 0,68 ± 0,28 pg/ml (p < 0,05). После окончания операции наблюдалось повышение концентрации TNF-a (на 34,5 %) у пациентов 2-й группы до 2,32 ± 1,13 pg/ml (p < 0,05). Однако в первой группе оперированных пациентов после хирургического вмешательства происходило более выраженное, в 2,2 раза от фонового значения, увеличение уровня данного провоспалительного цитокина.
Через 4 часа после операции у пациентов 1-й группы отмечено дальнейшее увеличение концентрации TNF-a (на 16,5 %) до 1.76 ± 0,83 pg/ml, а в группе № 2 – наоборот – резкое снижение уровня данного медиатора (в 2,01 раза) до 1,15 ± 0,59 pg/ml. Таким образом, у исследуемых больных, получавших однократную инфильтрационную анальгезию послеоперационной раны, уровень TNF-a оказался достоверно меньше, чем у лиц контрольной группы в 3-й контрольной точке (p < 0,05). На первые сутки после хирургического вмешательства у пациентов 1-й группы концентрация TNF-a снизилась на 29,5 % (до 1,24 ± 0,51 pg/ml, p < 0,05), а во 2-й группе – на 4,3 % (до 1,1 ± 0,55 pg/ml). Сопоставляя в целом медиаторный ответ, можно утверждать, что инфильтрация операционной раны ропивакаином создаёт условия для большего контроля над воспалительной реакцией в ответ на хирургическую травму в течение 1-х суток послеоперационного периода. Ограничение излишнего воспаления обеспечивается меньшей стимуляцией выброса TNF-a и более высоким содержанием в системной циркуляции рецепторного антагониста IL-1. Установленные изменения баланса медиаторов, участвующих в реакции воспаления, ассоциируют со снижением интенсивности болевого синдрома, связанного с травматичным оперативным вмешательством.
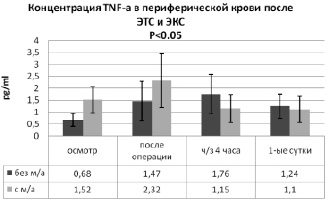
Рис. 5. Сравнительный анализ динамики концентрации TNF-a в периферической крови пациентов после ЭТС и ЭКС
При анализе динамики уровня кортизола в периферической крови пациентов после эндопротезирования коленного и тазобедренного суставов (рис. 6) выявлено увеличение данного гормона в 1-й и 2-й группах. У пациентов без местной анальгезии (группа № 1) уровень кортизола к 1-м суткам увеличился на 23,2 % – с 466,63 ± 72,77 нмоль/л до 607,72 ± 104,54 нмоль/л. Во 2-й группе исследуемых при однократной инфильтрации раны местным анестетиком подъем концентрации кортизола составил 20,1 % – с 489,68 ± 82,57 до 612,56 ± 82,65 нмоль/л. Сравнение динамики кортизола у пациентов 1-й и 2-й групп не выявило достоверных различий в обеих контрольных точках (p > 0,05).
Учитывая полученные результаты, можно достоверно утверждать об отсутствии влияния однократного введения 0,5 % раствора ропивакаина в рану на системный уровень кортизола в первые сутки после эндопротезирования крупных суставов нижних конечностей.
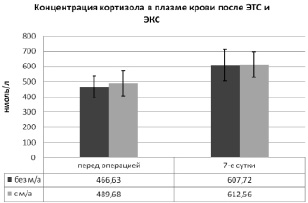
Рис. 6. Сравнительный анализ динамики концентрации кортизола в периферической крови пациентов после ЭТС и ЭКС
Выводы
1. Использование в схеме мультимодального обезболивания однократной инфильтрации операционной раны 0,5 % раствором ропивакаина при тотальном эндопротезировании крупных суставов нижних конечностей обеспечивает в течение первых суток послеоперационного периода более высокий уровень анальгезии и позволяет значительно снизить дозу тримеперидина.
2. Введение в операционную рану 0,5 % раствора ропивакаина создаёт условия для большего контроля над воспалительной реакцией в ответ на хирургическую травму. Изменения баланса медиаторов, участвующих в реакции воспаления, сочетаются со снижением интенсивности послеоперационного болевого синдрома.
Рецензенты:
Куликов А.В., д.м.н., профессор кафедры анестезиологии и реаниматологии, ГБОУ ВПО УГМА Минздрава России, г. Екатеринбург;
Герасимов А.А., д.м.н., профессор, зав. кафедрой медицины катастроф, ГБОУ ВПО УГМА Минздрава России, г. Екатеринбург.
Работа поступила в редакцию 01.04.2014.
Библиографическая ссылка
Комкин В.А., Бабушкин В.Н., Жирова Т.А., Руднов В.А. МЕСТНАЯ ОДНОКРАТНАЯ ИНФИЛЬТРАЦИОННАЯ АНАЛЬГЕЗИЯ ПОСЛЕОПЕРАЦИОННОЙ РАНЫ У ПАЦИЕНТОВ ПОСЛЕ ЭНДОПРОТЕЗИРОВАНИЯ КОЛЕННОГО И ТАЗОБЕДРЕННОГО СУСТАВОВ // Фундаментальные исследования. 2014. № 4-3. С. 524-529;URL: https://fundamental-research.ru/ru/article/view?id=33952 (дата обращения: 28.02.2026).



