Изучение механизмов регенерации конечностей у позвоночных является актуальной проблемой в биологии, которая в значительной степени связана с исследованием клеточных источников регенерации в тканях мезенхимного происхождения. В этом аспекте большое значение имеет разработка новых экспериментальных моделей, способствующих пониманию механизмов, лежащих в основе процессов восстановления и репарации. Органотипическое роллерное культивирование тканей позвоночных представляется весьма перспективным для изучения клеточных источников регенерации в тканях, а также поиска биологически активных веществ, способных влиять на их активацию.
Ранее было установлено, что при роллерном типе культивирования тканей мозга, сетчатки и роговицы глаза позвоночных in vitro в них происходит дополнительная активация клеточных источников регенерации [1, 13]. Кроме того, было показано, что в данных условиях культивирования биологически активные вещества, относящиеся к новой группе мембранотропных гомеостатических тканеспецифических биорегуляторов (МГТБ), вызывают в сверхмалых дозах, соответствующих 10–8–10–12 мг, дополнительную активацию клеточных источников регенерации [7]. Ранее было установлено, что биорегуляторы данной группы имеют внеклеточную локализацию. В сверхмалых дозах (СМД) они влияют на клеточную адгезию, миграцию, пролиферацию и дифференцировку, а также оказывают протекторное действие на ткань и увеличивают жизнеспособность клеток при культивировании in vitro. Активность МГТБ характеризуется наличием тканевой, но отсутствием видовой специфичности [7]. Ранее было продемонстрировано, что сывороточный МГТБ стимулирует восстановление и репарацию кожных ран в эксперименте, оказывает протекторное действие на ткань кожи тритона при ее органотипическом роллерном культивировании in vitro [5, 14].
Результаты исследования состава и строения МГТБ показали, что они представляют собой пептидно-белковые комплексы, причем за проявление биологического действия ответственны небольшие пептиды, активность которых модулируют связанные с ними белки-модуляторы [7]. Наиболее изученным в этом аспекте является биорегулятор, выделенный из сыворотки крови быка, основу которого представляет комплекс, образованный пептидами с мол. массой 1666 ± 2; 1812 ± 3; 1915 ± 2; 2016 ± 2 Да, а также изоформой сывороточного альбумина (неизученная форма преальбумина сыворотки крови быка: мол. масса 67854,8 Да; pI 3,90-3,93; N-концевой аминокислотный мотив Ала – Про – Лиз – Лиз – Сер – Глу – Иле – Ала – Лей – Фен) [7]. Для биорегулятора, выделенного из костной ткани, основным действующим веществом является пептид с мол. массой 4301 ± 2 Да [4]. Было установлено, что у пептидов, входящих в состав МГТБ, блокирован N-концевой фрагмент.
Целью настоящего исследования явилась разработка новой модели роллерного органотипического культивирования регенерата хвоста тритона in vitro для изучения специфического биологического действия МГТБ, выделенных из сыворотки крови и костной ткани млекопитающих.
Материалы и методы исследования
Химические реактивы, применяемые в работе, были марки не ниже ХЧ, производства Serva (Германия), Sigma (США), Реахим (Россия), Merk (Германия). Для приготовления всех водных растворов использовалась дистиллированная деионизованная вода (система очистки MilliQ, сопротивление 16–18 МОм).
Крысы линии Wistar (180–230 г, обоего пола), мыши F1 линий СВА/С57Bl (16–20 г, обоего пола) содержались в виварии, а тритоны Pleurodeles waltl обоего пола, используемые в данном исследовании, содержались в аквариальной Института биологии развития имени Н.К. Кольцова РАН.
Для получения высокоочищенной фракции сывороточного биорегулятора использовали сыворотку крови крупного рогатого скота (30 л) – стерильный, инактивированный коммерческий препарат производства ФГУП «Предприятие по производству бактерийных и вирусных препаратов Института полиомиелита и вирусных энцефалитов им. М.П. Чумакова РАМН», применяемый в качестве добавки к ростовой среде клеточных культур.
Для получения экстракта костной ткани использовали бедренные и большие берцовые кости крыс, у которых предварительно удаляли эпифизы и костный мозг. Кости промывали и экстрагировали, используя водно-солевой раствор состава: 0,15 М NaCl; 1 мM CaCl2; 5 мM KCl; 1 мM HEPES, (40 г костной ткани – 150 мл р-ра) в течение 3–4 часов при +4 °С. Тканевой экстракт фильтровали через несколько слоев марли, центрифугировали (3000 g, 15 мин), собирали надосадочную жидкость.
Cыворотку крови или экстракт костной ткани высаливали, используя сульфат аммония, который добавляли к экстракту или сыворотке крови при постоянном перемешивании до образования насыщенного раствора соли (на 1000 мл раствора 780 г соли). Суспензию белков оставляли на 7 суток при температуре +4 °С, после чего центрифугировали для осаждения примесных белков при 12000 g в течение 30 мин, фракцию супернатанта, которую далее диализовали против дистиллированной воды с добавлением азида натрия для удаления низкомолекулярных примесей и сульфата аммония в течение 14 дней. Полученные фракции супернатантов далее концентрировали до 50 мл, используя роторный вакуумный испаритель, при температуре +37 °С.
Фракции супернатантов (100 мл) разделяли изоэлектрофокусированием (ИЭФ) в градиенте плотности сахарозы на колонке LKB-440 (LKB, Швеция), используя амфолины диапазона рН 3,5–10,0 (Serva, Германия), при +4 °С в течение 96 часов при напряжении 500–1500 В. Собирали фракции объемом 10 мл. Детекцию белков во фракциях осуществляли на спектрофотометре Ultrospec 1100 pro, (Biochrom Ltd., Великобритания) при 280 нм, для каждой фракции определяли значение рН. Белковые фракции собирали согласно полученной картине разделения, которые далее длительно диализовали против дистиллированной воды и концентрировали. Собирали фракции кислых белков при значении pH < 3,0 и определяли мембранотропную активность адгезиометрическим методом, который заключается в оценке параметра, характеризующего вязкоупругие свойства ткани при стандартном деформационном воздействии [13].
Количественное определение белка во всех исследуемых растворах осуществляли двумя способами: спектрофотометрически [2] или с помощью колориметрического метода с использованием бицинхонината меди при 562 нм [12].
Электрофорез проводили в 15 %-м ПААГ по методике Лемли [10].
У тритонов, наркотизированных в 0,1 % растворе MS-222, удаляли фрагмент хвоста длиной 2 см. Регенераты хвостов взрослых тритонов выделяли через 40 дней после ампутации фрагмента хвоста и далее культивировали, используя роллер (Assistant RM5, Германия) со скоростью вращения 35 об/мин, в течение 14 дней при +22 °С в питательной среде для амфибий, которая содержала: 70 мл среды 199, 10 мл ЭТС, 30 мл кипячёной бидистиллированной, воды, 100 мкл р-ра антибиотика-антимикотика (Sigma-Aldrich, США), 100 мкл 4 % сульфата гентамицина. Среду культивирования стерилизовали, используя мембранные фильтры типа «CA» фирмы Nalgene, (США) c размером пор 0,22 мкм. В опытные флаконы (4 мл) добавляли 40 мкл соответствующей ИЭФ-фракции; в контрольные флаконы добавляли 40 мкл дистиллированной воды. Все флаконы укупоривали и культивировали 14 суток при + 22 °С в роллере. Исследовали две ИЭФ-фракции: выделенную из сыворотки крови в дозах 10–4 и 10–11 мг и выделенную из костной ткани – в дозах 10–8 и 10–14 мг. Смену среды культивирования производили каждые 72 часа, при этом в опытных сериях в питательную среду добавляли исследуемые фракции в указанных дозах, а в контрольных – в питательную среду ничего не добавляли.
Изучение состояния регенератов хвостов тритонов после культивирования проводили на сериях парафиновых срезов. Регенераты хвостов тритонов фиксировали в р-ре Буэна, срезы толщиной 7 мкм окрашивали гематоксилином-эозином по стандартной методике и изучали микроскопически. Более чем на 50 срезах было подсчитано количество фибробластов с использованием окулярной сетки на площади не менее 0,0225 мм2. Все полученные данные обрабатывали статистически, используя критерий Стьюдента.
Результаты исследования и их обсуждение
Для исследования МГТБ и их отдельных компонентов был разработан экспериментальный подход, первой стадией которого является экстракция биорегуляторов данной группы из тканей. На следующем этапе из экстрактов методом высаливания белков сульфатом аммония получают биологически активную пептидную компоненту биорегуляторов. В данной работе пептидные компоненты биорегуляторов, выделенных из сыворотки крови и экстракта костной ткани крыс, дополнительно очищали методом ИЭФ. Методом SDS-электрофореза показано, что они представляют собой высокоочищенные пептиды, входящие в состав биорегуляторов; обнаруживаются следовые количества белков-модуляторов с мол. массой около 66 кДа (рис. 1). Методом MALDI TOF масс-спектрометрии установлено, что пептидная компонента в каждом случае представлена: во фракции, выделенной из сыворотки крови, суммой пептидов с мол. массами 1376 ± 2; 1447 ± 2; 1666 ± 2; 1810 ± 2 Да, а во фракции, выделенной из экстракта костной ткани пептидами с мол. массами – 1041 ± 2; 1157 ± 2 Да.
а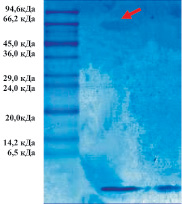 б
б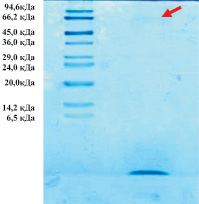
Рис. 1. SDS-электрофорез в 15 %-м ПААГ ИЭФ-фракций, выделенных их сыворотки крови (а) и костной ткани (б). Слева – маркерные белки: апротинин из легкого быка – 6,5 кДа; α-лактальбумин – 14,2 кДа; соевый ингибитор трипсина – 20,0 кДа; трипсиноген из поджелудочной железы быка – 24,0 кДа; карбоангидраза – 29,0 кДа; глицеральдегид-3-фосфатгидрогеназа – 36,0 кДа; овальбумин – 45,0 кДа; бычий сывороточный альбумин – 66,2 кДа; фосфорилаза b – 94,6 кДа; Стрелками отмечены белки-модуляторы
Данные фракции были исследованы на новой модели роллерного органотипического культивирования регенератов хвоста тритона. Обе фракции исследовали в разных дозах, добавляя в питательную среду культивирования. Через 40 дней после операции у тритонов в образовавшихся интактных регенератах хвостов (рис. 2, 3, а) были обнаружены следующие элементы: хорошо выраженная хрящевая ткань, хорда, мышечные волокна, сосуды, формирующиеся подкожные железы, пигментированные клетки звездчатой формы, расположенные под многослойным эпителием кожи, а также множество недифференцированных мезенхимных клеток. На данном сроке у тритонов хирургически удаляли регенераты хвостов, соответствующих стадиям регенерации IV–V [8], которые далее культивировали в течение 14 дней при 22 °С.

Рис. 2. Регенерат хвоста тритона на 40-й день после ампутации (общий вид)
Во флаконы опытных серий в среду культивирования добавляли ИЭФ-фракции биорегуляторов, выделенных из сыворотки крови и костной ткани млекопитающих, в соответствующих концентрациях, а в контроле – в питательную среду ничего не добавляли.
Были поставлены следующие опытные серии:
- серия № 1 (контрольная) – культивирование без добавления в питательную среду биорегуляторов;
- серия № 2 (опытная) – в питательную среду добавляли ИЭФ-фракцию, выделенную из сыворотки крови, в дозе 10–11 мг;
- серия № 3 (опытная) – в питательную среду добавляли ИЭФ-фракцию, выделенную из сыворотки крови, в дозе 10–4 мг;
- серия № 4 (опытная) – в питательную среду добавляли ИЭФ-фракцию, выделенную из костной ткани, в дозе 10–14 мг.
- серия № 5 (опытная) – в питательную среду добавляли ИЭФ-фракцию, выделенную из костной ткани, в дозе 10–8 мг.
После культивирования состояние регенератов в контроле существенно отличалось от состояния интактных регенератов хвостов, развившихся у тритонов на 40-й день после ампутации (рис. 3, а, б). Можно отметить выраженные процессы деградации во всех тканях регенерата. Имеет место гибель клеток хрящевой ткани, хондроциты отсутствуют, а на месте хряща присутствуют апоптирующие клетки. В кориуме выявлены малодифференцированные клетки. По сравнению с интактными, в кориуме культивируемых регенератов под многослойным эпителием кожи наблюдаются зрелые подкожные железы, наполненные секретом, пигментные клетки образуют плотные скопления под эпителием, хорошо представлены мышечные волокна.
При воздействии изучаемых ИЭФ-фракций состояние регенератов изменялось (рис. 3, в–е).
Следует отметить, что ИЭФ-фракция, выделенная из сыворотки крови, оказывала влияние на состояние тканей регенерата хвоста в целом, способствуя сохранению гистоструктуры и их жизнеспособности (рис. 3, в, г), в то время как ИЭФ-фракция, выделенная из костной ткани, проявляла тканеспецифическое действие, которое выражалось в поддержании целостности в основном хрящевой ткани (рис. 3, д).
Отдельное исследование было посвящено изучению действия более высоких доз данных ИЭФ-фракций на этой экспериментальной модели.
Исследование гистологических срезов культур регенератов после 14 дней культивирования показало, что биологическое действие ИЭФ-фракций в СМД и в высоких концентрациях принципиально различалось (рис. 3).
При воздействии ИЭФ-фракции, выделенной из сыворотки крови, в СМД (рис. 3, в) наблюдали в целом сохранение структуры хряща, однако в некоторых его областях имела место частичная деградация данной ткани, выражавшаяся в гибели хондроцитов, сегментация хряща и элементы нервной трубки плохо выражены, пигментные клетки образуют плотные тяжи под эпителием, а эпителиальный пласт кожи отходит, как при линьке, железы в кориуме не сильно выражены, представлены мышечные волокна и скопления малодифференцированных клеток. При воздействии этой фракции в дозе, соответствующей 10–4 мг (рис. 3, г), не наблюдали гибели хондроцитов, структура хряща полностью сохранялась, наблюдали сегментацию хряща, характерную для данной стадии, элементы спинного мозга и мышечные волокна хорошо выражены, зрелые железы вырабатывают много секрета, в кориуме много малодифференцированных клеток, пигментные клетки образуют небольшие скопления. Таким образом, ИЭФ-фракция, выделенная из сыворотки крови, в высокой концентрации оказывала протекторное действие на регенерат хвоста тритонов, выраженное в сохранении хрящевой, мышечной тканей, а также структуры кожи и подкожных желёз. Данная фракция, содержащая сывороточный биорегулятор, оказывала на ткани регенерата хвостов тритонов в СМД менее выраженный протекторный эффект, чем в высокой дозе. Эти результаты согласуются с ранее полученными данными, которые показали, что ИЭФ-фракция, выделенная из сыворотки крови, в дозе 10-4 мг, стимулировала регенерацию конечности у лягушки Xenopus laevis in vivo [6]. Можно предположить, что сывороточный биорегулятор в высоких концентрациях обладает морфогенетическим потенциалом, а в СМД – поддерживает жизнеспособность соединительнотканных элементов.
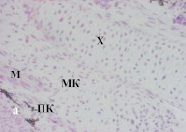
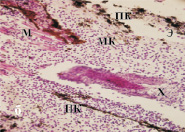
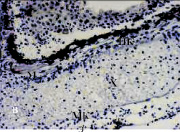
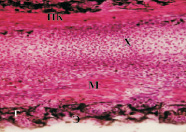
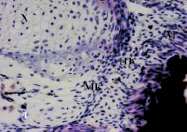
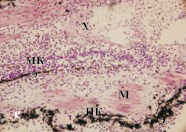
Рис. 3. Роллерное культивирование регенератов хвостов тритонов in vitro в течение 14-ти суток: а – регенерат хвоста тритона на 40-й день после ампутации; б – контроль (без добавления ИЭФ-фракций); в – с добавлением ИЭФ-фракции, выделенной из сыворотки крови, доза – 10–11 мг; г – с добавлением ИЭФ-фракции, выделенной из сыворотки крови, доза – 10–4 мг; д – с добавлением ИЭФ-фракции, выделенной из костной ткани, доза – 10–14 мг; е – с добавлением ИЭФ-фракции, выделенной из костной ткани, доза – 10–8 мг. Увеличение ×200. Окрашивание гематоксилином и эозином. На рисунке буквами указаны следующие структурные элементы: Э – многослойный эпидермис; Х – хорда; М – мышечные волокна; МК – малодифференцированные клетки; ПК – пигментированные клетки. ИЭФ-фракция, выделенная из костной ткани, в СМД (рис. 3, д) проявляла тканеспецифическое протекторное действие: поддерживала жизнеспособность клеток хрящевой ткани, способствовала сохранению её структуры, а также началу сегментации хряща, характерному для данной стадии. Под многослойным эпителием в кориуме видны зрелые железы с секретом, а пигментированные клетки, в отличие от контроля, образовывали небольшие скопления, а не протяженные структуры. Отмечалось присутствие хорошо выраженных мышечных волокон, а также малодифференцированных клеток
При действии высокой дозы (рис. 3, е) данной фракции в хрящевой ткани наблюдали развитие процессов деградации: хондроциты практически отсутствовали, на их месте присутствовали скопления клеток с пикнотическими ядрами. В отличие от контроля, хорошо были выражены структура и клетки спинного мозга, а также подкожные железы, наполненные секретом. Пигментные клетки присутствовали в виде скоплений под эпителием, не образуя протяженных структур, как в контроле. Мышечные волокна хорошо развиты. Таким образом, действие ИЭФ-фракции, выделенной из костной ткани, в двух дозах различалось: только в СМД она проявляла тканеспецифическое протекторное действие, поддерживая жизнеспособность клеток и структуру хряща. В то же время данная фракция в двух дозах оказывала сходный протекторный эффект на другие ткани регенерата, отличный от контроля.
Помимо визуальной оценки состояния тканей культивируемых регенератов на гистологических срезах, был также применен прямой подсчет фибробластов. В качестве контроля исследовали гистологические срезы, полученные после культивирования без добавления исследуемых фракций, а также интактных 40-дневных регенератов хвостов тритонов. Результаты подсчета приведены в таблице.
Влияние ИЭФ-фракций, выделенных из сыворотки крови и костной ткани млекопитающих, на количество фибробластов в регенератах хвостов тритонов в условиях роллерного органотипического культивирования in vitro.
|
Опытная серия |
Интактный регенерат хвоста тритона |
Контроль |
ИЭФ-фракция, выделенная из сыворотки крови, в дозе – 10–4 мг |
ИЭФ-фракция, выделенная из сыворотки крови, в дозе – 10–11 мг |
ИЭФ-фракция, выделенная из костной ткани, в дозе – 10–8 мг |
ИЭФ-фракция, выделенная из костной ткани, в дозе – 10–14 мг |
|
Количество фибробластов на единицу площади |
30,5 ± 15,6 |
39,7 ± 10,0# |
43,3 ± 11,1# |
55,4 ± 21,1*# |
38,4 ± 8,5 |
42,4 ± 9,1# |
Примечание. * – отмечены достоверные отличия от контроля (р < 0,05);
# – отмечены достоверные отличия от интактного регенерата (р < 0,05).
Присутствие пептидной фракции, выделенной из сыворотки крови, в СМД при культивировании способствовало увеличению количества фибробластов по сравнению с контролем, в то время как ИЭФ-фракция, выделенная из костной ткани, не оказывала влияния на количество фибробластов в культивируемых регенератах хвостов. По сравнению с интактным регенератом, при роллерном культивировании во всех группах, кроме группы серии № 5 (ИЭФ-фракция, выделенная из костной ткани, в дозе 10–8 мг), количество фибробластов увеличивалось, что указывает на стимуляцию их пролиферации в данных условиях.
Заключение
Суммируя полученные результаты, можно заключить, что, во-первых, пептидные компоненты биорегуляторов, выделенных из сыворотки крови быка и костной ткани крысы, обладают протекторным действием, увеличивая жизнеспособность клеток тканей регенератов хвостов тритонов при длительном роллерном органотипическом культивировании in vitro. Во-вторых, активность пептидных компонент данных биорегуляторов характеризуется наличием тканевой специфичности: пептиды, входящие в состав биорегулятора, выделенного из костной ткани, оказывали в СМД выраженное протективное действие только на хрящевую ткань формирующейся хорды в регенерате, а пептидная компонента биорегулятора, выделенного из сыворотки крови, в высокой концентрации поддерживала жизнеспособность всех производных мезодермы. Можно предположить, что такое действие пептидов сывороточного биорегулятора связано с важнейшей функцией крови как основного информационного русла организма и ее присутствием практически во всех органах и тканях. Полученные результаты указывают на значительную роль данных эндогенных биорегуляторов в регуляции гомеостаза костной ткани в условиях in vitro.
В этой работе было впервые показано различное действие пептидных компонент биорегуляторов данной группы в СМД и в высоких дозах. Следует отметить, что ранее на различных экспериментальных моделях, как in vivo, так и in vitro действие биорегуляторов группы МГТБ и их составляющих компонент изучали только в СМД [7]. Имеющиеся в настоящее время результаты исследований показывают, что только пептидная компонента биорегулятора, выделенного из сыворотки крови, обладает морфогенетическим потенциалом, причем в высокой дозе. Для объяснения этого феномена, очевидно, требуется проведение дополнительных исследований.
Рецензенты:
Шарова Н.П., д.б.н., зав. лабораторией биохимии процессов онтогенеза, ФГБУН Институт биологии развития им. Н.К. Кольцова РАН, г. Москва;
Голиченков В.А., д.б.н., профессор, зав. кафедры эмбриологии Биологического факультета МГУ им. М.В. Ломоносова, г. Москва.
Работа поступила в редакцию 06.03.2014.
Библиографическая ссылка
Рыбакова Е.Ю., Краснов М.С., Ильина А.П., Ямскова В.П., Ямсков И.А. ВЛИЯНИЕ БИОРЕГУЛЯТОРОВ, ВЫДЕЛЕННЫХ ИЗ СЫВОРОТКИ КРОВИ И КОСТНОЙ ТКАНИ МЛЕКОПИТАЮЩИХ, НА СОСТОЯНИЕ РЕГЕНЕРАТОВ ХВОСТОВ ТРИТОНОВ ПРИ РОЛЛЕРНОМ ОРГАНОТИПИЧЕСКОМ КУЛЬТИВИРОВАНИИ IN VITRO // Фундаментальные исследования. 2014. № 5-2. С. 283-289;URL: https://fundamental-research.ru/ru/article/view?id=33865 (дата обращения: 04.02.2026).



