Исследования на позвоночных показали, что взаимодействие клеток в процессе иммунного ответа имеет важное значение для его выраженности и точности [3]. У беспозвоночных кооперация клеток изучена меньше, прежде всего из-за представлений о примитивности их иммунной системы. Однако иглокожие, являясь одними из низкоорганизованных животных, занимают особое место среди беспозвоночных, так как находятся в основании древа Deuterostomia, к которому относятся и позвоночные. Ключевую роль в иммунных реакциях иглокожих играют циркулирующие клетки – целомоциты, наиболее многочисленными из которых являются фагоциты и морулярные клетки [5]. Фагоциты иглокожих, подобно макрофагам позвоночных, фагоцитируют и инкапсулируют антигены. Морулярные клетки синтезируют ряд гуморальных факторов защиты, участвуют в инкапсулировании чужеродных микроорганизмов, в заживлении ран и регенерации. У голотурий (Echinodermata, Holothuroidea) показана возможность взаимодействия между отдельными типами иммуноцитов (фагоцитами и морулярными клетками) на гуморальном уровне [15], однако механизмы этого взаимодействия и их регуляции остаются недостаточно исследованными.
Активные формы кислорода (АФК) рассматриваются в настоящее время как важные физиологические молекулы, участвующие во внутри- и межклеточной передаче сигнала [13]. При этом в фагоцитах позвоночных высокий уровень АФК в процессе иммунного ответа строго контролируется и «уравновешивается» высокой активностью антиоксидантных ферментов. Один из основных ферментов, детоксицирующих АФК, – каталаза (КФ 1.11.1.6), которая обезвреживает образовавшуюся H2O2. Важную роль в поддержании в клетке пула восстановленного глутатиона, который является важным неферментативным антиоксидантом, играет глутатионредуктаза (ГР, КФ 1.6.4.2). В свою очередь, глутатионтрансферазы (ГТ, КФ 2.5.1.18) осуществляют детоксикацию организма от ксенобиотиков, а также собственных метаболитов, в том числе продуктов пероксидации липидов, с участием восстановленного глутатиона.
Сдвиг в оксидантно-антиоксидантном балансе клетки является важным фактором, через который осуществляют свое регуляторное иммуносупрессорное действие у позвоночных глюкокортикоидные гормоны, при этом ключевое значение имеет изменение в клетках уровня перекиси водорода [8]. Стероидные гормоны обнаружены и у иглокожих [10]. При этом исследование влияния синтетического глюкокортикоидного гормона дексаметазона (Д) на иммунитет голотурии Eupentacta fraudatrix показало, что он оказывал апоптозмодулирующее действие при взаимодействии фагоцитов и морулоподобных клеток [15].
Цель работы – исследование изменений активности антиоксидантных ферментов фагоцитов и морулоподобных клеток голотурии E. fraudatrix при их взаимодействии на уровне гуморальных продуктов, синтезированных в отсутствие и в присутствии дексаметазона.
Материал и методы исследования
Голотурии E. fraudatrix (длина тела 35–70 мм) собраны в заливе Петра Великого осенью и зимой 2008 г. До начала экспериментов они находились в аквариуме с проточной аэрируемой морской водой в течение 2–4 недель.
Животных надрезали с помощью скальпеля, целомическую жидкость отбирали и добавляли в сосуд с антикоагулирующим раствором [5] в соотношении объемов 1:2. Образцы от трех-пяти (для последующей преинкубации клеток) или 15–40 животных (для последующей инкубации клеток) объединяли для центрифугирования. Получали фракции, обогащенные морулярными клетками (МК) и фагоцитами (фракция 1, Ф1), центрифугированием в ступенчатом градиенте фиколла-верографина, как описано ранее [15].
Эксперимент осуществлялся в два этапа и в двух повторностях. На первом (преинкубация) клетки инкубировали в течение 3 или 24 ч с фосфатно-солевым буфером (рН 7,6) с добавлением 36 г/л NaCl (ФСБН) или дексаметазона (100 мкМ), после чего отделяли среду преинкубации центрифугированием. На втором этапе (инкубация) полученные супернатанты Ф1, преинкубированных с дексаметазоном 24 ч (С(Ф1 + Д)24) или с ФСБН 24 ч (СФ1-24), добавляли к суспензиям свежевыделенных МК в объемном соотношении 1:1. Полученные супернатанты МК, преинкубированных с дексаметазоном 24 ч (С(МК + Д)24) или ФСБН в течение 3 ч (СМК3), или 24 ч (СМК24), аналогичным образом добавляли к свежевыделенным Ф1. В контрольные лунки добавляли ФСБН. Инкубацию проводили в течение 30 мин, 18 и 24 ч при температуре 22 °С. Пробы для последующего определения активности антиоксидантных ферментов замораживали в жидком азоте. Перед измерением активности ферментов к суспензии размороженных клеток добавляли фенилметилсульфонилфторид в концентрации 1 мМ и разрушали клетки ультразвуком (УЗДН-1, Россия) 22 кГц·100 с (5 раз по 20 с), 0 °С. Для получения безъядерного супернатанта образцы центрифугировали при 1000 g в течение 6 мин. Активность антиоксидантных ферментов каталазы, ГР и ГТ измеряли спектрофотометрическими методами, как описано ранее [6]. Определение концентрации белка в пробах производили окраской Кумасси-G250. Расчет активности антиоксидантных ферментов проводили по результатам не менее чем двух параллельных измерений.
Полученные данные (средние значения ± средняя ошибка измерений) анализировали с использованием непарного t теста (программное обеспечение INSTAT-3, GraphPad Software). Разницу между группами считали достоверной при p < 0,05.
Результаты исследования и их обсуждение
Добавление СМК3 вызывало в Ф1 через 30 мин или 18 ч инкубации снижение активности каталазы на 13 и 63 % соответственно, по сравнению с контролем (рис. 1, а). Добавление же СМК24 достоверно не влияло активность фермента в Ф1 через 30 мин, но стимулировало его активность через 24 ч инкубации на в 1,4 раза по сравнению с контролем (рис. 1, а).
Таким образом, действие продуктов из МК зависело как от времени преинкубации МК, так и от времени инкубации СМК с Ф1. При этом с увеличением времени преинкубации МК с 3 до 24 ч ингибирующий эффект супернатанта МК на активность каталазы в Ф1 сменялся на противоположный.
По-видимому, снижение активности каталазы в Ф1 во время инкубации с СМК3 связано с ингибирующим действием присутствующих в СМК3 гуморальных веществ, продуцированных в МК во время инкубации в стрессовых для клеток голотурий температурных условиях (22 °С). МК не обладают способностью к респираторному взрыву, но являются продуцентами ИЛ-1α-подобных веществ (ИЛ-1α-ПВ), повышение уровня которых в Ф1 отмечено в первые 30 мин воздействия гуморальных продуктов из МК, преинкубированных в течение 24 ч [15].
а  б
б  в
в 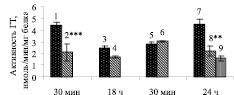
Рис. 1. Изменение активности каталазы (а), ГР (б) и ГТ (в) в фагоцитах при инкубации с супернатантом морулоподобных клеток: 1, 3, 5, 7 – контроль; 2, 4 – супернатант морулоподобных клеток, преинкубированных 3 ч; 6, 8 – супернатант морулоподобных клеток, преинкубированных 24 ч; 9 – супернатант морулоподобных клеток, преинкубированных 24 ч с дексаметазоном, 100 мкМ. Примечания: * Р < 0,05; ** Р < 0,01; *** Р < 0,001 по сравнению с контролем
На возможность опосредованного воздействия цитокиноподобных веществ из МК на активность антиоксидантных ферментов в фагоцитах указывают и данные работы [4], показавшие, что морулярные клетки асцидий (хордовые) через синтезируемые ими цитокиноподобные вещества стимулировали респираторный взрыв в фагоцитах. Учитывая эти факты, можно предположить, что одними из гуморальных продуктов, модулирующих активность каталазы в Ф1, могут быть ИЛ-1α-ПВ. Линейный характер зависимости активности фермента от времени инкубации и достижение значимых изменений активности при увеличении времени инкубации Ф1 с гуморальными продуктами из МК до 24 ч указывает на то, что действие этих веществ в Ф1 осуществлялось, по-видимому, по аналогии с действием ИЛ-1α у позвоночных, через индукцию ядерных факторов, поскольку осуществление ядерных эффектов требует достаточно длительного времени [7]. При этом разница в действии СМК3 и СМК24 на активность каталазы в Ф1 может быть связана с различным уровнем ИЛ-1α-ПВ в супернатантах, полученных в разные сроки преинкубации МК, поскольку известно, что эффект действия цитокинов зависит от концентрации [2]. Сопоставление данных работы Zaika, Dolmatova [15] о развитии апоптоза в Ф1 при воздействии СМК3 и, напротив, снижении при воздействии СМК24 свидетельствуют о том, что изменения активности каталазы в Ф1, продемонстрированные в настоящей работе, соответствуют представлениям о защитной роли этого фермента в процессе апоптоза.
В пользу этого предположения свидетельствуют и данные о том, что преинкубация МК с дексаметазоном привела к снижению активности каталазы в Ф1 при 24 ч воздействии C(МК + Д)24 на 88 % по сравнению с контролем (рис. 1, а). При тех же условиях эксперимента, как показано ранее [15], C(МК + Д)24 стимулировал апоптоз в Ф1. Известно, что дексаметазон модулирует синтез цитокинов в клетках [1], и H2O2 играет ключевую роль в передаче индуцированного дексаметазоном апоптотического сигнала [8]. По-видимому, и в настоящем эксперименте преинкубация МК с дексаметазоном, через изменения в синтезе цитокинов в этих клетках, приводила к стимуляции синтеза H2O2 в Ф1 на фоне снижения активности каталазы.
Активность другого антиоксидантного фермента – ГР – возрастала в Ф1 в 6 и 23 раза после 30 мин или 18 ч инкубации с СМК3, соответственно, по сравнению с контролем (рис. 1, б). Такой рост активности фермента, как и снижение активности каталазы, по-видимому, связан со стресс-индуцированным ростом продукции АФК в Ф1 под влиянием гуморальных продуктов из МК и расходованием восстановленного глутатиона, на восполнение которого и направлена работа фермента, субстратом для которого является окисленный глутатион. Однако с увеличением времени преинкубации МК до 24 ч, направленность изменений в Ф1 при воздействии супернатанта МК менялась: при 30 мин инкубации с СМК24 активность ГР возрастала в 2 раза, при 24 ч – напротив, снижалась в 2,3 раза. По-видимому, такие изменения активности фермента связаны со снижением расходования восстановленного глутатиона при воздействии гуморальных продуктов из СМК24 в течение 24 ч – срока инкубации, по-видимому, за счет активации каталазы. При добавлении же к Ф1 С(МК + Д)24 активность фермента росла в 2,8 раза по сравнению с контролем, что сходным образом находит объяснение в снижении уровня восстановленного глутатиона на фоне снижения активности каталазы.
Активность ГТ при инкубации Ф1 с СМК3 в течение 30 мин или 18 ч снижалась на 52 и 32 % соответственно, что также указывает в пользу предположения о росте уровня АФК и снижении уровня восстановленного глутатиона в Ф1 при воздействии гуморальных продуктов из МК. Можно предполагать, что именно развитие оксидантного стресса является причиной развития апоптоза в Ф1 при воздействии СМК3 [15]. Однако через 30 мин инкубации Ф1 с СМК24 активность ГТ практически не изменялась, а через 24 ч – даже снижалась на 51 % по сравнению с контролем, по-видимому, в связи со значительным снижением уровня АФК в результате активации каталазы и переходе клетки на другой уровень оксидантно-антиоксидантного баланса. При воздействии же C(МК + Д)24 активность ГТ снижалась еще больше, на 64 %, что коррелировало со снижением активности каталазы, по-видимому, уже за счет роста уровня АФК.
Полученные результаты подтверждают полученные ранее данные о способности гуморальных продуктов из МК, преинкубированных в стрессовых условиях инкубации (температура 22 °C), влиять на функциональный ответ фагоцитов [15]. Так, снижение активности каталазы и ГТ и рост активности ГР, которое происходило уже через 30 мин инкубации и в дальнейшем находилось в прямой зависимости от времени инкубации Ф1 с СМК3 (за исключением ГТ), свидетельствует о росте уровня АФК, по-видимому, в результате «респираторного взрыва» и функциональной активности фагоцитов. И, напротив, рост активности каталазы и снижение активности ГР при воздействии СМК24 с возрастанием времени инкубации до 24 ч указывает на снижение функциональной активности Ф1, сопровождающимся снижением в них продукции АФК. Вариации активности ГТ, как и ГР, свидетельствовали о том, что изменения уровня восстановленного глутатиона связаны с изменениями уровня АФК в Ф1, при этом отсутствие прямой корреляции между активностью ГТ и каталазы в некоторые периоды инкубации свидетельствует о том, что активность ГТ зависела от уровня не только АФК, но и, по-видимому, других метаболитов. При этом процесс влияния МК на Ф1 может модулироваться дексаметазоном, преинкубация МК с которым вызывает обратный эффект на активность антиоксидантных ферментов каталазы и ГР и, по-видимому, функциональную активность Ф1, вызывая ее стимуляцию через 24 ч инкубации.
При обратном влиянии, СФ1 на МК, 30 мин инкубация МК с СФ1-24 сопровождалась снижением активности каталазы на 73 % (рис. 2, а), а 24 ч инкубация, напротив, способствовала увеличению активности фермента в 1,9 раз по сравнению с контролем. При добавлении в среду инкубации Ф1 дексаметазона активность каталазы в МК, проинкубированных 24 ч с С(Ф1 + Д)24 возрастала еще более − в 6 раз по сравнению с контролем.
По-видимому, снижение активности каталазы через 30 мин связано с развитием в МК оксидантного стресса, вызванного повышением уровня АФК, продуцируемых Ф1, в окружающей МК среде инкубации, поскольку известно, что в самих Ф1 через 30 мин инкубации при повышенной температуре развивался апоптоз [15].
Возможность регуляции взаимодействия иммунных клеток позвоночных через выделяемые клетками АФК описана Sabbione et al. [12], которые показали, что нейтрофилы могут модулировать ответ Т-лимфоцитов, используя в качестве сигнальных молекул продуцируемые ими АФК.
И, напротив, рост активности каталазы через 24 ч происходил, по-видимому, в ответ на снижение уровня оксидантного стресса, индуцированного гуморальными продуктами из Ф1, в которых во время 24 ч преинкубации происходило снижение уровня апоптоза, как показано ранее [15], что, по-видимому, сопровождалось снижением уровня АФК в среде инкубации МК. Вместе с тем сравнение полученных результатов с ранее полученными данными о том, что воздействие СФ1 через 30 мин инкубации вызывало в МК снижение уровня апоптоза, а через 24 ч, напротив, стимулировало его рост по сравнению с контролем [15], свидетельствует о том, что в данных, условиях каталаза не оказывала защитного эффекта в отношении развития апоптоза.
а 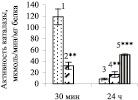 б
б 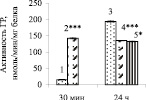 в
в 
Рис. 2. Изменение активности каталазы (а), ГР (б) и ГТ (в) в морулоподобных клетках при инкубации с супернатантом фагоцитов: 1, 3 – контроль; 2, 4 – супернатант фагоцитов, преинкубированных 24 ч; 5 – супернатант фагоцитов, преинкубированных 24 ч с дексаметазоном, 100 мкМ. Примечания: * Р < 0,05; ** Р < 0,01; *** Р < 0,001 по сравнению с контролем
По-видимому, развитие апоптоза в МК при воздействии гуморальных продуктов из Ф1 могло происходить по независимым от внутриклеточных АФК путям. В то же время известно, что цитокины могут как повышать, так и снижать уровнь апоптоза, при этом их антиапоптотическое действие на ранних стадиях инкубации может осуществляться независимо от их влияния на NF-kappaB, через антиапоптотическую протеинкиназу Akt [11]. Это свидетельствует о возможной роли ИЛ-1α-ПВ как внутриклеточного медиатора влияния АФК, продуцированных в Ф1, на МК.
При этом ключевую роль в развитии апоптоза могла играть не перекись водорода, а оксид азота (NO), синтез которого зависит от уровня цитокинов и для которого показана возможность как антиапоптотического действия через Akt, так и проапоптотического [14]. Кроме того, механизмы воздействия на сигнальные системы NO и АФК могут быть независимы [9]. Активность каталазы в МК при воздействии супернатантов Ф1 возрастала еще более, в 6 раз по сравнению с контролем, если Ф1 были преинкубированы с дексаметазоном (рис. 2, а). Поскольку ранее было показано, что в самих Ф1 24 ч преинкубация с дексаметазоном приводила к росту уровня апоптоза, и С(Ф1 + Д)24 также стимулировал рост апоптоза в МК, получает подтверждение предположение, что развитие апоптоза в МК индуцируется АФК, продуцируемыми Ф1, но АФК не являются внутриклеточными медиаторами апоптоза в этих клетках.
Активность ГР в МК изменялась противоположно изменениям активности каталазы (рис. 2, б): добавление СФ1-24 значительно стимулировало рост активности фермента (в 9 раз по сравнению с контролем) в МК через 30 мин инкубации, а через 24 ч инкубации наблюдалось, напротив, ингибирование фермента – на 30 % по сравнению с контролем. Воздействие С(Ф1 + Д)24 на активность фермента в МК не отличалось от действия СФ1-24. В целом это свидетельствует в пользу предположения о ведущей роли изменений в уровне H2O2 и, соответственно, активности каталазы, в механизмах воздействия на антиоксидантную ферментную систему в МК гуморальных продуктов из Ф1, при модуляции их синтеза дексаметазоном.
Добавление СФ1-24 к МК через 30 мин инкубации приводило к увеличению активности ГТ на 28 %, а через 24 ч – увеличивало ее в 1,8 раза по сравнению с контролем. Изменения активности ГТ через 24 ч инкубации позитивно коррелировали с изменениями активности каталазы. Добавление к МК С(Ф1 + Д)24 еще в большей степени увеличивало активность фермента – в 4,9 раз по сравнению с контролем. Опережающие изменения в активности каталазы по сравнению с активностью ГТ подтверждают ведущую роль каталазы в изменениях антиоксидантной ферментной системы в МК, свидетельствуя в пользу представлений о том, что именно H2O2, продуцируемая Ф1, играла роль межклеточного медиатора.
Результаты исследования указывают на то, что эффект клеток-продуцентов на клетки мишени зависел от функционального состояния как первых, так и вторых. При этом сравнение данных, полученных при изучении взаимодействия двух типов клеток при 24 ч сроке преинкубации клеток-продуцентов, свидетельствует о том, что Ф1 и МК действовали на антиоксидантную ферментную защиту своих клеток-мишеней при длительной инкубации (24 ч) противоположным образом: воздействие СМК на Ф1 вызывало преимущественно стимуляцию антиоксидантной ферментативной защиты в течение всего периода инкубации, а при воздействии СФ1 на МК отмечено первоначальное (30 мин) снижение активности каталазы на фоне роста активности глутатион-зависимых ферментов, с последующим, к 24 ч, ростом антиоксидантной ферментативной защиты. При этом сравнение с данными работы Zaika, Dolmatova [15] показывает, что если в Ф1 уровень антиоксидантной ферментной защиты влиял на развитие апоптоза, то в МК – нет. Эти результаты указывают на наличие различных регуляторных внутриклеточных механизмов апоптоза в этих двух типах клеток, предположительно, H2O2-зависимые в Ф1 и NO-зависимые – в МК. Полученные данные свидетельствуют также о различной роли этих клеток (до сих пор недостаточно исследованной) в иммунном ответе у голотурий.
Дексаметазон, добавленный к среде преинкубации, модулировал эффекты гуморальных продуктов при межклеточном взаимодействии: снижал уровень антиоксидантной ферментной защиты в фагоцитах при воздействии гуморальных продуктов из МК и, напротив, стимулировал его в МК при воздействии среды инкубации фагоцитов. Таким образом, дексаметазон может менять направленность иммунного ответа. Это свидетельствует о повышении уровня продукции АФК, прежде всего H2O2, в фагоцитах при воздействии дексаметазона, которые, как показано выше, напротив, снижают уровень оксидантного стресса в МК, что может свидетельствовать об ограничении функциональной активности клеток. Это указывает на возможность наличия у голотурий гормональной (стероидной) регуляции иммунного ответа, сходной с таковой у позвоночных.
В целом полученные результаты свидетельствуют о том, что иммунные клетки беспозвоночных, как и у позвоночных, могут оказывать взаиморегулирующее действие, и различия как экстраклеточных, так и внутриклеточных механизмов взаимовлияния, в том числе на оксидантно-антиоксидантный баланс клеток, обеспечивают тонкую настройку иммунного ответа. Кроме того, такое взаимовлияние может регулироваться гормонально, о чем свидетельствуют полученные данные о модулирующем действии дексаметазона на активность антиоксидантных ферментов, приводящим к изменению функциональной активности обоих типов исследованных клеток и способствующим, по-видимому, ограничению активности морулярных клеток. В целом полученные результаты свидетельствуют о сложности регуляции иммунного ответа у голотурий, вероятно, и обеспечивающей тот высокий уровень иммунной защиты, который характерен для этих животных. Полученные данные могут быть использованы при разработке клеточной модели для механизмов врожденного иммунного ответа.
Выводы
1. В двух типах исследованных клеток существуют различные механизмы регуляции антиоксидантной ферментативной активности, что, по-видимому, обеспечивает взаимное ограничение избыточной функциональной активности клеток при их взаимодействии.
2. Преинкубация клеток-продуцентов с дексаметазоном приводила к изменению направленности эффекта гуморальных продуктов из МК на антиоксидантную ферментную систему в Ф1, подавляя ее, и еще в большей степени повышала стимулирующий эффект продуктов из Ф1 на активность ферментов в МК, что в целом может свидетельствовать об иммуносупрессорном действии дексаметазона в голотуриях.
Рецензенты:
Ламаш Н.Е., д.б.н., старший научный сотрудник лаборатории фармакологии, ФГБУН Институт биологии моря им. А.В. Жирмунского Дальневосточного отделения РАН, г. Владивосток;
Тимченко Н.Ф., д.м.н., профессор, заведующая лабораторией молекулярных основ патогенности бактерий, ФГБУ «Научно-исследовательский институт эпидемиологии и микробиологии имени Г.П. Сомова» Сибирского отделения РАМН, г. Владивосток.
Работа поступила в редакцию 26.02.2014.
Библиографическая ссылка
Долматова Л.С., Уланова О.А. ИЗМЕНЕНИЯ АНТИОКСИДАНТНОЙ ФЕРМЕНТАТИВНОЙ АКТИВНОСТИ ФАГОЦИТОВ И МОРУЛЯРНЫХ КЛЕТОК ГОЛОТУРИИ EUPENTACTA FRAUDATRIX ПРИ ВЗАИМОДЕЙСТВИИ КЛЕТОК И ИХ МОДУЛЯЦИЯ ДЕКСАМЕТАЗОНОМ // Фундаментальные исследования. 2014. № 5-2. С. 276-282;URL: https://fundamental-research.ru/ru/article/view?id=33864 (дата обращения: 04.02.2026).



