Замена части сердца и сосудов как способ лечения различной патологии является древней идеей, над которой работали многие ученые медики. Первые результаты стали относятся к концу XIX века. Самым ярким и известным экспериментатором конца XIX и начала XX века остается Алексис Каррель, который в 1907 году за свои разработки был удостоен Нобелевской премии. Алексис Каррель и доктор К.К. Гатри пересаживали сегменты сосудов вместо дефектов в сосудах и дали жизнь методике «аутовенозной пластики» артерий при повреждениях и окклюзиях; в конце XIX века они в своей лаборатории в Чикаго пересаживали сердце и почки в эксперименте на животных.
В конце 40-х годов Роберт Гросс и Чарльз Хафнагел сообщили об успешном замещении сегмента аорты аортальным гомографтом при операции резекции коарктации аорты, когда диастаз оказался большим и выполнение прямого анастомоза стало невозможным.
В 1951 году парижский хирург Ж. Удо сообщил о первом случае замещения гомотрансплантатом окклюзированного участка в нижней части аорты. В следующем году Шарль Дюбо и Майкл ДеБейки выполнили подобные операции при аневризмах аорты. В сердечной хирургии биологические клапаны стали применять в начале 60-х годов.
Человеческий и ксенобиологический материал для пластики сердца и сосудов имеет большое преимущество в виде хорошей адаптации к выполнению заданной функции и отсутствии необходимости приема антикоагулянтов [3, 4, 5, 10]. Однако реакции отторжения, ранней и поздней дегенерации биоткани с деформацией и кальцинацией приводят к необходимости повторных операций [1, 2, 3, 11, 12]. Однако то же самое, но только с большей частотой тромбозов, происходит с механическими и синтетическими протезами.
Принципиальным направлением обработки и хранения человеческого и других биологических материалов для пластики сердца и сосудов является удаление клеток и клеточного материала, где сосредоточены основные антигены и оставление коллагено-эластического комплекса с максимальным сохранением его упруго-деформативных свойств. Существует немало способов хранения и стерилизации, от хранения в глютаровом альдегиде и жидком азоте, до замачивания в среде с антибиотиками и антигрибковыми препаратами. Отдаленные наблюдения показывают, что большинство гомо- и ксенографтов через 7–10 лет теряют свою функцию и возникает необходимость их замены на новый. В литературе есть указания на то, что некоторые аллотрасплантаты исправно функционируют по 20 и более лет [4, 6, 8, 10].
Цель: оценить результаты биопротезирования клапанов сердца у детей.
Материал и методы исследования
С 2000 по 2012 гг. включительно в отделении кардиохирургии ДРКБ МЗ РТ произведено 89 операций по пересадке легочных и аортальных клапанов. Из них было 41 ксенотрасплантат производства лаборатории НЦ ССХ им. Бакулева А.Н., которые использовали до 2008 года, и 48 гомотрансплантатов производства биолаборатории г. Санкт-Петербург, их использовали после 2008 года.
Клапансодержащие кондуиты применяли при следующих операциях (см. рис. 1):
– операция Росса при аортальных пороках, 14 случаев до 2008 года и 3 после;
– операция Растелли при общем артериальном стволе и атрезии легочной артерии, 16 случаев до 2008 года и 11 после;
– замена клапана при легочном стенозе, 3 случаев до 2008 года и 1 после;
– замена клапана на отдаленных сроках после радикальной коррекции тетрады Фалло, 9 случаев до 2008 года и 2 после;
– операции по замене ксено- и гомографта при его дисфункции, всего 27 (45,8 %).
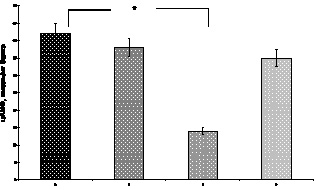
Рис. 1. Количество операций с применением кондуитов. * – РКТФ – радикальная коррекция тетрады Фалло; РК СЛА – радикальная коррекция стеноза клапана лёгочной артерии
По возрасту пациенты распределялись следующим образом: операция Растелли выполнялась при диагнозе «общий артериальный ствол» в возрасте от 1 до 3 месяцев (средний возраст 1,8 месяца); при диагнозе «атрезия легочной артерии» в возрасте от 6 до 18 месяцев (средний возраст 8,6 месяца); операция Росса при патологии аортального клапана выполнялась в возрасте от 3 до 18 лет (средний возраст 14,8 лет); замена клапана после радикальной коррекции тетрады Фалло – в возрасте от 4 до 18 лет (средний возраст 15,2 года).
Атрезия легочной артерии и общий артериальный ствол относятся к критическим порокам сердца, которые требуют срочного хирургического лечения. При атрезии легочной артерии хирургическое лечение осуществляли в два этапа. Другие операции проводили детям старше 3-х лет, что значительно облегчало задачу хирурга.
Результаты исследования и их обсуждение
Наибольшая летальность в группах (4,14,8 %) наблюдалась в группе детей первого года жизни, которым выполняли операцию Растелли. После операции Росса умер один пациент от сердечной недостаточности. Общая летальность при пересадке клапанов составила 5,5 %.
В отдалённом послеоперационном периоде после операции Росса выполнена замена 9 ксеноклапанов (64 %). В одном случае нарастающая аортальная недостаточность явилась показанием к имплантации механического клапана. Повторных замен кондуитов после реопераций не было.
В группе операций Растелли выполнено 11 (68,7 %) реопераций после ксенопротезирования. Устанавливали гомографты соответствующего размера. На 11 случаев первичных операций Растелли с применением гомографта зафиксировано 3 (27 %) случая реопераций по поводу раннего сморщивания кондуита с выраженным стенозом легочного ствола на сроках 1,5–2 года после операции.
Замена легочного клапана после радикальной коррекции тетрады Фалло на отдаленных сроках по поводу нарастающей недостаточности клапана лёгочной артерии и снижения функции правого желудочка произведено у 9 пациентов ксеноклапаном и у 3 гомографтом. В дальнейшем реоперация по замене ксенотрансплантата на гомографт выполнена у 4 (44 %) пациентов.
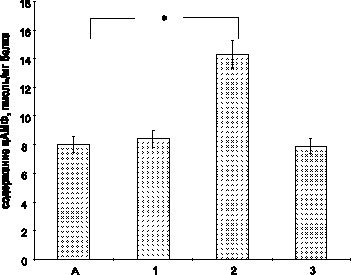
Рис. 2. Число реопераций после установки трансплантата. * – РКТФ – радикальная коррекция тетрады Фалло
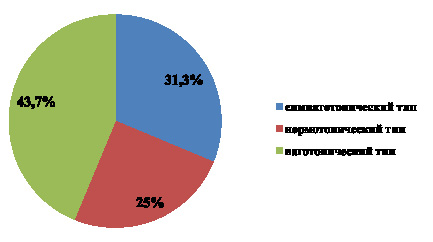
Рис. 3. Динамика замены ксентрансплантатов на гомотрансплантаты в послеоперационном периоде. * – РКТФ – радикальная коррекция тетрады Фалло
При изолированном стенозе лёгочной артерии клапан меняли в 4 случаях, были имплантированы 3 ксено- и 1 гомотрансплантат. Реопераций не проводили (рис 2, 3)
Выводы
1. Полученные нами результаты в общих чертах повторяют имеющийся опыт проведения подобных вмешательств.
2. Гомографт по сравнению с ксенографтом показывает более продолжительные сроки функционирования.
3. Идеальным трансплантатом в детской хирургической практике может считаться тот, который растет вместе с организмом больного, однако поиски его могут затянуться на неопределенно долгое время.
Рецензенты:Гребнев П.Н., д.м.н., профессор кафедры детской хирургии, ГБОУ ВПО «Казанский государственный медицинский университет» Минздравсоцразвития РФ, г. Казань;
Садыкова Д.И., д.м.н., доцент кафедры госпитальной педиатрии с курсом поликлинической педиатрии, ГБОУ ВПО «Казанский государственный медицинский университет» Минздравсоцразвития РФ, г. Казань.
Работа поступила в редакцию 21.03.2014.
Библиографическая ссылка
Миролюбов Л.М., Миролюбов Л.М., Хавандеев М.Л., Петрушенко Д.Ю., Костромин А.А., Лысенко Т.Р., Нурмеев И.Н., Нурмеев И.Н. БИОПРОТЕЗИРОВАНИЕ КЛАПАНОВ СЕРДЦА У ДЕТЕЙ // Фундаментальные исследования. 2014. № 4-2. С. 314-317;URL: https://fundamental-research.ru/ru/article/view?id=33835 (дата обращения: 02.01.2026).



