Глаукома является одной из наиболее актуальных медико-социальных проблем, что обусловлено значительным ее распространением, трудностями ранней диагностики и неблагоприятного прогноза. Несмотря на большое количество научных публикаций, посвященных изучению патогенеза глаукомы, до настоящего времени до конца не выяснена роль иммунных механизмов в патогенезе развития первичных открытоугольной и закрытоугольной глауком [1, 10, 12].
Цитокины – ключевые гуморальные факторы воспаления, необходимые для реализации защитных функций, прежде всего, врожденного иммунитета. Для цитокиновой сети характерен ряд свойств [5, 9]. Основными из них являются: индуцибельность синтеза большинства самих цитокинов и их рецепторов, избыточность (перекрывание спектров действия разных цитокинов), их взаимосвязи и взаимодействия и преимущественно локальность действия [2, 4, 11]. В многочисленных работах показано, что ни один из цитокинов не существует и не проявляет своей биологической активности изолированно. Результаты их взаимодействия могут приводить к синергизму, антогонизму, а иногда быть неожиданными [6, 7]. В литературе представлены публикации с неоднозначными суждениями о направленности, степени изменений про- и противовоспалительных цитокинов у пациентов с глаукомой как на системном, так и на локальном уровне. Отсутствуют исследования по сравнительной оценке состояния цитокиновой сети у пациентов с открытоугольной и закрытоугольной глаукомами. Это и определило цель настоящего исследования
Цель: оценить локальный и системный уровень про- и противовоспалительных цитокинов у пациентов с первичной открытоугольной и первичной закрытоугольной глаукомами.
Материалы и методы исследования
Были обследованы пациенты с первичной открытоугольной глаукомой (ПОУГ) I-III стадиями (133 человека) и закрытоугольной глаукомой I-III стадиями (27 человек). Определение содержания цитокинов (IL-1β, IL-6,IL-2, IL-2pp, IL-17, IFN-γ,IL-10, IL-4, TGF-b1, TGF-b2) в сыворотке крови и в слезной жидкости у пациентов с ПОУГ и ПЗУГ разных стадий проведено методом твердофазного ИФА с применением специфических реактивов «R&D DiagnosticsInc.» (USA). Контролем служили данные, полученные при обследовании 50 практически здоровых добровольцев. Для определения достоверности различий использовалась непараметрическая статистика (медиана, нижний и верхний квартиль, критерий Манна–Уитни-Вилкоксона, χ2), с использованием программы SPSSv 16.
Результаты исследования и их обсуждение
При анализе цитокинового профиля сыворотки крови пациентов с глаукомой было установлено, что содержание большинства исследованных провоспалительных цитокинов (IL-1β, IL-6, IL-2, IL-17) повышалось (табл. 1). Исключение составили: IFNγ – уровень которого в сыворотке крови не отличался от контрольных величин и растворимый рецептор IL-2, количество последнего, напротив, было снижено (р < 0,01).
Таблица 1
Содержание цитокинов в сыворотке крови обследованных с глаукомой и контрольной группах
|
№ п/п |
Показатели (Ме; Q25;Q75), пг/мл (min-max) |
Группа контроля (n = 50) |
Больные с глаукомой (n = 160) |
|
1 |
IL-1β |
2,34 (1,2; 12,60) (0,5–19,30) |
12,00*** (3,2; 63,30) (0,5–265,1) |
|
2 |
IL-6 |
1,28 (0,6; 2,33) (0,3–3,72) |
9,20** (0,3; 18,60) (0,3–133,75) |
|
3 |
IL-2 |
1,75 (0,2; 13,49) (0,2–36,88) |
3,23* (0,40; 59,31) (0,10–201,45) |
|
4 |
SRIL-2 |
277,55 (119,63; 429,00) (27,7–624,70) |
172,43** (79,12; 309,17) (7,33–1418,0) |
|
5 |
IL-17 |
10,96 (2,97; 26,31) (1,4–57,46) |
53,90** (20,50; 131,2) (3,6–1650,6) |
|
6 |
IFNγ |
12,50 (7,90; 26,00) (4,60–34,50) |
16,82 (1,80; 84,15) (1,80–148,60) |
|
7 |
IL-10 |
11,77 (1,7; 23,19) (1,10–36,60) |
10,14 (0,85; 18,80) (0,70-63,08) |
|
8 |
IL-4 |
9,28 (5,0; 10,0) (1,20–13,40) |
2,32* (1,4; 7,48) (0,6–98,49) |
|
9 |
TGFβ1 |
16,76 (13,02; 24,0) (6,47–46,31) |
14,74 (10,6; 18,31) (5,9–60,06) |
|
10 |
TGFβ2 |
163,21 (83,67; 231,23) (55,26–330,20) |
252,43* (201,21; 276,15) (120,96–343,88) |
Примечания: статистическая достоверность различий показателей с группой контроля: р < 0,05 – *; р < 0,01 – **; р < 0,001 – ***.
При оценке уровня противовоспалительных цитокинов не зафиксировано достоверных различий в содержании IL-10 и TGFβ1 в общей группе пациентов с глаукомой, но установлен низкий уровень IL-4 по сравнению с контролем (р < 0,05). Тогда как концентрация TGFβ2 статистически значимо повышалась у пациентов с глаукомой (252,43 (201,21;276,15) пг/мл против 163,21 (83,67; 231,23) пг/мл; р < 0,05).
При анализе цитокинового профиля сыворотки крови у пациентов с ПОУГ и ПЗУГ разных стадий выявлены существенные различия (табл. 2), позволяющие считать ПОУГ заболеванием, характеризующимся развитием системной воспалительной реакции, что подтверждает сосудистую и метаболическую теории патогенеза ПОУГ. Установлено, что уже при начальной стадии ПОУГ в крови возрастает содержание IL-6 и, особенно, IL-17, определяется дефицит противовоспалительных медиаторов – IL-4, TGFβ1 и SRIL-2.
При второй стадии ПОУГ уровень провоспалительных цитокинов увеличивался в несколько раз. У пациентов этой группы определена гиперцитокинемия IL-17, IL-2, IL-1β; возрастал уровень IL-6, IFNγ, TGFβ2. При сохранении низких значений IL-4, определен дефицит IL-10.
Таблица 2
Содержание цитокинов в сыворотке крови у пациентов с ПОУГ и ПЗУГ разных стадий
|
Показатели (Ме; Q25-Q75) пг/мл |
Контрольная группа n = 50чел./100 глаз |
Пациенты ПОУГ, n = 133/201 глаз |
Пациенты ПЗУГ, n = 27/47 глаз |
||||
|
I стадия |
II стадия |
III стадия |
I стадия |
II стадия |
III стадия |
||
|
n = 39/99• |
n = 56/64• |
n = 38/71• |
n = 13/21• |
n = 8/16• |
n = 6/12• |
||
|
IL-1β |
2,34 (1,2; 12,60) (0,5–19,30) |
4,0 (1,2; 14,5) р1-2 < 0,001 |
16,30*# (3,2; 64,0) р2-3 > 0,05 |
12,45*# (2,9; 66,3) р1-3 < 0,01 |
3,60 (0,8; 10,64) р1-2 > 0,05 |
4,20# (1,30; 14,26) р2-3 > 0,05 |
5,36# (1,42; 18,44) р1-3 > 0,05 |
|
IL-6 |
1,28 (0,6; 2,33) (0,3–3,72) |
3,0* (0,3; 10,0) р1-2 < 0,05 |
10,42* (4,0; 17,5) р2-3 > 0,05 |
10,30** (8,0; 18,6) р1-3 < 0,05 |
2,43 (0,8; 4,20) р1-2 > 0,05 |
7,12 (0,3; 8,16) р2-3 > 0,05 |
9,26** (3,10; 20,62) р1-3 < 0,01 |
|
IL-2 |
1,75 (0,2; 13,49) (0,2–36,88) |
1,22 (0,4; 3,25) р1-2 < 0,001 |
36,45**# (1,2; 59,80) р2-3 > 0,05 |
21,02*# (2,23; 39,05) р1-3 < 0,01 |
2,86 (0,40; 8,14) р1-2 > 0,05 |
4,20# (0,60; 9,86) р2-3 > 0,05 |
6,74# (1,00; 12,40) р1-3 > 0,05 |
|
SRIL-2 |
277,55 (119,63; 429,00) (27,7–624,70) |
137,13* (42,69; 79,12) р1-2 < 0,05 |
172,43 (87,0; 233,82) р2-3 < 0,05 |
309,17*# (190,89; 394,12) р1-3 < 0,001 |
148,00* (68,32; 186,00) р1-2 > 0,05 |
170,36 (120,4; 264,3) р2-3 > 0,05 |
240,50# (108,62; 326,3) р1-3 < 0,05 |
|
IL-17 |
10,96 (2,97; 26,31) (1,4–57,46) |
35,50 (13,9; 65,0) р1-2 < 0,01 |
64,90*** (12,30; 131,12) р2-3 > 0,05 |
61,17** (20,05; 106,9) р1-3 < 0,05 |
20,34 (15,26; 32,00) р1-2 < 0,05 |
28,22*# (18,24; 38,40) р2-3 > 0,05 |
34,86*# (28,03; 46,50) р1-3 < 0,01 |
|
IFNγ |
12,50 (7,90; 26,00) (4,60–34,50) |
14,32 (1,80; 28,0) р1-2 < 0,05 |
20,44*# (9,98; 84,15) р2-3 > 0,05 |
17,25*# (8,70; 61,0) р1-3 < 0,05 |
10,82 (3,12; 24,38) р1-2 > 0,05 |
16,36# (1,64; 32,14) р2-3 > 0,05 |
12,00# (1,80; 28,60) р1-3 > 0,05 |
|
IL-10 |
11,77 (1,7; 23,19) (1,10–36,60) |
16,47 (8,5; 19,70) р1-2 < 0,05 |
5,17* (1,7; 6,42) р2-3 < 0,05 |
10,14 (0,80; 18,80) р1-3 > 0,05 |
13,28 (1,54;18,26) р1-2 > 0,05 |
12,86# (1,90; 14,90) р2-3 < 0,05 |
15,12*# (4,85; 40,3) р1-3 < 0,05 |
|
IL-4 |
9,28 (5,0; 10,0) (1,20–13,40) |
1,85* (1,4; 6,80)↓ р1-2 > 0,05 |
3,23* (1,14; 8,09) р2-3 > 0,05 |
3,68* (1,4; 7,48)↓ р1-3 > 0,05 |
11,00# (2,60; 13,92) р1-2 > 0,05 |
6,92# (2,32; 11,74) р2-3 > 0,05 |
7,26# (1,86; 14,15) р1-3 > 0,05 |
|
TGFβ1 |
16,76 (13,02; 24,0) (6,47–46,31) |
14,77* (10,75; 18,31) р1-2 > 0,05 |
15,35 (12,23; 19,71) р2-3 > 0,05 |
13,25* (10,6; 17,30) р1-3 > 0,05 |
16,00 (11,20; 19,68) р1-2 < 0,05 |
20,82# (15,84; 32,60) р2-3 < 0,01 |
26,30**# (18,31; 54,25) р1-3 < 0,001 |
|
TGFβ2 |
163,21 (83,67; 231,23) (55,26–330,20) |
190,42 (140,6; 240,2) р1-2 < 0,05 |
266,30* (188,4; 288,5) р2-3 > 0,05 |
306,46** (201,28; 340,2) р1-3 < 0,05 |
170,00 (130,40; 206,26) р1-2 > 0,05 |
174,20 (134,65; 220,53) р2-3 < 0,05 |
144,15*# (122,40; 176,3) р1-3 < 0,05 |
Примечания: статистическая достоверность различий между группами: р – с группой контроля: р < 0,05 – *;р < 0,01 – **;р < 0,001 – ***; р1,2,3 – сравниваемые группы; # – р < 0,05 между группами пациентов с разными клиническими формами глаукомы (ПОУГ и ПЗУГ); • – n = чел./глаз.
В продвинутой (III стадии) ПОУГ эти закономерности сохраняются, но возрастала уровень SRIL-2 и относительно повышается (по сравнению со II стадией) IL-10 содержание в сыворотке крови (табл. 2).
При анализе цитокинового профиля сыворотки крови пациентов с I стадией ПЗУГ большинство исследованных цитокинов не отличалось от референсных величин за исключением низкого уровня SRIL-2 (табл. 2). При сравнительной оценке с аналогичными показателями у пациентов с ПОУГ зафиксировано статистически значимое различие в содержании IL-17 (χ2 = 4,86 против р < 0,05 2-й степени свободы). Что позволяет считать уровень IL-17, превышающий 30,00 пг/мл, дополнительным дифференциально-диагностическим признаком І стадии ПОУГ.
Таблица 3
Содержание цитокинов в слезной жидкости у пациентов с ПОУГ и ПЗУГ разных стадий
|
Показатели (Ме; Q25-Q75) пг/мл |
Контрольная группа n = 50чел./100 глаз |
Пациенты ПОУГ, n = 133/201 глаз |
Пациенты ПЗУГ, n = 27/47 глаз |
||||
|
I стадия |
II стадия |
III стадия |
I стадия |
II стадия |
III стадия |
||
|
n = 39/99• |
n = 56/64• |
n = 38/71• |
n = 13/21• |
n = 8/16• |
n = 6/12• |
||
|
IL-1β |
2,6 (1,6; 3,2) |
3,69* (3,20; 5,06) р1-2 < 0,05 |
8,64* (1,50; 12,38) р2-3 < 0,05 |
13,20* (3,22; 37,19) р1-3 < 0,001 |
3,0 (2,1; 3,42) р1-2 < 0,05 |
9,86* (3,80; 12,89) р2-3 > 0,05 |
10,94* (3,14; 28,60) р1-3 < 0,05 |
|
IL-6 |
2,0 (1,7; 5,4) |
2,1 (2,0; 4,80) р1-2 > 0,05 |
2,4 (2,0; 5,70) р2-3 < 0,05 |
7,40*# (6,5; 9,20) р1-3 < 0,05 |
2,80 (2,0; 3,96) р1-2 > 0,05 |
3,2 (2,0; 5,92) р2-3 > 0,05 |
2,45 (2,4; 4,23) р1-3 > 0,05 |
|
IL-2 |
2,2 (2,0; 3,1) |
5,18 (1,95; 8,60) р1-2 < 0,01 |
16,19**# (8,46; 30,50) р2-3 < 0,001 |
3,25 (1,2; 6,84)# р1-3 > 0,05 |
2,44 (2,0; 3,20) р1-2 < 0,001 |
64,26*** (17,66; 280,0) р2-3 < 0,05 |
28,0** (2,4; 32,0) р1-3 < 0,05 |
|
SRIL-2 |
200,0 (132,4;240,8) |
296,34* (154,0; 328,6) р1-2 > 0,05 |
309,17* (268,42; 394,12) р2-3 < 0,05 |
228,95 (136,77; 289,17) р1-3 < 0,05 |
246,54* (186,24; 316,20) р1-2 < 0,05 |
364,22* (266,3; 448,50) р2-3 < 0,05 |
300,40* (240,2; 345,40) р1-3 > 0,05 |
|
IL-17 |
5,34 (2,10; 8,90) |
47,80** (13,20; 158,20)# р1-2 < 0,05 |
19,60* (7,32; 72,50)# р2-3 > 0,05 |
16,76* (8,00; 62,14)# р1-3 < 0,05 |
5,07 (1,20; 5,80) р1-2 < 0,05 |
9,0* (1,20; 16,83) р2-3 < 0,05 |
3,4 (2,8; 5,62) р1-3 > 0,05 |
|
IFNγ |
22,83 (10,00; 26,50) |
10,25* (4,78; 10,0) р1-2 < 0,001 |
54,30* (27,20; 146,0)# р2-3 > 0,05 |
44,36* (18,64; 82,0) р1-3 < 0,01 |
14,97 (10,08; 24,10) р1-2 > 0,05 |
27,00 (24,10; 29,90) р2-3 > 0,05 |
36,48* (26,52; 44,56) р1-3 < 0,01 |
|
IL-10 |
14,05 (7,14; 26,3) |
34,51* (6,20; 45,63)↑# р1-2 < 0,01 |
3,90* (6,3; 14,31) р2-3 > 0,05 |
7,66 (6,40; 30,50) р1-3 < 0,05 |
10,12 (6,65; 16,20) р1-2 > 0,05 |
8,86 (4,8; 14,20) р2-3 < 0,05 |
18,24 (7,20; 24,80) р1-3 < 0,05 |
|
IL-4 |
4,90 (2,5; 6,2) |
9,90 (3,2; 14,0) р1-2 > 0,05 |
7,78 (2,7; 14,3) р2-3 < 0,05 |
18,20*# (5,6; 28,4) р1-3 < 0,05 |
5,60 (3,40; 5,76) р1-2 > 0,05 |
7,20 (4,21; 8,43) р2-3 > 0,05 |
6,34 (2,96; 7,12) р1-3 > 0,05 |
|
TGFβ1 |
360,00 (270,0; 425,0) |
270,00* (210,00; 360,00) р1-2 > 0,05 |
285,0* (255,0; 310,0) р2-3 < 0,05 |
200,0**# (150,0; 240,0) р1-3 < 0,05 |
364,32 (146,30; 380,0) р1-2 > 0,05 |
286,14 (196,80; 306,50) р2-3 < 0,05 |
410,12* (298,4; 454,20) р1-3 < 0,05 |
|
TGFβ2 |
168,50 (110,0; 206,4) |
182,96* (173,92; 238,30) р1-2 > 0,05 |
216,00**# (193,80; 280,4) р2-3 > 0,05 |
288,63***# (201,21; 320,60) р1-3 < 0,05 |
173,92 (156,01; 238,32) р1-2 < 0,05 |
138,35 (120,60; 180,23) р2-3 > 0,05 |
160,52 (110,12; 190,30) р1-3 > 0,05 |
Примечания: статистическая достоверность различий между группами: р – с группой контроля: р < 0,05 – *;р < 0,01 – **;р < 0,001 – ***; р1,2,3 – сравниваемые группы; # – р < 0,05 между группами пациентов с разными клиническими формами глаукомы (ПОУГ и ПЗУГ); • – n = чел./глаз.
У пациентов со II стадией ПЗУГ цитокиновый профиль сыворотки крови также мало отличался от референсных величин. У них определено умеренное увеличение IL-17 по сравнению с контролем, но значения IL-17 были в среднем в 2 раза ниже, чем у пациентов с ПОУГ. Концентрация IL-17, превышаюшая 60,00 пг/мл, определена как стабильный признак развитой стадии ПОУГ (χ2 = 5,84 при р < 0,01; 1-й степени свободы).
При III стадии ПЗУГ выявлен целый ряд изменений в цитокиновом профиле: повышение содержания IL-6, IL-17, IL-10, TGFβ1 и снижение количества TGFβ2 по сравнению с группой контроля.
Сравнительный анализ цитокинового профиля крови пациентов с ПОУГ и ПЗУГ II-III стадии выявил, что ПОУГ характеризуется увеличением IL-1β, IL-2, IL-17, IFNγ и TGFβ при одновременном снижении IL-10, IL-4 и TGFβ1.
Для более полного представления о цитокиновом профиле сыворотки крови у пациентов с глаукомой нами был рассчитан удельный вес каждого из них (рисунок).
Оценка удельного веса основных про- и противовоспалительных цитокинов наглядно демонстрирует увеличение доли провоспалительных цитокинов и дефицита противовоспалительных IL-4, IL-10 при ПОУГ.
При ПЗУГ удельный вес провоспалительных цитокинов повышался незначительно за исключением уровня IL-17 и IL-6. Доля противовоспалительных медиаторов (IL-4 и IL-10), напротив, была достоверно выше по сравнению с ПОУГ, но ниже, чем в контроле.
Оценка удельного веса цитокинов в профиле сыворотки крови как пациентов с ПОУГ, так и ПЗУГ свидетельствует о значительной роли IL-17 в патогенезе глаукомы, что подтверждает мнение ряда авторов [1, 8] и может косвенно свидетельствовать о значении аутоиммунных механизмов при глаукомах.
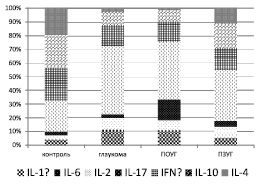
Цитокиновый профиль сывороток крови пациентов с разными клинико-лабораторными проявлениями глаукомы
Расчет коэффициента, отражающего поляризацию иммунного ответа, позволил сделать заключение, что при ПОУГ регистрируется Th I тип иммунного ответа, а при ПЗУГ – смешанный Th1/Th2 тип (10,00 ± 0,20 против 1,5 ± 0,04 при ПЗУГ и 1,35 ± 0,02 у здоровых).
Отдельно проведена сравнительная оценка концентраций трансформирующих ростовых факторов (TGFβ1 и TGFβ2) в сыворотке крови больных с ПОУГ и ПЗУГ и установлен разнонаправленный характер их изменений. Выявлено, что при II и III стадиях ПЗУГ уровень TGFβ1 существенно выше, чем у пациентов с ПОУГ, тогда содержание TGFβ2, напротив, значимо повышено у пациентов с ПОУГ. Это подтверждает патогенетическую роль TGFβ2 при первичной открытоугольной глаукоме [12], вероятно, стимулированный им фиброз вносит вклад в нарушение оттока внутриглазной жидкости и повышение ВГД. Наши исследования подтвердили данные ряда авторов [12, 13]. В то же время не зафиксировано увеличения в крови TGFβ1 при ПОУГ, а при I и III стадиях было определено снижение его уровня по сравнению с контрольной группой. Эти результаты согласуются с данными, полученными Д.А. Рукиной с соавт. (2011) [3]. Не до конца понятен механизм этих различий, но полученные результаты позволяют разработать дополнительный дифференциально диагностический признак ПОУГ II–III стадий: увеличение TGFβ2 в сыворотке крови выше 205 пг/мл сопряжено с ПОУГ II стадии (χ2 = 4,26, р < 0,05 при 2 ст. свободы) и ПОУГ III стадии (χ2 = 5,86, р < 0,01 при 2 ст. свободы).
Как известно, оценка локального уровня цитокинов, продуцируемых в органе-мишени, позволяет более точно выявить изменения, происходящие в органе зрения, в том числе при глаукоме. Результаты проведенных нами исследований констатируют гиперцитокинемию большинства протестированных медиаторов в общей когорте пациентов за исключением – IL-10, TGFβ1. Наиболее нарастал уровень IL-2 (в 7,5 раза), IL-17 (в 7 раз), IL-1β (в 5 раз), несколько меньше увеличивалось содержание IFNγ и IL-4 (в 2 раза), SRIL-2 (в 1,6 раза), TGF β2 (в 1,5 раза). Концентрация IL-10 в среднем была в пределах референсных величин, а содержание TGF β1 снижалось.
Анализ локального содержания цитокинов в зависимости от стадии процесса позволил выявить целый ряд закономерностей, которые в целом свидетельствуют о разных патогенетических механизмах ПОУГ и ПЗУГ (табл. 3). У пациентов с ПОУГ уже на ранней стадии зарегистрирована гиперпродукция IL-17 и IL-10, умеренное увеличение IL-1β, TGFβ2, SRIL-2 на фоне дефицита IFNγ и снижения TGFβ1. Расчет соотношения IFNγ к IL-4 позволил констатировать, что у этой категории пациентов превалирует Th 2 тип иммунного ответа на фоне гиперактивации Th 17 типа. При II стадии ПОУГ отмечено увеличение локального уровня Th 1 маркерного цитокина – IFNγ, повышение содержания IL-1β, IL-2 и его растворимого рецептора. Сохраняется увеличение TGFβ2 и IL-17, но значения последнего достоверно ниже, чем при I стадии болезни. Выявлен пониженный уровень TGFβ1 (не отличающийся от I стадии ПОУГ), определен дефицит IL-10. Проводя комплексную оценку локального уровня цитокинов при II стадии ПОУГ, выявлен Th 1 тип ответа с угнетением противовоспалительной активности клеток врожденного иммунитета.
В продвинутой стадии ПОУГ зафиксировано нарастание как ранних, так поздних провоспалительных цитокинов – IL-1β и IL-6 и повышенный уровень (не отличающийся от II стадии) IL-17 и IFNγ. Выявлено относительное снижение (до референсных величин) локальной концентрации IL-2 и его растворимого рецептора, что может свидетельствовать об истощении их продукции или повышенном образовании соответствующих комплексов.
Оценка противовоспалительных медиаторов у пациентов с III стадией ПОУГ показала изменение баланса в сторону усиления продукции и секреции большинства из них: в 4 раза увеличился уровень IL-4, статистически значимо (по сравнению с контролем и I стадией ПОУГ) нарастало содержание TGFβ2, концентрация IL-10 умеренно повышалась (по сравнению со II стадией ПОУГ). Отличительным признаком ПОУГ ІІІ стадии был локальный дефицит TGFβ1 (табл. 3). Увеличение IFNγ и IL-4 с превалированием уровня последнего, характеризует Th 2 тип иммунного ответа при ПОУГ III стадии.
Таким образом, при анализе цитокинового профиля установлено, что в сыворотке крови пациентов с глаукомой определяется повышение уровня IL-1β, IL-6, IL-2, IL-17 и TGFβ2 и снижение количества IL-4, при этом в целом при ПОУГ регистрируется Тh I тип иммунного ответа при ПОУГ и Th I/Th II тип при ПЗУГ.
У пациентов с ПОУГ зарегистрированы различия системного и локального цитокинового профиля, зависящие от стадии болезни. Показана существенная роль IL-17 в патогенезе ПОУГ и оценке ее степени тяжести. Изменения локального цитокинового профиля сопряжены со стадией глауком. При ПОУГ I стадии выявлен Th 17/Th II тип иммунного ответа. При ПОУГ II стадии зарегистрирован Th I тип ответа с угнетением противовоспалительной активности клеток врожденного иммунитета. Третья стадия ПОУГ характеризовалась Th II типом иммунного ответа.
При I стадии ПЗУГ локально большинство цитокинов было в пределах референсных значений, за исключением умеренного повышения SRIL-2 и относительного увеличения TGFβ2. В сыворотке крови у этих пациентов также не выявлено существенных колебаний исследованных цитокинов. Зафиксировано умеренное повышение IL-4 и сниженный уровень SRIL-2.
У пациентов со II стадией ПЗУГ зафиксировано умеренное увеличение IL-1β, IL-17 и TGFβ1. Цитокиновый профиль слезной жидкости при II стадии ПЗУГ имел больше отличий: определены гиперпродукция IL-2, SRIL-2, IL-17, повышение IL-1β.
При III стадии ПЗУГ сывороточный профиль цитокинов характеризовался выраженным увеличением TGFβ1, недостаточностью TGFβ2, повышением уровня IL-6 и IL10. Особенностью локального цитокинового профиля при III стадии ПЗУГ было увеличение TGFβ1, IFNγ и относительное повышение IL-10.
Рецензенты:
Запорожец Т.С., д.м.н., главный научный сотрудник лаборатории иммунологии, ФГБУ «Научно-исследовательский институт эпидемиологии и микробиологии имени Г.П. Сомова» СО РАМН, г. Владивосток;
Просекова Е.В., д.м.н., профессор, заведующая кафедрой клинической лабораторной диагностики, общей и клинической иммунологии, ГБОУ ВПО «Тихоокеанский государственный медицинский университет» Минздрава России, г. Владивосток.
Работа поступила в редакцию 04.02.2014.
Библиографическая ссылка
Маркелова Е.В., Кириенко А.В., Чикаловец И.В., Догадова Л.П. ХАРАКТЕРИСТИКА СИСТЕМЫ ЦИТОКИНОВ И ЕЕ РОЛЬ В ПАТОГЕНЕЗЕ ПЕРВИЧНЫХ ГЛАУКОМ // Фундаментальные исследования. 2014. № 2. С. 110-116;URL: https://fundamental-research.ru/ru/article/view?id=33556 (дата обращения: 28.02.2026).



