В настоящее время гидроксиапатит Cа10(PO4)6(OH)2 (ГАП) представляет значительный интерес в качестве синтетического материала для костной трансплантации. Главное преимущество такого материала состоит в том, что он обладает высокой биологической совместимостью и остеокондуктивностью in vivo, имеет большое сходство по составу с костью животных и людей, не вызывает аллергических реакций и не токсичен [4]. Однако его клиническое применение остается ограниченным из-за высокой хрупкости и низкой скорости резорбции при контакте с межтканевыми жидкостями в организме по сравнению с некоторыми биологически активными стеклами и стеклокерамикой. Рассмотрение сложной химии костной ткани дает объяснение медленной остеоинтеграции имплантатов на основе ГАП. Несмотря на то, что костная ткань по существу имеет кальций-фосфатный состав, она также содержит значительные концентрации других ионов, способных к замещению на различные катионы и анионы, присутствующие в апатитовой структуре. Тип и количество ионов замещения в апатитовой фазе варьируются от нескольких массовых процентов (например, CO32–) до сотых и тысячных долей процента (например, Mg2+ или Sr2+). Эти ионные замещения приводят к формированию сложных структур на кристаллохимическом уровне и оказывают важное влияние на скорость растворения и биологическую активность костной ткани [5–6].
Исследование роли кремния в костной ткани ведется с начала 1970-х годов. Карлайл [8] сообщал, что кремний (~5 % масс.) содержится в активных зонах роста, таких как остеоиды молодых костей мышей и крыс, а дефицит кремния приводит к аномальному развитию скелета. Подобные исследования Шварца и Милна [7] на крысах показали, что дефицит кремния приводит к деформации черепа в результате формирования несовершенных минеральных кристаллов, а также доказали прямую зависимость между долей кремния и минерализацией кости. На физиологическом уровне кремний играет положительную роль в кальцификации костей и обмене веществ, поэтому предполагается, что включение сопоставимых количеств силикатных ионов в структуру ГАП может также повысить биоактивность этих имплантатов. Биоактивность – комплексная характеристика совместимых с организмом материалов, учитывающая помимо биологических процессов роста и дифференциации клеток скорость растворения материала в слабокислой среде, создаваемой определенными группами клеток и скорость осаждения гидроксиапатита из межтканевой жидкости организма на поверхности материала [1]. Кроме того, сорбционная способность тоже является важной характеристикой для биоматериалов.
Цель работы – исследование биоактивности и сорбционных свойств различных синтетических образцов наноразмерного Si-ГАП.
Материалы и методы исследования
Различные образцы наноразмерного Si-ГАП (Ca10(PO4)6-x(SiO4)x(OH)2-x, 0 ≤ x ≤ 2) были синтезированы методом осаждения из растворов, описанным в работе [2]. В качестве реагентов были использованы насыщенный раствор гидроксида кальция, раствор ортофосфорной кислоты. В качестве реагента – «поставщика» аниона SiO44– выбрали тетраэтоксисилан. Средний размер кристаллов полученных порошков определили методом Williamson‒Hall на дифрактометре Rigaku Ultima IV, а их удельную поверхность – методом низкотемпературной адсорбции и термодесорбции азота (метод БЭТ) на газо-адсорбционном анализаторе ТriStar II 3020.
Для оценки биоактивности Si-ГАП были выбраны два метода исследования:
1) динамический метод – путем фиксации изменения значений рН при растворении образцов Si-ГАП в разбавленной соляной кислоте. Навеску 0,1 г образца Si-ГАП с точностью 0,0002 г помещали в 50 мл раствора хлороводородной кислоты с С(1/1НCl) = 10–3 М и измеряли значение pH раствора с помощью рН-метра Metter Toledo c периодичностью 2 минуты при непрерывном перемешивании.
2) статический метод – путем аналитического определения концентрации катионов кальция при растворении образцов Si-ГАП в ацетатном буферном растворе с разным временем экспозиции. Навески Si-ГАП массой 0,1 ± 0,0002 г помещали в химические стаканы, содержащие 50 мл ацетатного буферного раствора с pH = 5,5, перемешивали и оставляли. По окончании требуемого времени экспозиции в коническую колбу отбирали точно 10 мл исследуемого раствора, добавляли 20 мл бидистиллированной воды, 2–4 капли концентрированного раствора аммиака и титровали раствором С(1/2 ЭДТА) = 5·10–3 М в присутствии эриохрома черного – Т до перехода окраски в точке эквивалентности от красного до синего. Массовый процент выхода кальция в раствор в зависимости от исходного содержания кальция в образце Si-ГАП рассчитывали по формуле
η = 1б25VT,
где Vт – объем титранта, израсходованный на титрование, мл.
С целью оценки сорбционной способности образцов Si-ГАП в качестве сорбата выбрали ионы меди. Навески Si-ГАП массой 0,3 ± 0,0020 г помещали химические стаканы, содержащие 25 мл раствора сульфата меди с концентрацией ионов меди от 0,01 до 0,1 М. Время экспозиции составило 3 часа. Равновесные концентрации растворов меди были определены спектрофотометрическим методом по методике [3] при длине волны 610 нм в кюветах толщиной 10,02 мм на спектрофотометр LEKI SS1104.
Результаты исследования и их обсуждение
На рис. 1 представлены результаты исследования биоактивности ГАП (х = 0) и различных образцов Si-ГАП (х = 0,5; 1,0; 1,5; и 2,0) двумя методами.
а 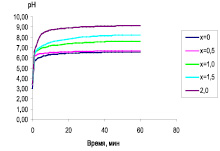 б
б 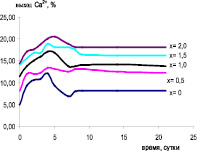
Рис. 1. Динамика растворения образцов Si-ГАП в HCl (а) и ацетатном буферном растворе (б)
Диаграммы, приведенные на рис. 1, а и б, показывают, что оба метода дают сопоставимые результаты. Образцы Si-ГАП имеют повышенную резорбируемость по сравнению с немодифицированным ГАП. Это подтверждает, что внедрение силикат-ионов в решетку ГАП приводит к увеличению его биоактивности и зависит от содержания ионов кремния в образце. Самой высокой биоактивностью обладает Si2,0-ГАП (рис. 1, а). Интересно отметить, что выход кальция образцов Si-ГАП в ацетатный буферный раствор быстро растет в начальное время исследования и через 4 суток достигает максимального значения, после которого содержание кальция в растворе уменьшается до восьмых суток и далее удерживается постоянное (рис. 1, б). Объяснение выявленного факта требует дополнительного изучения. Предполагается, что в ацетатном буферном растворе образцы Si-ГАП постепенно растворяются и выделяются ионы Са2+. Когда концентрация Са2+ достигает насыщения в данном растворе, происходит сорбция этих ионов на оставшихся частях Si-ГАП. Считается, что размер частиц и их удельная поверхность являются определяющими фактами для сорбционной способности данного материала. Из табл. 1 видно, что размер кристаллов частиц Si-ГАП примерно в 3 раза меньше, чем немодифицированного ГАП. При повышении содержания кремния в образцах Si-ГАП наблюдается уменьшение размера кристаллов и увеличение их удельной поверхности, и, соответственно, улучшает сорбционные свойства ГАП, что подтверждается результатами исследования сорбции на них ионов меди (рис. 2).
Таблица 1
Размер кристаллов и удельная поверхность образцов Si-ГАП
|
x |
Содержание Si в образце, % |
Размер кристаллов, нм |
Удельная поверхность, м2/г |
|
0,0 |
0,00 |
65,51 |
27,70 |
|
0,5 |
1,40 |
19,29 |
59,07 |
|
1,0 |
2,85 |
12,78 |
65,99 |
|
1,5 |
4,31 |
11,37 |
108,97 |
|
2,0 |
5,81 |
11,68 |
122,22 |
а 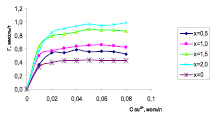 б
б 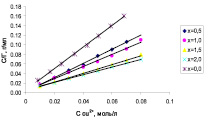
Рис. 2. Изотерма (а) и линеаризованная изотерма (б) сорбции ионов меди на образцах Si-ГАП
Полученные изотермы сорбции ионов меди на образцах Si-ГАП полностью соответствуют изотермам мономолекулярной адсорбции Лэнгмюра (рис. 2, а). Результаты исследования показывают, что Si-ГАП оказывает повышенную сорбционную способность по сравнению с немодифицированным ГАП, и эта величина прямо зависит от содержания кремния. Наилучшей сорбционной активностью по отношению к сорбату обладает Si2,0-ГАП.
Из линеаризованной изотермы (рис. 2, б) определили величину предельной сорбции Г∞ образцов Si-ГАП по формуле
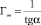 ,
,
где tgα – тангенс угла наклона линеаризованной изотермы (табл. 2). Величина предельной сорбции Si2,0-ГАП по меди составляет 1,27 ммоль/г, что примерно в 3 раза больше предельной сорбции немодифицированного ГАП.
Таблица 2
Величины предельной сорбции образцов Si-ГАП
|
х |
0,00 |
0,50 |
1,00 |
1,50 |
2,00 |
|
tgα, г/ммоль |
2,27 |
1,45 |
1,28 |
0,93 |
0,79 |
|
Г∞, ммоль/г |
0,44 |
0,69 |
0,78 |
1,08 |
1,27 |
Одним из предполагаемых механизмов сорбции является ионный обмен. Предпосылкой для этого является то, что ионы кальция в кристаллической решетке Si-ГАП могут быть замещены на катионы бивалентных металлов близкого радиуса. Для уточнения механизма сорбции меди на Si-ГАП измерялась концентрация ионов кальция в растворе после сорбции на образце Si2,0-ГАП методом комплекснометрического титрования, который описан выше. Масса навески Si2,0-ГАП составила 0,5 ± 0,0020 г. Разные концентрации растворов сульфата меди были выбраны так, чтобы ионы меди полностью сорбировались на навесках Si2,0-ГАП. В данной работе концентрации растворов сульфата меди составили 0,0050; 0,0075; 0,0100; 0,0150 и 0,0200 моль/л. В качестве холостого раствора, не содержащего ионы меди, использовали бидистиллированную воду. Результаты исследования представлены на рис. 3.
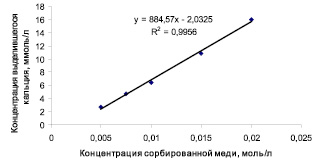
Рис. 3. Зависимость концентрации выделившегося Са2+ в результате сорбции ионов меди на образце Si2,0-ГАП от концентрации сорбированных ионов меди
Линейная зависимость между количеством сорбированных ионов Cu2+ и выделившихся Са2+ является доказательством о ионно-обменном механизме сорбции ионов меди на Si-ГАП. Тем не менее ионный обмен – только один из возможных механизмов сорбции, т.к., согласно результатам аппроксимации полученных данных, только примерно половины выделившихся ионов кальция замещаются на ионы меди.
Выводы
1. Внедрение силикат-ионов в кристаллическую решетку ГАП повышает его биоактивность, которая имеет прямую зависимость от содержания кремния в образцах Si-ГАП.
2. По сравнению с немодифицированным ГАП образцы Si-ГАП имеют повышенную сорбционную активность к ионам меди, которая возрастает при увеличении содержания кремния. Предельная сорбция ионов меди на различных образцах Si-ГАП составляет от 0,69–1,27 ммоль/г. Установлено, что одним из механизмов данной сорбции является ионно-обменный.
3. Полученные результаты исследования дают основание полагать, что наноразмерный кремнийсодержащий гидроксиапатит является перспективным биоматериалом для ортопедического и дентального протезирования.
Работа выполнена в рамках договора об условиях предоставления и использования субсидии на реализацию комплексного проекта по созданию высокотехнологичного производства, выполняемого с участием российского высшего учебного заведения № 13.G25.31.0006 от 07.09.2010 г. «Биосовместимые композиционные и кальцийсодержащие остеопластические и лечебно-профилактические материалы для медицины».
Рецензенты:
Евтушенко Е.И., д.т.н., профессор, зав. кафедрой стекла и керамики, Белгородский государственный технологический университет им. В.Г. Шухова, г. Белгород;
Жилякова Е.Т., д.фарм.н., профессор, зав. кафедрой фармацевтической технологии, управления и экономики здравоохранения, ФГАОУ ВПО «Белгородский государственный национальный исследовательский университет», г. Белгород.
Работа поступила в редакцию 27.01.2014.
Библиографическая ссылка
Трубицын М.А., Габрук Н.Г., Олейникова И.И., Ле Ван Тхуан, Доан Ван Дат, Хоанг Вьет Хунг ИССЛЕДОВАНИЕ БИОАКТИВНОСТИ И СОРБЦИОННЫХ СВОЙСТВ НАНОРАЗМЕРНОГО КРЕМНИЙСОДЕРЖАЩЕГО ГИДРОКСИАПАТИТА // Фундаментальные исследования. 2014. № 1. С. 71-75;URL: https://fundamental-research.ru/ru/article/view?id=33507 (дата обращения: 22.02.2026).



