Основой здорового питания является сбалансированность рациона по всем пищевым компонентам, однако в результате переработки, использования неполноценного по химическому составу пищевого сырья, эндогенных причин организм не получает необходимое количество незаменимых компонентов [12]. Недостаток питательных веществ запускает адаптационные механизмы, что является отражением стресс-реакции и ведёт в конечном счёте к различным функциональным расстройствам [3]. Известно, что важную роль в функционировании репродуктивной системы играет целый ряд пищевых факторов, таких как белковая пища, витамины-антиоксиданты (витамин E, витамин C), а также минералы (цинк, селен) [9]. Вместе с тем в последнее время ведётся активная пропаганда различных диет, что многими воспринимается буквально как тотальный отказ от еды в той или иной степени. Указанное обстоятельство усугубляется низким культурным уровнем населения в вопросах рационального питания и отсутствием навыков ведения здорового образа жизни [7]. Кроме того, в России, как и во всём мире, стала ощущаться тенденция роста мужской субфертильности, следствием которой, в частности, стал низкий уровень воспроизводства населения [6]. В этой связи представляет интерес исследование влияния бедной белком и лишённой витаминов и минералов пищи на функциональное состояние мужской репродуктивной системы.
Цель исследования – рассмотреть эффекты недостатка питательных веществ на функциональное состояние разных звеньев репродуктивной системы самцов крыс.
Материалы и методы исследования
Исследование проводили на самцах крыс линии Wistar массой 200–220 г. Животных содержали на дистиллированной воде и очищенном рисе в умеренном количестве (5–10 г на животное) в течение 30 дней. За один день до декапитации животные содержались лишь на дистиллированной воде. Эксперименты на животных осуществлялись в соответствии с требованиями Женевской конвенции (1985). По окончании экспериментальных воздействий в крови измеряли перекисную резистентность эритроцитов (ПРЭ) [8], а также исходный уровень малонового диальдегида (МДА) и кинетические показатели перекисного окисления липидов (ПОЛ) в тканях медиобазального гипоталамуса и семенников [11]. Кроме того, измеряли относительные массы гипофиза (мг %) и семенников (%), а также количество дефективных эпидидимальных сперматозоидов [10]. Статистическую обработку полученных данных выполняли с использованием критерия Стьюдента (t), различия считали достоверными при p < 0,05 [2].
Результаты исследования и их обсуждение
Недостаток питательных веществ вызвал падение массы животных, которая оказалась на 27 % ниже по сравнению с контролем (P < 0,01) к моменту окончания экспериментальных воздействий (175 ± 15,0 и 240 ± 9,8 г соответственно).
В условиях недостаточного поступления питательных веществ (белка, витаминов, минералов) запускаются адаптационные механизмы, отражающие стресс-реакцию (пищевой стресс). О развитии окислительного стресса на фоне снижения антиоксидантного статуса (АО-статуса) животных ввиду недостаточного питания свидетельствует факт усиления перекисного гемолиза эритроцитов (рис. 1).
В условиях пищевого стресса отмечается повышение исходного уровня МДА (МДАисх) и кинетических показателей ПОЛ (спонтанного спПОЛ и аскорбатзависимого асПОЛ) в ткани семенников, что свидетельствует об интенсификации процессов свободнорадикального окисления (СРО) в указанной ткани (табл. 1).
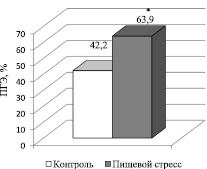
Рис. 1. Изменение уровня перекисного гемолиза эритроцитов (ПГЭ) в условиях недостаточного поступления питательных веществ. * P < 0,05 – в сравнении с контролем
Таблица 1
Изменение показателей ПОЛ в ткани семенников в условиях пищевого стресса, вызванного недостаточным поступлением питательных веществ
|
Условия опыта |
n |
МДАисх, нмоль/0,5 г |
Кинетические показатели, нмоль МДА/ч |
|
|
спПОЛ |
асПОЛ |
|||
|
Контроль |
10 |
4,89 ± 0,151 |
45,97 ± 0,840 |
48,74 ± 0,702 |
|
Пищевой стресс |
10 |
7,02 ± 0,032 |
49,48 ± 1,084 |
54,09 ± 1,183 |
|
P |
P < 0,001 |
P < 0,05 |
P < 0,01 |
|
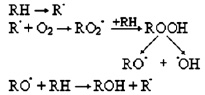
Развитие окислительного стресса, сопряжённого с радикальным окислением ненасыщенного фосфолипида RH, можно выразить следующей схемой:
Усиление процессов липопероксидации должно коррелировать с угнетением функционального состояния органа [4]. Подтверждением указанного обстоятельства является снижение относительной массы семенников более чем в 2 раза (55,55 %) (табл. 2).
Говоря о регуляторном влиянии со стороны гипоталамо-гипофизарного комплекса на семенники в условиях недостатка питательных веществ, следует отметить коррелятивную связь между падением относительной массы семенников и гипофиза в соответствии с коэффициентом положительной корреляции r = +0,461 (табл. 2). Падение относительной массы гипофиза в условиях пищевого стресса свидетельствует об угнетении его инкреторной функции в целом и позволяет допустить факт нарушения функционального состояния семенников за счёт угнетения выброса аденогипофизом тропных гормонов и, в частности, лютропина, регулирующего выработку клетками Лейдига тестостерона.
Угнетение секреторной функции аденогипофиза, в свою очередь, можно связать с угнетением функционального состояния высшего центра регуляции вегетативных функций – гипоталамуса, в медиобазальной и преоптической области которого сосредоточены центры регуляции репродуктивной функции, в частности, супрахиазматическое и аркуатное ядра. Об угнетении функционального состояния гипоталамуса в условиях пищевого стресса свидетельствует факт интенсификации процессов СРО. В пользу указанного обстоятельства говорит повышение исходного уровня МДА на 58 % (P < 0,001) и усиленная динамика его накопления в условиях инкубации (рис. 2).
Таблица 2
Изменение относительной массы семенников и гипофиза самцов крыс в условиях пищевого cтресса
|
Условия опыта |
n |
Относительная масса семенников, % |
Относительная масса гипофиза, мг % |
|
Контроль |
10 |
0,63 ± 0,058 |
3,57 ± 0,220 |
|
Пищевой стресс |
10 |
0,28 ± 0,031 |
2,75 ± 0,121 |
|
P |
P < 0,001 |
P < 0,01 |
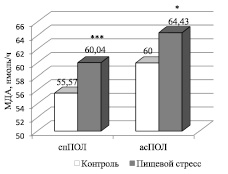
Рис. 2. Кинетические показатели ПОЛ в условиях экспериментального пищевого стресса, вызванного недостатком питательных веществ. * P < 0,05; *** P < 0,001 – в сравнении с контролем
Уровень МДА и кинетические показатели ПОЛ в гипоталамической ткани превышают, однако, таковые в ткани семенников, что вполне естественно, учитывая, что гипоталамус как часть нервной ткани очень богат основным субстратом липопероксидации – липидами [5]. Усиление процессов СРО в гипоталамической ткани свидетельствует о нарушении его функционального состояния в целом. Учитывая регуляторную роль гипоталамуса в отношении гипофиза, можно заключить, что угнетение функционального состояния гипофиза вызвано блокадой выброса рилизинг-факторов в область срединного возвышения, в частности, гонадолиберина. Таким образом, можно заключить, что нарушение функционального состояния семенников в условиях пищевого стресса вызвано не только усиленной динамикой процессов СРО в самой тестикулярной ткани, но и угнетающим регуляторным влиянием со стороны гипоталамо-гипофизарного комплекса. Указанное обстоятельство о регуляторном влиянии гипоталамо-гипофизарного комплекса в условиях стресса находится в соответствии с ранними работами Б.В. Алешина и Л.А. Бондаренко (1982), которые связывали угнетение тестикулярного андрогенопоэза в условиях стресса с эндокринными сдвигами в системе «гипоталамус-гипофиз» [1].
В подтверждение всего вышесказанного был проведён морфологический анализ эпидидимальных сперматозоидов. В условиях проводимого эксперимента визуально отмечено снижение общего количества эпидидимальных сперматозоидов. Процент дефективных форм сперматозоидов в контрольной группе составил 7,0 ± 0,54 %, в то время как в опытной группе их количество превосходило более чем в 4,5 раза и составило 32,4 ± 1,63 % (P < 0,001). Ведущими патологиями были облом и потеря хвоста сперматозоидов, что коррелирует с повышенной динамикой процессов СРО в тестикулярной ткани в условиях низкого антиоксидантного статуса животных, вызванного недостатком питательных веществ.
Заключение
Проведённое исследование позволяет прийти к следующему заключению.
1. Обнаружена взаимосвязь между уровнем процессов СРО и функциональным состоянием гонад.
2. Угнетение функционального состояния семенников в условиях пищевого стресса осуществляется с помощью двух механизмов:
1) за счёт интенсификации процессов СРО в ткани семенников;
2) за счёт регуляторного влияния со стороны гипоталамо-гипофизарного комплекса.
3. Ведущими патологическими нарушениями эпидидимальных сперматозоидов являются облом и потеря хвоста сперматозоидов, а также снижение их общего количества.
Рецензенты:
Великородов А.В., д.х.н., профессор, зав. кафедрой фармацевтической химии Астраханского государственного университета, г. Астрахань;
Бойко О.В., д.м.н., профессор кафедры биохимии с курсом лабораторной диагностики, ГБОУ ВПО «Астраханская государственная медицинская академия» Минздрава России, г. Астрахань.
Работа поступила в редакцию 27.01.2014.
Библиографическая ссылка
Логинов П.В., Николаев А.А. СОСТОЯНИЕ РЕПРОДУКТИВНОЙ ФУНКЦИИ САМЦОВ БЕЛЫХ КРЫС В УСЛОВИЯХ НЕДОСТАТКА ПИТАТЕЛЬНЫХ ВЕЩЕСТВ // Фундаментальные исследования. 2014. № 1. С. 67-70;URL: https://fundamental-research.ru/ru/article/view?id=33506 (дата обращения: 24.01.2026).



