Нарушения кислотно-основного и водно-электролитного баланса являются скорее правилом, чем исключением у больных, находящихся в отделениях интенсивной терапии. Всегда, когда имеется дисфункция жизненно-важных систем респираторной, сердечно-сосудистой и мочевыделительной систем, становится невозможной ауторегуляция баланса кислот, оснований, электролитов и воды [3]. Продукты анаэробного метаболизма, вызывающие ацидоз, представляют реальную опасность для организма, так как способны не только нарушать функции, но и приводить к морфологическим изменениям в различных органах и тканях [4]. Накопление молочной кислоты, известной в качестве крупного донора протонов, изменяет гемостатические и реологические свойства крови, усиливает гипоксию тканей и уменьшает функцию энергообразования в клетках вследствие разобщения гликолиза и цикла Кребса, снижает ресинтез АТР и ведет к увеличению энтропии в организме [1–6].
Деятельность печени, также как и легких, почек и кожи компенсирует сдвиги рН. В то же время при гипоксии и ацидозе, возникающем вследствие нарушения снабжения тканей кислородом или кровью, уменьшается активность пируватдегидрогеназного комплекса и снижается окислительное декарбоксилирование пирувата. В этих условиях равновесие реакции пируват ↔ лактат сдвинуто в сторону образования лактата, уменьшается ресинтез АТФ, что, следовательно, ведёт к снижению скорости глюконеогенеза. Печень длительное время после начала шока является потребителем лактата, но в условиях гипоксии и ацидоза становится таким же производителем лактата, как и другие ткани и, в конце концов, после последовательной утраты всех своих функций поражение шоковой печени превращается в поражение всего организма [4].
Целью работы явилось изучение влияния ацидоза на гемостаз и морфологию печени.
Материалы и методы исследования
Исследования проведены на беспородных животных (42 кошках). Лактат-ацидоз создавали введением 3 % раствора молочной кислоты в изотоническом растворе NaCl в бедренную вену под гексеналовым наркозом. Различный сдвиг рН в кислую сторону достигали дозированным капельным введением лактата обычно от 20 до 38 капель в мин. под контролем рН (рН-метр МР 120ВЕ). По достижении необходимого значения рН (от 7,2, 7,0, 6,8, 6,5) поддерживали необходимый уровень соответственно 30, 60, 120, 180 мин, затем брали пробы крови для изучения показателей системы гемостаза и кусочки органов для гистологических, гистохимических исследований и электронной микроскопии. Были использованы методы окрашивания морфологического материала: гематоксилин-эозином, гематоксилин-пикрофуксином по Ван-Гизон, гематоксилином Вейгерта в модификации Харта, импрегнация азотнокислым серебром по Футу. Электронная микроскопия производилась при рН 7,4 крови (контроль), 7,2 и 7,0 (опыт) через 15 и 30 мин после начала ацидоза. Ультраструктурный анализ тканей производили с помощью микроскопа IEM-7A (Япония) при ускоряющем напряжении 50 кВ и увеличениях на экране микроскопа 6000–30000 раз. Эвтаназия животных проводилась передозированием гексеналового наркоза. В работе с экспериментальными животными были соблюдены требования, изложенные в «Методических рекомендациях по проведению медико-биологических исследований с использованием животных» от 1985 г.
Результаты исследования и их обсуждение
Нами было проведено сравнительное исследование показателей гемостаза в крови бедренной артерии, печеночной и воротной венах. Изначально наиболее продолжительным время рекальцификации было в крови бедренной артерии, наибольшая скорость свертывания наблюдалась в крови, притекающей к печени. Тромбопластическая активность была ниже в крови из бедренной артерии и более высокой в крови воротной вены. Одновременно с ацидозом наблюдалась активация процесса свертывания крови, взятой из портальной системы. Эти данные свидетельствует о том, что к печени притекает кровь с высокой тромбопластической активностью и низким уровнем рН. Между тем в крови, оттекающей от печени, подобных сдвигов обнаружить не удалось (табл. 1). Приведенные данные свидетельствуют о важной роли печени в регуляции свертывания крови, а также восстановлении рН среды до физиологических пределов. Антикоагулянтная активность до инъекции лактата была самой высокой в крови печеночной вены. Полученные данные подтверждают мысль о поступлении из печени антикоагулянтов, обладающих антитромбиновым действием. Приток крови к печени, обогащенной молочной кислотой, значительно снижает уровень антикоагулянтов, в результате чего тромбиновое время укорачивается. Фибринолитическая активность, по нашим данным, была выше в крови из воротной вены по сравнению с артерией и печеночной веной. Снижение фибринолиза может быть связано с поступлением в кровоток ингибиторов плазмина. Фибриназная активность была наибольшей в крови бедренной артерии. Введение кислого раствора в воротную систему печени сопровождалось снижением фибриназной активности во всех изучаемых пробах крови, но в большей степени в крови из воротной вены. На фоне введения молочной кислоты в крови воротной и печеночной вен появлялись продукты деградации фибриногена, что является признаком развития ДВС-синдрома (табл. 1).
Таблица 1
Влияние введения молочной кислоты в воротную вену на показатели свертывания крови, оттекающей от печени (М ± m)
|
Изучаемые показатели n = 14 |
Контроль |
Опыт |
||||
|
Бедренная артерия |
Нижняя полая вена |
Воротная вена |
Бедренная артерия |
Нижняя полая вена |
Воротная вена |
|
|
рН 7,44 |
рН 7,39 |
рН 7,39 |
рН 7,38 |
рН 7,34 |
рН 7,32 |
|
|
Время рекальцификации (с) |
106,6 ± 6,2 |
94,7 ± 6,21 р < 0,1 |
87,2 ± 7,13 р < 0,05 |
97,8 ± 3,22 р < 0,05 |
97,4 ± 7,37 р < 0,1 |
76,2 ± 7,25 р < 0,2 |
|
Протромбиновое время (с) |
10,8 ± 0,19 |
11,8 ± 0,17 р < 0,001 |
10,9 ± 0,18 p < 0,2 |
9,9 ± 0,22 р < 0,01 |
10,7 ± 0,22 р < 0,01 |
10,3 ± 0,24 р < 0,05 |
|
Тромбиновое время (с) |
40,4 ± 0,9 |
43,5 ± 0,90 р < 0,02 |
39,8 ± 0,90 p < 0,1 |
39,9 ± 0,68 р < 0,1 |
38,1 ± 1,34 p < 0,02 |
38,8 ± 0,89 p < 0,4 |
|
Тромбиновое время (с) |
19,9 ± 0,7 |
21,9 ± 0,60 р < 0,02 |
19,4 ± 0,55 р < 0,1 |
18,3 ± 1,16 р < 0,3 |
18,1 ± 0,73 р < 0,01 |
18,7 ± 0,45 р < 0,2 |
|
Фибринолиз (мин) |
73,6 ± 5,2 |
58,9 ± 3,33 p < 0,01 |
44,6 ± 6,92 p < 0,01 |
61,8 ± 3,79 p < 0,05 |
45,8 ± 5,64 p < 0,1 |
36,4 ± 2,62 p < 0,05 |
|
Фактор ΧΙΙΙ (c) |
105,5 ± 5,6 |
91,8 ± 5,46 p < 0,06 |
84,4 ± 6,50 p < 0,05 |
78,5 ± 27,94 p < 0,4 |
59,1 ± 28,6 p < 0,3 |
48,9 ± 30,58 p < 0,3 |
|
ПДФ (мг %) |
3,9 ± 0,3 |
4,2 ± 0,2 p < 0,2 |
6,2 ± 0,3 p < 0,01 |
8,2 ± 0,4 p < 0,001 |
10,4 ± 0,4 p < 0,001 |
12,6 ± 0,3 p < 0,001 |
Примечание. р – достоверность различий между контролем и опытом.
Сравнительное исследование показателей гемостаза в крови бедренной артерии и воротной вены показало, что при рН крови 7,2–7,0 происходит гиперкоагулемия, укорачиватся время свертывания крови, снижается антикоагулянтная активность крови. Понижение рН крови ниже 7,0 и увеличении продолжительности ацидоза до 120–180 минут сопровождается гипокоагуляцией, коагулопатией потребления, значительным снижением фибриногена и появлением продуктов деградации фибрина. Наиболее выраженные сдвиги в системе гемостаза были выявлены в пробах крови из воротной вены, здесь же определялся более низкий уровень рН крови (табл. 2).
Таблица 2
Изменение свертывания крови в воротной вене и общей циркуляции при лактат-ацидозе
|
Изучаемые показатели n = 14 |
Контроль |
Опыт |
||||
|
Бедренная артерия |
Воротная вена |
Бедренная артерия |
Воротная вена |
Бедренная артерия |
Воротная вена |
|
|
рН 7,4 |
рН 7,36 |
рН7,0 |
рН 7,0 |
рН 6,8 |
рН 6,8 |
|
|
Время рекальцифика ции(с) |
84,4 ± 3,8 |
73,2 ± 3,4 р < 0,05 |
61,8 ± 1,6 р < 0,001 |
57,0 ± 2,0 р < 0,001 |
147,5 ± 9,0 р < 0,001 |
138,3 ± 10, 6 р < 0,001 |
|
Протромбиновое время (с) |
23,7 ± 1,1 |
22,8 ± 1,1 Р < 0,4 |
27,2 ± 1,4 р < 0,02 |
25,8 ± 1,4 Р < 0,1 |
31,3 ± 2,9 р < 0,05 |
38,0 ± 2,4 р < 0,001 |
|
Тромбиновое время (с) |
41,0 ± 2,65 |
31,0 ± 2,85 р < 0,01 |
35,2 ± 3,28 Р < 0,1 |
27,2 ± 0,98 р < 0,001 |
нет сгустка |
нет сгустка |
|
Фактор XIII (с) |
143,0 ± 17,1 |
133,7 ± 13,6 р < 0,5 |
> 300 р < 0,001 |
> 300 р < 0,001 |
> 300 р < 0,001 |
> 300 р < 0,001 |
|
Количество фибриногена (мг/мл) |
16,4 ± 1,1 |
18,9 ± 1,4 Р < 0,2 |
11,4 ± 1,1 р < 0,001 |
12,6 ± 1,3 р < 0,01 |
11,2 ± 2,3 р < 0,05 |
10,3 ± 1,8 р < 0,001 |
|
ПДФ (мкг/л) |
3,9 ± 0,3 |
4,2 ± 0,2 р < 0,2 |
6,2 ± 0,3 р < 0,01 |
8,2 ± 0,4 р < 0,001 |
10,4 ± 0,4 р < 0,001 |
12,6 ± 0,3 р < 0,001 |
Примечания: р – достоверность различий между контролем и опытом, n количество исследований.
На основании полученных данных можно прийти к выводу, что печень при ацидозе играет важную роль в регуляции гемостатической функции крови. Это может быть связано как со способностью печени восстанавливать рН почти до исходного уровня, так и выделять в кровоток антикоагулянты и факторы свертывания крови.
Морфологическое исследование тканей печени позволило выявить целый ряд изменений в зависимости от глубины и продолжительности метаболического ацидоза. При микроскопическом исследовании (рН 7,2 продолжительность ацидоза 30 мин) определяются единичные капли жира в гепатоцитах. Пространства Диссе умеренно расширены, синусные капилляры полнокровны. Рисунок печеночных балок сохранен. Основная масса печеночных клеток имеет ядра округлой и овоидной формы (рис. 1). Просвет печеночных артерий не спавшийся, наблюдается расслоение крови, агрегация форменных элементов, стенки сосудов в состоянии отека. В венах – полнокровие, расслоение крови на жидкую часть и форменные элементы, венозная стенка в состоянии отека. Центральные вены долек печени полнокровны. Структура печеночных долек сохранена.
При сдвиге рН до 7,0–6,5; на протяжении соответственно 60–180 минут наблюдается агрегация форменных элементов, тромбы, отек сосудистой стенки, десквамация эндотелиоцитов. В центральных отделах печеночных долек определяется мелкоочаговый некроз, некробиоз гепатоцитов, отмечаются очаговые нарушения структуры балок, пространства Диссе расширены. Встречаются вакуолизированные гепатоциты с зернистой дистрофией. Ядра клеток преимущественно шаровидной формы, неравномерно окрашиваются гематоксилином. По периферии печеночных долек структура балок не изменена. Отмечается неравномерная очаговая элиминация гликогена. Гранулы гликогена в основном содержатся вокруг печеночных сосудов (рис. 4).
По данным электронной микроскопии, при метаболическом лактат-ацидозе (рН 7,2–30 мин) обнаружены грубые нарушения в большинстве структур клеток печени. В ядрах гепатоцитов выявляют многочисленные участки расслоения и микронадрывы ядерной мембраны, отмечается маргинация хроматина, неравномерное его распределение по всему срезу. Хроматин образует крупные глыбки, которые располагаются как непосредственно под ядерной мембраной, так и на всей площади среза ядра (рис. 3).
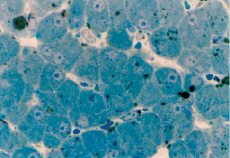
Рис. 1. Поперечный срез печени кошки. Отмечается жировая дистрофия гепатоцитов, нерезко выраженный межклеточный отек, капилляры с уплощенной эндотелиальной выстилкой, сладжи эритроцитов. рН крови 7,2 продолжительность ацидоза 15 минут. Ув.:об.1000. Микрофотография
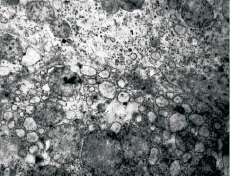
Рис. 2. Печень кошки при метаболическом ацидозе (рН крови 7,0, экспозиция 30 мин). Разрушена плазматическая мембрана клетки, органоиды находятся в межклеточном пространстве. Матрикс митохондрий просветлен, структура крист нарушена, отмечаются признаки вакуольного перерождения цитоплазмы, количество гликогена в клетках снижается. Ув.: 25 000. Электронная микрофотография
В цитоплазме резко уменьшается количество гликогена. Зерна гликогена становятся более прозрачными, имеют низкую плотность. Митохондрии круглой и овоидной формы. Кристы деформированы, их контуры плохо просматриваются, в некоторых органоидах они полностью разрушены. При уровне рН крови 7,2 и экспозиции 30 минут митохондрии, как правило, сохраняют свою целостность. При сдвиге рН до 7,0 на протяжении 30 минут наблюдается разрушение внутренней и наружной мембран митохондрий. Подобного рода морфологические нарушения приводят к блокированию в клетке аэробного фосфорилирования АТФ, так как снижается градиент потенциала Н-ионов в матриксе и межмембранном пространстве, которые в норме обеспечивают необходимый отрицательный заряд, равный 220 mV. Согласно теории Митчелла прекращается движение протонов через F0 F1АТФ-синтетазу и синтез АТФ. Учитывая, что многие митохондрии при рН 7,2 и даже 7,0 сохраняют свою цельность, аэробное образование АТФ сохраняется, хотя и на более низком уровне. Повреждение лизосом ведет к поступлению лизосомальных ферментов в окружающую среду. В клетках обнаруживаются аутофагосомы, жировые включения различного размера (рис. 2, 3). Было выявлено выраженное расширение шероховатого и гладкого эндоплазматического ретикулума, в цитоплазме появляются свободные рибосомы. Перестройки в ядре, снижение гликогена, изменение структуры митохондрий, строения шероховатого эндоплазматического ретикулума, ответственного за белково-синтетические функции нарушает функционирование клеток, ведет к дистрофическим процессам.
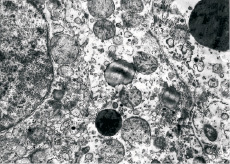
Рис. 3. Печень кошки через 30 минут после «переживания» органа при метаболическом ацидозе (рН крови 7,2). Отдельные митохондрии имеют нарушение структуры матрикса. Наружная мембрана митохондрий не нарушена, структура крист в большинстве случаев сохранена. Наблюдается деструкция цитоплазмы, в которой присутствуют две аутофагосомы. Электронная микроскопия. Ув.: 20 000
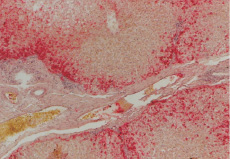
Рис. 4. Печень кошки, рН 7,0–70 мин, Кармин по Бесту, об. 10. Резкое снижение количества гликогена в печеночных дольках, гликоген определяется только по периферии печеночной дольки и отсутствует в гепатоцитах центральной части, вокуольная дистрофия гепатоцитов, венозное полнокровие, тромбоз артерии, резко выражен отек сосудистой стенки
Сдвиг рН в кислую сторону до 7,0 нередко сопровождается нарушением структурной целостности цитоплазматической мембраны. Фрагменты мембран и содержимое цитоплазмы поступают во внеклеточное пространство, кровь и лимфу. Это приводит к дальнейшему повышению гиперкоагулемии, вызванному лактат-ацидозом и развитию ДВС-синдрома.
Таким образом, лактат-ацидоз сопровождается структурными изменениями клеточных элементов печени, приводит к развитию жировой, вакуольной дистрофии, некробиозу и некрозу гепатоцитов. Эти изменения могут сопровождаться нарушением аэробного фосфорилирования, синтетических процессов, стимуляцией процессов гемостаза и приводить к развитию ДВС-синдрома и тромбозу.
Работа поддержана Минобрнауки РФ, Государственное задание по вузу no. 4.3604.2011.
Рецензенты:
Патеюк А.В., д.м.н., профессор кафедры социальной политики, психологии и педагогики профессионального образования, ФГБОУ ВПО «Забайкальский государственный университет», г. Чита;
Степанов А.В., д.м.н., зав. кафедрой безопасности жизнедеятельности и медицины катастроф, ГБОУ ВПО «Читинская государственная медицинская академия», г. Чита.
Работа поступила в редакцию 17.01.2014.
Библиографическая ссылка
Альфонсова Е.В. ВЛИЯНИЕ ЭКСПЕРИМЕНТАЛЬНОГО ЛАКТАТ-АЦИДОЗА НА ГЕМОСТАЗ И МОРФОЛОГИЮ ПЕЧЕНИ // Фундаментальные исследования. 2013. № 12-3. С. 417-422;URL: https://fundamental-research.ru/ru/article/view?id=33420 (дата обращения: 27.02.2026).



