Тяжелая астма составляет 18 % в общей структуре заболевания [4]. Наряду с высокими показателями потребления ресурсов здравоохранения тяжелая бронхиальная астма (БА) ассоциирована с частыми жизнеугрожающими состояниями и высоким риском смерти, что позволяет отнести ее к одной из наиболее актуальных проблем современной медицины [2].
В течение последнего десятилетия достигнут значительный прогресс в изучении молекулярных механизмов тяжелой БА. Так, в многочисленных доказательных исследованиях определены наиболее вероятные причинные факторы и молекулы, лежащие в основе формирования тяжелой БА и терапевтической резистентности, которые могли бы быть использованы как в диагностических целях, так и стать новыми таргетными мишенями терапии БА [8].
В то же время утверждать, что сегодня имеется полное понимание механизмов формирования тяжелой астмы и терапевтической резистентности, не представляется возможным.
Большинство опубликованных исследований обладает рядом ограничений, во-первых, они разнородны по своим целям и задачам, выполнены на неоднородных выборках пациентов с точки зрения степени тяжести и/или уровне контроля болезни субъектов, все это не позволяет объединить результаты этих исследований и сформировать полную теоретическую концепцию.
Во-вторых, опубликовано ограниченное количество работ, в которых в качестве субъектов выступали пациенты с тяжелой терапевтически резистентной БА или представители фенотипов тяжелой астмы.
В этой связи представляется актуальным планирование и выполнение транскриптомного исследования тяжелой астмы, которое позволит оценить профили экспрессии генов, что даст возможность определить механизмы формирования терапевтической резистентности.
Материалы и методы исследования
Было спланировано и проведено по единому протоколу проспективное интервенционное исследование в параллельных группах с продолжительностью лечебного периода 24 недели. Протокол исследования был разработан в соответствии со стандартом ICH GCP и прошел этическую экспертизу.
Диагноз БА был установлен в соответствии с критериями GINA [1]. Было сформировано 2 группы пациентов – легкая персистирующая и тяжелая БА. Клиническое течение заболевания на момент включения в исследование в соответствии с критериями контроля должно было быть расценено как неконтролируемое. В рамках исследования в соответствии с протоколом пациенту назначались следующие фармакотерапевтические режимы: легкая персистирующая БА – флутиказона пропионат (ФП) 250 мкг/сут, тяжелая астма – сальметерол/ФП – 1000 мкг/сут по ФП.
По окончании лечебного периода, в соответствии с оценкой эффективности терапии и критериями ATS (2000), группа пациентов с тяжелой БА апостериорно разделена на терапевтически чувствительных (ТЧБА) и резистентных пациентов (ТРБА) [6]. Клиническая характеристика представлена в таблице.
Глобальный уровень экспрессии генов определен в лимфоцитах периферической крови у исследованных больных с помощью микрочипа Affymetrix HuGene ST1.0 (Affymetrix, Santa Clara, CA), содержащего пробы для 28875 генов. Выделение РНК, пробоподготовку, гибридизацию и сканирование микрочипов проводили в соответствии с протоколами Affymetrix. Гибридизация, окрашивание, промывка и сканирование микрочипов выполнена c помощью устройства GeneTitan. Полученные после сканирования изображения микрочипов конвертировали в экспрессионные сигналы с помощью программного обеспечения компании Affymetrix. Эти файлы затем использовали для оценки качества мечения и гибридизации микрочипов, а также препроцессинга, включающего коррекцию на фон, квантильную нормализацию и суммирование экспрессионных сигналов с помощью программы Affymetrix Power Tools 1.12.0. Последующий анализ проводили в программной среде R. Уровень экспрессии генов в различных группах сравнивали путем построения линейных моделей с помощью пакета limma [7], включая анализ линейных контрастов между сравниваемыми группами (легкая БА, ТЧБА, ТРБА). Поправку на множественные сравнения проводили с помощью подхода False Discovery Rate (FDR) [3].
Для построения перечня генов с дифференциальной экспрессией значение p < 0,05 после поправки на множественные сравнения расценивали как статистически значимое в любом из трех сравниваемых контрастов.
Клиническая характеристика групп сравнения
|
Показатель |
Легкая БА (n = 5) |
ТЧБА (n = 20) |
ТРБА (n = 20) |
|
Возраст (лет) |
53,80 ± 0,97 |
47,15 ± 3,20 |
51,40 ± 2,52 |
|
Кол-во дневных симптомов за последние 7 дней |
6,00 ± 1,97 |
12,45 ± 1,51 |
21,35 ± 2,13* |
|
Кол-во ночных симптомов за последние 7 дней |
0,80 ± 0,20 |
2,55 ± 0,47 |
5,05 ± 1,15 |
|
Стаж заболевания (лет) |
9,00 ± 2,24 |
9,75 ± 1,94 |
16,65 ± 1,88* |
|
Частота вызовов скорой помощи за последние 12 мес. |
– |
0,15 ± 0,15 |
2,60 ± 1,23* |
|
ОФВ1 (%) |
99,36 ± 5,57 |
68,10 ± 1,89 |
61,97 ± 1,97* |
|
PC20 (мг/мл) |
4,01 ± 3,01 |
0,06 ± 0,00 |
0,06 ± 0,00 |
|
АСТ-тест (балл) |
20,40 ± 0,98 |
15,30 ± 0,58 |
12,40 ± 0,89* |
Примечание. * – p < 0, 05 – в сравнении с ТЧБА.
Результаты исследования и их обсуждение
Анализ транскриптома образцов идентифицировал 1388 генов, экспрессия которых статистически значимо отличалась между сравниваемыми группами.
Согласно полученным данным, наибольшее число генов со специфичной дифференциальной экспрессией зарегистрировано между ТРБА и легкой персистирующей БА (n = 1201). Значительно меньшее количество генов со специфичной экспрессией зарегистрировано при сравнении ТЧБА и ТРБА (n = 18), а также ТЧБА и легкой БА (n = 49).
Для 43 генов установлены различия в уровне экспрессии одновременно при сравнении ТЧБА и ТРБА, а также резистентной формой и легкой БА. Таким образом, ТРБА специфическим образом характеризуется отличием в уровне экспрессии 43 генов от других исследованных групп. Также по результатам проведенного анализа установлено, что ТЧБА и легкая персистирующая астма характеризуются отличием в уровне экспрессии 22 и 55 генов соответственно (рис. 1).
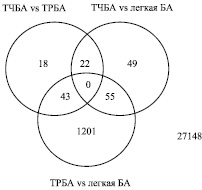
Рис. 1. Количество генов с отличающейся экспрессией на Визите 1 (p < 0,05)
Анализ транскриптома образцов, полученных на Визите 4 (24 недели терапии), идентифицировал 4041 ген, экспрессия которых статистически значимо различалась между сравниваемыми группами.
Согласно полученным данным, наибольшее число генов со специфичной дифференциальной экспрессией зарегистрировано между ТЧБА и ТРБА (n = 1664). Меньшее количество генов со специфичной экспрессией зарегистрировано между ТРБА и легкой БА (n = 1035) и ТЧБА и легкой БА (n = 39).
Для 1209 генов установлены различия в уровне экспрессии одновременно при сравнении ТЧБА и ТРБА, а также ТРБА и легкой БА. Таким образом, ТРБА специфическим образом характеризуется отличием в уровне экспрессии 1209 генов от других исследованных групп. Также по результатам проведенного анализа установлено, что ТЧБА и легкая персистирующая астма характеризуются отличием в уровне экспрессии 44 и 45 генов соответственно (рис. 2).
Заключение
В рамках данного исследования исходно в сравниваемых группах больных БА идентифицированы 1388 генов, экспрессия которых статистически значимо различалась. Необходимо отметить, что такая «количественная» характеристика различий сопоставима с результатами исследования Orsmark-Pietras C., проведенного в 2013 году, которое выполнено на детской популяции [5].
Наблюдаемые в нашем исследовании различия в количестве генов со специфичной экспрессией, вероятно, могут свидетельствовать о том, что легкая и тяжелая форма болезни отличаются большим количеством возможных механизмов, лежащих в основе формирования тяжести, а в основе формирования терапевтической резистентности в группе тяжелой астмы лежит значительно меньшее количество вероятных механизмов.
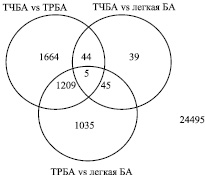
Рис. 2. Количество генов с отличающейся экспрессией на Визите 4 (24 недели) (p < 0,05)
В течение периода наблюдения (24 недели) общее количество генов с дифференциальной экспрессией изменялось и к окончанию периода наблюдения на фоне базисной противовоспалительной терапии их количество достигло 4041 гена. Необходимо отметить, что к окончанию лечебного периода зарегистрировано 1209 генов, характеризующихся отличием в уровне экспрессии у больных ТРБА по сравнению с пациентами других сравниваемых групп.
Полученные нами данные могут свидетельствовать о том, что исходно сравниваемые группы характеризуются различными профилями экспрессии генов, а в течение периода наблюдения на фоне базисной противовоспалительной терапии эти различия нарастают преимущественно за счет изменения экспрессии в группе ТРБА.
Рецензенты:
Кобякова О.С., д.м.н., профессор, заведующая кафедрой общей врачебной практики и поликлинической терапии, ГБОУ ВПО СибГМУ Минздрава России, г. Томск;
Федорова О.С., д.м.н., профессор кафедры факультетской педиатрии с курсом детских болезней лечебного факультета, ГБОУ ВПО СибГМУ Минздрава России, г. Томск.
Работа поступила в редакцию 15.01.2014.
Библиографическая ссылка
Куликов Е.С., Огородова Л.М., Фрейдин М.Б., Салтыкова И.В., Деев И.А., Селиванова П.А. СРАВНИТЕЛЬНАЯ ОЦЕНКА ДИФФЕРЕНЦИАЛЬНОЙ ЭКСПРЕССИИ ГЕНОВ ПРИ ТЯЖЕЛОЙ БРОНХИАЛЬНОЙ АСТМЕ // Фундаментальные исследования. 2013. № 12-2. С. 231-234;URL: https://fundamental-research.ru/ru/article/view?id=33311 (дата обращения: 03.01.2026).



