Популяции микроорганизмов, вступая в сложные взаимоотношения – конкурентные или кооперативные, при заселении различных частей органов, тканей микроорганизма формируют его специфический «микросимбиоценоз» [7]. При описании форм природных и искусственных сообществ микроорганизмов в литературе используется термин «ассоциации». В работах последнего десятилетия прошлого века для описания ассоциативных отношений или эктосимбиозов стали использовать термин «ассоциативный симбиоз» [8]. По мнению О.В. Бухарина, ассоциативный симбиоз – это многокомпонентная интегральная система, включающая хозяина в качестве макропартнера, стабильный доминантный микросимбионт и ассоциированные микросимбионты с разнонаправленными воздействиями, определяющими формирование, стабильность существования и продуктивность симбиоза в целом [2].
Большой интерес для исследований ассоциативных эктосимбиозов с микроорганизмами представляет ризосфера (узкая область почвы вдоль поверхности корней), так как она богато заселена микроорганизмами, оказывающими полифункциональное положительное влияние на растения [4]. Для обозначения таких бактерий используют термин plant growth promoting rhizobacteria (PGPR). Стимулирующие рост растений ассоциативные ризобактерии оказывают влияние на физиологические процессы растений, урожайность и качество растительной продукции [5], поэтому они все шире применяются в отечественном и мировом земледелии. Ризосфера служит их основной экологической нишей с наиболее благоприятными условиями [9]. В ризосферу из корней активно поступают сложные смеси легкодоступных органических источников энергии и углерода, что обусловливает ее высокую микробиологическую активность и образование отличающихся от почвенного микробоценоза специфических ризосферных микробных сообществ [7, 10].
На поверхности вегетативных подземных органов растений в основном доминируют грамотрицательные бактерии родов Pseudomonas, Erwinia, Xanthomonas, Flavobacterium, а в ризосфере и ризоплане растений – Pseudomonas, Flavobacterium, Agrobacterium, Azospirillum [2, 4]. Механизм действия этих микроорганизмов на фитопатогены включает конкуренцию за источник питания, эффективную колонизацию ризосферы, синтез антибиотических и рострегулирующих веществ [1]. Ассоциативные микроорганизмы, выделяющие в процессе роста антибиотические гетерогенные низкомолекулярные вещества, способны при низких концентрациях подавлять активность других микроорганизмов и тем самым влиять на жизнедеятельность растений [5].
Для изучения взаимодействий с полезными формами бактерий в ризосфере продуктивна концепция, согласно которой ассоциативные ризобактерии образуют с растением единую растительно-микробную систему с новыми свойствами, детерминированными положительным взаимодействием партнёров [2]. К ассоциативным предложено относить виды микроорганизмов, оказывающие положительное влияние на растения, но колонизирующие только поверхности органов и/или свободные пространства тканей. Ассоциативные микроорганизмы обитают в зоне прямого влияния растений, прилегающей к корням в почве или заселяют поверхность корней. Ризосферные микроорганизмы формируют на корнях растений сложные по таксономическому составу и структурно-функциональной организации сообщества, которые оказывают на растения полифункциональное воздействие [4].
Механизмы положительного влияния ризобактерий на жизнедеятельность растений делят на прямые и опосредованные. К прямым способам воздействия на растения предлагают относить: ассоциативную азотфиксацию, образование ростстимулирующих веществ, обеспечение легкоусвояемыми формами железа, фосфора и/или поглощение их из почвы и доставку в растения, формирование специфических трофических связей, уменьшение уровня этилена. Непрямые способы – предотвращение или уменьшение роста фитопатогенных почвенных микроорганизмов за счет выделения бактерицидных и антифунгальных метаболитов [2, 9].
Одной из важнейших проблем современного растениеводства являются фитопатогены, не только «традиционные» (облигатные), но и так называемые полиморфные группы грибов, включающие как сапротрофные, так и паразитические формы, многие из которых известны как биоразрушители, патогены культурных и дикорастущих растений [10]. Большинство сортов сельскохозяйственных культур в среднем реализуют только 20–25 % генетического потенциала продуктивности. При обеспечении защиты от возбудителей болезней, вредителей и сорняков они способны формировать значительно больший урожай. Среднемировой уровень потерь вследствие поражения сельскохозяйственных растений фитопатогенными микроорганизмами оценивается в 12 %. Это определяет важность защиты растений как одного из факторов интенсивного растениеводства. Установлено, что в борьбе с возбудителями болезней растений возможно использовать бактерии, обладающие антагонистическим действием по отношению к фитопатогенам [9]. Имеются сведения о том, что формирование эффективной растительно-бактериальной ассоциации определяется не только количеством выделяемых растением в ризосферное пространство растворимых органических соединений (экссудатов), но и их качественным составом, влияющим на приживаемость и размножение штамма в ризосфере. По этой причине можно говорить об относительной приуроченности штаммов PGPR к определенным видам и даже сортам растений, имеющим специфические характеристики химических корневых выделений [10]. Однако до сих пор антагонистическая активность ризосферных бактерий по отношению к фитопатогенам остается малоизученной.
Целью исследования явилось изучение антагонистической активности растительно-бактериальных ассоциантов по отношению к условно-патогенной и патогенной микрофлоре.
Материалы и методы исследования
Для выделения и идентификации используемых культур использовали такие питательные среды, как ЖСА, Эндо и МПА (Оболенск). Видовую идентификацию выделенных микробных ассоциантов проводили на основе изучения их морфологических, тинкториальных и биохимических свойств [6]. Для выявления Pseudomonas fluorescens использовали люминесцентную микроскопию (микроскоп – МИКМЕД-6 ЛЮМLed).
Антагонистический эффект выявляли у бактерий Pseudomonas fluorescens и Bacillus subtilis. В качестве тест-объекта использовали Staphylococcus aureus и Escherichia coli, обладающие типичными свойствами. Staphylococcus aureus – грамположительные кокки, диаметром 0,5–1,5 мкм, расположенные в мазке в виде небольших групп или виноградных гроздей, неподвижные (не имеют жгутиков), не образующие спор. Биохимически очень активны: продуцировали каталазу, восстанавливали нитриты из азота, обладали способностью гидролизовать белки, расщеплять многие углеводы в аэробных условиях. S. aureus расщепляли маннит и глюкозу не только в аэробных условиях, но и в анаэробных. Escherichia coli – короткие подвижные грамотрицательные палочки с закругленными концами, ферментировали лактозу с образование кислоты и газа (или лактозонегативны), на голодной среде c цитратом не расли, реакция Фогеса‒Проскауэра отрицательна, проба с MR положительна, не имели фенилаланиндезаминазы, не давали рост на среде с KCN [6]. Определение антимикробной активности проводили методом перпендикулярных штрихов [3]. Испытуемые штаммы наносили в виде штриха по диаметру, после инкубации 2–3 суток при температуре 37 °С к штаммам перпендикулярно подсевали тест-объекты (S.aureus и E.coli.). Антимикробные вещества, диффундирующие в толщу агара, задерживали рост чувствительных к ним микроорганизмов, что проявлялось в образовании зон отсутствия роста микробов (мм). О наличии и степени антагонистической активности у испытуемой бактерии судили по величине зоны ингибирования тест-штамма на границе со штрихом роста бактерии.
Результаты исследования и их обсуждение
Проведенные исследования показали, что в микробоценозе ризосферы и ризопланы изученных семейств растений преобладали Pseudomonas fluorescens и Bacillus subtilis, характерной особенностью P. fluorescens являлись флюоресценция в ультрафиолетовом цвете, расщепление оксидазы и окисление глюкозы OF. P. fluorescens, в отличие от B.subtilis обладали подвижностью. B.subtilis проявляли маннит- и каталазаположительную активность, не расщепляли мочевину, обладали способностью к спорообразованию и давали положительную реакцию Фогеса‒Проскауэра (табл. 1).
Таблица 1
Биохимическая активность ризосферных бактерий
|
Биохимические свойства |
P. fluorescens |
B.subtilis |
|
Наличие спор |
– |
+ |
|
Повижность |
– |
+ |
|
Ферментация лецитиназы |
+ |
– |
|
Ферментация маннита |
+ |
+ |
|
Ферментация ксилозы |
+ |
+ |
|
Образование уреазы |
– |
V |
|
Редукция нитратов |
(–) |
+ |
|
Реакция Фогеса‒Проскауэра |
– |
+ |
|
Синтез пиовердина, флюоресцирующего в УФ-свете |
+ |
– |
Примечания:
«–» – 0–10 % штаммов положительные;
(–) – 11–25 % штаммов положительные;
V – 26–75 % штаммов положительные;
«+» – 90–100 % штаммов положительные.
P. fluorescens и B.subtilis проявляли выраженную антагонистическую активность в отношении обеих тест-культур (рисунок).
а 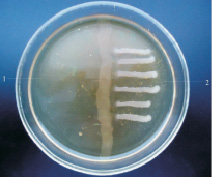 б
б 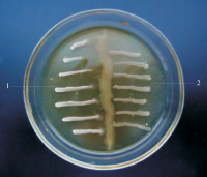
Антагонистическая активность B.subtilis (а) P. fluorescens (б) по отношению к E. coli (1) и S. aureus (2)
Проведенные исследования показали, что большей чувствительностью к действию ассоциативных ризобактерий обладала E. coli (табл. 2). Чувствительность E. coli к P. fluorescens в 8,0 раз превышает чувствительность S.aureus к данной бактерии. По отношению к B.subtilis, E. coli превышает чувствительность S.aureus в 2,7 раз.
Культура S. aureus оказалась устойчивой к антагонистическому действию ассоциативных ризобактерий. Из исследуемых бактериальных ассоциантов наибольшей активностью обладал B. subtilis, что, вероятно, обусловлено синтезом антибиотикоподобных веществ и сидерофоров.
Таблица 2
Антагонистическая активность P. fluorescens и B.subtilis (мм)
|
Тест-культуры |
Величина зоны отсутствия роста бактерий (мм) при взаимодействии с : |
|
|
Staphylococcus aureus |
Escherichia coli |
|
|
Pseudomonas fluorescens |
1,5 ± 0,5 |
12,1 ± 0,4 |
|
Bacillus subtilis |
10,2 ± 0,6 |
28,0 ± 0,5 |
Примечание: * – достоверность показателя по сравнению с диаметром зоны отсутствия роста S. aureus (р < 0,05).
Выводы
1. Микробные ассоцианты P. fluorescens и B.subtilis обладают антагонистической активностью в отношении E. coli и S. aureus. Антагонистическая активность B.subtilis по отношению к E. coli в 2,3 раз превышает действие P. fluorescens. По отношению к S. aureus антагонистическая активность B.subtilis в 6,8 раз превосходит активность P. fluorescens.
2. Наибольшая устойчивость к антагонистическому действию исследуемых штаммов из изученных тест-культур проявляется у S. aureus, которая превышает устойчивость E. coli в 2,7 раз по отношению к B.subtilis и в 8,0 раз по отношению к P. fluorescens.
Рецензенты:
Золотухин В.В., д.б.н., профессор кафедры зоологии, ФГБОУ ВПО «Ульяновский государственный педагогический университет им. И.Н. Ульянова», г. Ульяновск;
Артемьева Е.А., д.б.н., профессор кафедры зоологии, ФГБОУ ВПО «Ульяновский государственный педагогический университет им. И.Н. Ульянова», г. Ульяновск.
Работа поступила в редакцию 19.12.2013.
Библиографическая ссылка
Алексеева А.С., Артамонова М.Н., Потатуркина-Нестерова Н.И. АНТАГОНИСТИЧЕСКАЯ АКТИВНОСТЬ РАСТИТЕЛЬНО-БАКТЕРИАЛЬНЫХ АССОЦИАНТОВ // Фундаментальные исследования. 2013. № 11-5. С. 929-932;URL: https://fundamental-research.ru/ru/article/view?id=33227 (дата обращения: 20.01.2026).



