Одним из самых распространенных возбудителей внутрибольничных инфекций была и остается Pseudomonas аeruginosa. Инфекции, вызванные Pseudomonas, плохо поддаются терапии из-за множественной резистентности к антибиотикам. Изучение у P. аeruginosa механизмов адаптации к антибиотикам, образования биопленки и ее строения является одной из актуальных задач современной биомедицинской науки. На сегодняшний момент известны три основные стратегии, которые позволяют P. aeruginosa адаптироваться к давлению различных антибиотиков и иммунной системы пациентов. Это появление мутаторного фенотипа, развитие биопленки и высокая фенотипическая гетерогенность популяции [9]. Особенное внимание в литературе уделяется изучению в биопленке P. aeruginosa субпопуляций с мелкими колониями (small colony variant, SCV). По сравнению с колониями штамма дикого типа штаммы с мелкими колониями обладают высокой антибиотикорезистентностью, усиленным биопленкообразованием, могут образовывать морфотипы, подобные колониям дикого типа [4]. При таком фенотипе колоний исследователи отмечают задержку роста культуры, дефект движения и сильно сниженный уровень чувства кворума [10].
Многочисленные исследования, проводимые в мире, направлены также на изучение появления мутаторного фенотипа штаммов P. aeruginosa, отличающихся высокой приспособляемостью к действию антибиотиков. Так, в результате анализа 70 изолятов P. aeruginosa от 10 пациентов с хронической легочной инфекцией показано, что параллельная микроэволюция бактерий одного вида, длительное время находившихся под селективным давлением антибиотиков и иммунной системы пациентов, приводит к одновременному совместному сосуществованию субпопуляций с гипермутабильным, средним и слабым мутаторным фенотипом. Гипермутабильность связана с мутациями в генах системы репарации неправильно спаренных оснований (ММР) mutS и mutL [2]. Быстрая адаптация P. aeruginosa к ципрофлоксацину в большинстве случаев обусловлена мутациями в таких генах, как gyrA, gyrB, nfxB и orfN. Кроме того, возникающие в других местах генома вторичные мутации, как оказалось, также важны для появления антибиотикорезистентности [11].
Цель исследования – провести сравнительный анализ частот адаптивных мутантов и гетерогенности популяции клеток при инкубации с ципрофлоксацином в штаммах P. aeruginosa эталонного и с фенотипом мелких колоний (SCV).
Материалы и методы исследования
В работе были использованы штаммы Pseudomonas aeruginosa: музейный эталонный штамм ATCC 27853 и штамм с фенотипом мелких колоний SCV, выделенный нами из биопленки плавательного бассейна, ранее определенный как Pseudomonas aeruginosa [1]. Для получения планктонных культур клетки обоих штаммов выращивали при 370С до достижения ОП 0.2 при 600 нм в объеме 50 мл в жидкой среде LB (Luria Bertani) следующего состава, в г/л: 10 – триптон, 5 г дрожжевого экстракта, 5 г NaCl в 1 л дистиллированной воды. В дальнейшем добавляли в среду антибиотик ципрофлоксацин (ЦПРФ) в конечной концентрации 0,05 мкг/мл (P. aeruginosa SCV) и 0,2 мкг/мл (для P. aeruginosa ATCC 27853). Оптимальные концентрации антибиотика для каждого штамма были определены опытным путем. В большинстве литературных источников штаммы с мелкими колониями, выделенные, как правило, у больных с хроническими инфекциями дыхательных путей, описываются как высокоустойчивые к действию антибиотиков. Выделенный нами штамм с мелкими колониями из биопленки плавательного бассейна, напротив, оказался высокочувствительным к действию ЦПРФ, поэтому концентрация антибиотика в среде для подсчета адаптивных мутантов для него была ниже, чем для эталонного штамма. В течение 1,5 часов инкубации с антибиотиком через каждые 15 мин аликвоты культур клеток объемом 400 мкл 3 раза отмывали от антибиотика центрифугированием при 5000 об/мин в течение 5 мин, и осадок ресуспендировали в эквивалентном объеме физиологического раствора – 0,9 % NaCl (ФР, рН 7,4). Количество клеток в 1 миллилитре культуры определяли методом подсчёта колониеобразующих единиц (КОЕ) на LB-агаре (1,5 %). Для этого высевали по 5 мкл культуры с подобранным для подсчета разведением. Одновременно, с целью определения частоты стресс-индуцированных мутантов, высевали по 100 мкл шпателем на LB-агар с ЦПРФ (в той же концентрации). Эксперименты проведены в 3-х повторностях. Чашки инкубировали в термостате при 37°С в течение 7 дней. Частоту мутантов вычисляли как отношение среднего количества выросших на LB-агаре с ЦПРФ колоний к КОЕ.
Аналогичные эксперименты проводили для определения частоты адаптивных мутантов в биопленке. Для получения биопленки 50 миллилитров культуры инкубировали 96 часов при температуре 37 °С. Затем биопленку оставляли в необходимом для эксперимента количестве культуры (3 мл), а оставшуюся среду культивирования сливали. Биопленку разбивали ресуспендированием. Потом добавляли ЦПРФ в указанных концентрациях и проводили эксперимент по указанной схеме. Достоверность отличий определялась с помощью t-критерия Стьюдента, при минимальной величине уровня значимости р < 0,05.
С целью определения гетерогенности популяции после культивирования на LB-агаре с ЦПРФ в течение 7 суток колонии обоих штаммов, высеянные из биопленки, перекалывали стерильным наконечником на LB-агар без антибиотика по 59 колоний на чашку. Подсчет выросших колоний проводили через 24 часа и через 7 суток.
Результаты исследования и их обсуждение
В результате серии экспериментов по подсчету частоты адаптивных мутантов в растущих планктонных культурах и в биопленке было найдено, что добавление ЦПРФ в среду и 15-минутное инкубирование с ним достоверно снижает количество живых клеток в культурах обоих штаммов приблизительно в 10 раз (рис. 1). Количество выживших клеток достигает своих минимальных значений у P. aeruginosa SCV уже к 30 минуте, а у эталонного штамма к 90 минуте культивирования с антибиотиком. Что касается биопленки, то у эталонного штамма добавление в среду культивирования ЦПРФ не оказывает влияния на количество клеток в культуре, а у штамма SCV наблюдается незначительное, но достоверное снижение числа выживших клеток к 60 минуте инкубирования, при р < 0,05.
Сравнительный анализ частот адаптивных мутантов показал, что в планктонных культурах обоих штаммов частота адаптивных мутантов зависит от количества выживших клеток, но у штамма с фенотипом мелких колоний она увеличивается в 100 раз к 60 минуте инкубирования с ЦПРФ (рис. 2), а число выживших клеток снижается лишь в 10 раз (рис. 1). По литературным данным, после внесения в среду ЦПРФ снижается уровень метаболизма, способность к движению, проницаемость клетки, авторы считают, что это нужно для селекции необходимых для выживания в новых условиях мутаций, при значительно редуцированном SOS-ответе у P. aeruginosa по сравнению с E. coli [3]. Кроме того, гипермутабельность P. аeruginosa, по мнению большинства исследователей, связана с мутациями в белках системы ММР, необходимых для исправления ошибок репликации. Доказано, что при хронической инфекции в легких в течение терапии антибиотиками наблюдается гипермутабильность в генах mexZ, mucA и lasR, но для появления антибиотикорезистентности необходимы еще и мутации в генах ММР системы [6]. Однако другие исследователи показали, что мутаторный фенотип, связанный с дефектом белков ММР, увеличивает частоту адаптивных мутаций по сравнению с этим показателем в клетках эталонного штамма именно в культуре биопленки, а не у планктонных клеток [9]. В результате наших экспериментов выявлено, что, напротив, частота адаптивных мутантов штамма P. aeruginosa SCV достоверно выше у планктонных клеток по сравнению со штаммом P. aeruginosa ATCC 27853, чем в клетках культуры биопленки. Поэтому клетки штамма P. aeruginosa SCV, скорее всего, не несут мутацию в генах репарации неправильно спаренных оснований. Кроме того, штаммы, использованные в работе, скорее имеют средний мутаторный фенотип. В то же время наши результаты свидетельствуют о большей выживаемости клеток биопленок при действии ЦПРФ по сравнению с планктонными культурами обоих штаммов (рис. 1).
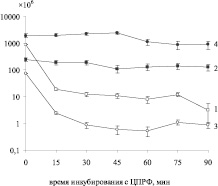
Рис. 1. Количество живых клеток в растущих культурах штаммов P. aeruginosa ATCC 27853 (1), SCV (3) и в биопленке (2, 4 соответственно), при инкубировании с ЦПРФ
По литературным данным транскриптомного анализа, существуют различия в экспрессии генов при стресс-ответе в биопленке и в планктонных культурах P. aeruginosa [5]. В то же время для бактерий рода Pseudomonas были показаны отличия в распределении мутаций в разных участках генома. Доказано, что горячие точки мутирования в геномах клеток растущих культур и биопленки отличаются [7].
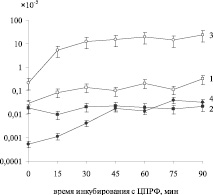
Рис. 2. Частота адаптивных мутантов в растущих культурах штаммов P. aeruginosa ATCC 27853 (1), SCV(3) и в биопленке (2,4 соответственно), при инкубировании с ЦПРФ
В результате экспериментов нами была замечена интересная закономерность. В отличие от эталонного штамма, у которого в культуре клеток биопленки частота адаптивных мутантов не зависит от времени инкубирования с антибиотиком, в культуре клеток биопленки штамма SCV наблюдается прямая зависимость этого показателя от времени инкубации с антибиотиком в жидкой среде, вне зависимости от числа живых клеток (рис. 2). Опираясь на эту закономерность и литературные данные, где с помощью генетического анализа доказана возможность попадания P. aeruginosa в организм человека не только от инфицированного человека, но и из окружающей среды [8], можно предположить, что изначально штаммы с мелкими колониями не обладают множественной антибиотикорезистентностью, она приобретается в результате лечения.
Luján A.M. с соавторами (2011) при изучении развития биопленки у Pseudomonas aeruginos доказали, что под давлением селективных факторов среды могут возникать мутации, приводящие к появлению разных фенотипов колоний, в том числе и к фенотипу маленьких колоний, что приводит к увеличению эффективности адаптивной эволюции к условиям среды. Авторы подчеркивают, что подобный процесс диверсификации наблюдается при хронических инфекциях дыхательных путей [9]. Мы решили также посмотреть, появятся ли фенотипические различия колоний после инкубирования клеток биопленки на ЦПРФ. Пересев после 10-дневного инкубирования с антибиотиками на агаризованной среде показал высокую гетерогенность популяции клеток штамма P. aeruginosa SCV в отличие от эталонного штамма. Пересеянные колонии штамма SCV разделились как по размерам, так и по скорости роста (рис. 3 и таблица).
Результаты подсчета разных по размерам и по скорости роста колоний штамма P. aeruginosa SCV
|
Количество мелких колоний (менее 4 мм), % |
Количество средних колоний (4-5 мм), % |
Количество крупных колоний (более 5 мм), % |
Количество колоний, не выросших при пересеве, % |
Количество колоний, выросших через 7 суток после посева |
Количество колоний, выросших через сутки после посева |
|
36.6 ± 2.6* |
36.59 ± 2.1 |
23.83 ± 4.2 |
2.98 ± 0.7 |
10 ± 3.6 |
3 ± 1.3 |
Примечание. *Результаты представлены в виде средней ± ошибка средней (n = 4;Χ ± m).
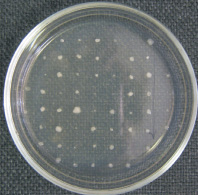
Рис. 3. Проявление гетерогенности популяции клеток штамма P. aeruginosa SCV через 7 суток после пересева с LB-агара с ЦПРФ на LB-агар без антибиотика
Следует отметить, что через сутки после пересева появились крупные и средние колонии, а через семь суток выросли мелкие колонии. В то же время все пересеянные колонии эталонного штамма появились через сутки и были приблизительно одного размера (4–5 миллиметров).
Заключение
Таким образом, в результате нашей работы получилось, что в клетках биопленки штамма P. aeruginosa SCV частота адаптивных мутантов напрямую зависит от времени инкубации с антибиотиком. Кроме того, после инкубации с ЦПРФ наблюдается высокая гетерогенность популяции клеток этого штамма в отличие от клеток эталонного штамма. На основании полученных результатов можно предположить, что, несмотря на изначально высокую чувствительность к ЦПРФ клеток штамма P. aeruginosa SCV, более длительная инкубация с антибиотиком вызывает появление клонов с высокой устойчивостью к действию антибиотика.
Рецензенты:
Виноградов А.Б., д.м.н., профессор, заведующий кафедрой биологии, экологии и медицинской генетики, ГБОУ ВПО «Пермская государственная медицинская академия им. Е.А. Вагнера» Министерства здравоохранения и социального развития Российской Федерации, г. Пермь;
Кузяев Р.З., д.м.н., профессор кафедры микробиологии, ГБОУ ВПО «Пермская государственная медицинская академия им. Е.А. Вагнера» Министерства здравоохранения и социального развития Российской Федерации, г. Пермь.
Работа поступила в редакцию 19.12.2013.
Библиографическая ссылка
Цветкова Н.А., Гузачева И.М., Голясная Н.В., Беляева Л.А. ИЗУЧЕНИЕ ЧАСТОТЫ АДАПТИВНЫХ МУТАНТОВ И ГЕТЕРОГЕННОСТИ ПОПУЛЯЦИИ КЛЕТОК ШТАММОВ PSEUDOMONAS AERUGINOSA ATCC 27853 И С ФЕНОТИПОМ МЕЛКИХ КОЛОНИЙ В РЕЗУЛЬТАТЕ ДЕЙСТВИЯ ЦИПРОФЛОКСАЦИНА // Фундаментальные исследования. 2013. № 11-4. С. 706-710;URL: https://fundamental-research.ru/ru/article/view?id=33189 (дата обращения: 20.02.2026).



