Данная работа посвящена исследованию механимов формирования гиппокампального тета-ритма. Тета-ритм – это высоко-амплитудные осцилляции полевого потенциала с частотой 4–12 Гц, наиболее отчетливо выраженные во время исследовательского поведения и парадоксального сна. Тета-ритм является электрофизиологическим коррелятом таких важных когнитивных процессов, как внимание и память, в которых критическую функцию играет гиппокамп. Медиальная септальная область (МСО) является структурой переднебазального мозга и основным входом в гиппокамп со стороны ствола. В настоящее время МСО рассматривается как пейсмейкер гиппокампального тета-ритма [14].
Пейсмейкерную функцию МСО выполняет за счет проекционных ГАМКергических нейронов, которые в ходе генерации тета-ритма разряжаются ритмическими залпами импульсов, следующими на тета-частоте [5]. Эти группы клеток разряжаются во время противоположных фаз тета-ритма [1] и обнаруживают взаимное тормозное влияние друг на друга [6]. В МСО также обнаружены непроецирующиеся к гиппокампу ГАМКерические нейроны [8], а также глутамат- и холинергические нейроны [11]. Большая часть (~60–70 %) нейронов относится к быстро-разряжающимся нейронам (fast-spiking), лишь небольшая часть (~15–20 %) нейронов МСО имеет залповые свойства (cluster-firing) [9]. Быстро-разряжающиеся и залповые нейроны преимущественно являются ГАМКергическими и глутаматергическими [7, 11]. Часть проекционных ГАМКергических и глутаматергических нейронов имеют ярко выраженные h-токи [5, 7, 10, 13]. Общая доля нейронов МСО, разряжающихся устойчивыми ритмическими залпами в отсутствие внешних входов (предположительно пейсмейкерных), в МСО невелика [14] (не превышает 20–30 %), однако показана чрезвычайная важность этих нейронов для формирования ритмического выхода от септума к гиппокампу [3]. Холинергические нейроны проявляют свойства медленно-разряжающихся нейронов (slow-firing) [11]. В МСО преимущественно представлены метаботропные М3 мускариновые рецепторы, поэтому считается, что роль холинергичесикх рецепторов заключается в создании тонического возбуждения [15]. Глутаматергические и непроекционные ГАМКергические нейроны играют значительную роль в формировании ритмического выхода в гиппокамп, однако механизмы этого пока неизвестны. Кроме того, непонятна роль h-токов и механизмов формирования ритмического выхода в системе взаимно-тормозных популяций нейронов. На сегодняшний день нет модели, удовлетворяющей всем имеющимся морфо-функциональным данным. В настоящей работе была поставлена цель разработать гипотезу септальных межнейронных взаимодействий, удовлетворяющую большинству современных литературных данных и лежащих в основе пейсмейкерной функции МСО и проверить её на модели.
Материалы и методы исследования
Модель нейрона. Для моделирования потенциала нейрона мы использовали подход Ходжкина‒Хаксли. В данной работе мы использовали два типа нейронов: быстро-разряжающиеся и залповые. В зависимости от условий эксперимента залповые нейроны могли содержать h-ток. Для залповых пейсмейкерных нейронов мы использовали следующее уравнение:
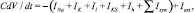
где С – емкость мембраны нейрона; V – потенциал на мембране нейрона; t – время; IК – быстрый калиевый; INa – быстрый натриевый ток; Il – ток утечки; ISK – медленный калиевый ток; Isyn – синаптические токи; Iext – внешний ток, имитирующий тоническое возбуждение.
Уравнение для залповых непейсмейкерых нейронов было получено удалением из уравнения h-тока (Ih), а уравнение быстро-разряжающегося нейрона было получено путем удаления также и медленного калиевого тока (IKS). Токи описывались следующими уравнениями:
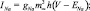
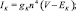
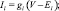
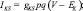
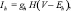
где g – максимальная проводимость соответствующего канала; Е – потенциал реверсии соответствующего канала; m, h, n, p, q, H – воротные переменные каналов. Для расчета поведения воротных переменных мы использовали уравнение
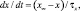
где x – воротная переменная. Для m, h и n функции 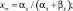
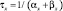 имеют вид:
имеют вид:
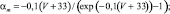
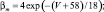
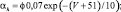
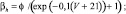
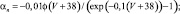
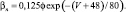
Для расчетов воротных остальных воротных переменных
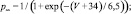
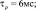
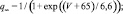
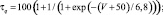
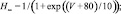
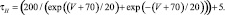
Параметры использованных функций приведены в табл. 1.
Уравнения для описания воротных переменных быстрого калиевого и натриевого тока, а также медленного калиевого тока мы описывали как в [12].
В данной работе холинергические нейроны не моделировались. Их наличие учитывалось путем введения в уравнение возбуждающего тока, при этом значение тока в каждый момент времени для каждого нейрона выбиралось случайно по нормальному закону.
Модель синапса. В данной работе мы использовали два типа синапсов: возбуждающие и тормозные. Для описания синаптических токов мы использовали уравнения:
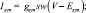
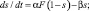
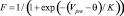 .
.
где Vpre – потенциал пресинаптического нейрона; w – вес синапса; w = 1, если не указано другое значение в описании эксперимента. Уравнения синапсов мы использовали как в [12]. Параметры модели синапса приведены в табл. 2.
Постановка вычислительного эксперимента. Схема связей нейронов в модельных экспериментах описывается ниже. Интегрирование уравнений воротных переменных проводили аналитически. Уравнения, описывающие потенциал нейронов и проводимость синаптических токов, интегрировали по методу Рунге‒Кутты четвертого порядка.
Таблица 1
Параметры моделей нейронов
|
Параметр |
Быстро-разряжающиеся нейроны |
Залповые нейроны |
Залповые пейсмейкерные нейроны |
|
С, мкФ/см2 |
1 |
1 |
1 |
|
gNa, мС/см2 |
55 |
55 |
55 |
|
gK, мС/см2 |
8 |
8 |
8 |
|
gKS, мС/см2 |
0 |
12 |
12 |
|
gh, мсС/см2 |
0 |
0 |
1 |
|
gl, мсС/см2 |
0,1 |
0,1 |
0,1 |
|
ENa, мВ |
55 |
55 |
55 |
|
EK, мВ |
–85 |
–85 |
-85 |
|
El, мВ |
–65 |
–50 |
–50 |
|
Eh, мВ |
– |
– |
–40 |
|
φ |
10 |
5 |
5 |
Для анализа импульсной активности в модельной системе мы использовали представление активности нейронов в виде непрерывного сигнала. Активность нейрона представляли в виде временной последовательности со значением 1 в момент спайка и 0 во все остальные моменты. Непрерывный сигнал получали путем свертки последовательности с функцией sinc. Непрерывные сигналы усредняли по каждой группе нейронов. Для расчетов использовали среду Scilab.
Таблица 2
Параметры моделей синапсов
|
Параметр |
Тормозные синапсы |
Возбуждающие синапсы |
|
gsyn |
0,005 нС |
0,008 нС |
|
Esyn |
–75 мВ |
0 мВ |
|
α |
14 мс–1 |
1,1 мс–1 |
|
β |
0,07 мс–1 |
0,19 мс–1 |
|
θ |
0 мВ |
2 мВ |
|
K |
2 мВ |
5 мВ |
Результаты исследования и их обсуждение
Роль залповых пейсмейкерных нейронов в синхронизации системы проекционных ГАМКергических нейронов.
Ранее в [12] было показано, что система из двух популяций взаимно-тормозных быстро-разряжающихся нейронов может быть синхронизирована на тета-частоте за счет внешнего ритмического входа, например, глутаматергического, на одну из популяций. В данной работе мы использовали аналогичную схему. Мы моделировали систему из 100 быстро-разряжающихся ГАМКергических нейронов, которые были разделены на две группы по 50 нейронов. Также в модели присутствовали 40 залповых глутаматергических нейронов (рис. 1).
а 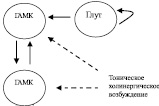 б
б  в
в 
Рис. 1. Роль наличия залповых пейсмейкерных нейронов в популяциях проекционных ГАМКергических нейронов: а – схема связей нейронов в модели, ГАМКергические нейроны (по 50 нейронов в каждой группе) быстро-разряжающиеся (в экспериментах при наличии пейсмейкеров 20 % нейронов было заменено на залповые пейсмейкеры), глутаматергические нейроны (40) являются залповыми; б – растровая развертка разрядов активности модельной сети при наличии пейсмейкеров, черным цветом обозначены глутаматергические нейроны, серым ‒ ГАМКергические, масштаб по времени 200 мс; в – значение коэффициента корреляции Пирсона (обозначено цветом) между активностями популяций ГАМКергических нейронов в зависимости от отношения силы связи между популяциями и отношения силы тока, действующего на обе популяции
Проведенное нами моделирование такой системы показало, что формирование в ней устойчивых ритмических взаимоотношений между популяциями ГАМКергических нейронов не происходит. Одна из популяций получает возбуждающий глутаматергический и условный холинергический вход, а вторая ‒ только холинергический, поэтому первая популяция полностью тормозит вторую. Можно было ожидать, что изменение силы связей между популяциями (в наших экспериментах w от одной популяции другой варьировалась от 0,1 до 1 с шагом 0,1) и силы холинергического воздействия (в наших экспериментах Iext в одной и другой популяции варьировалась в 0,1 до 1 с шагом 0,1) позволит стабилизировать противофазный режим между ГАМКергическими популяциями. Мы также предположили, что наличие залповых песмейкерных нейронов среди ГАМКергических клеток может стабилизировать формирование противофазного ритмического режима. Действительно, замена 20 % ГАМКергических нейронов в каждой группе на залповые пейсмейкеры значительно стабилизировала противофазный режим в данной системе. На рис. 1 показано, что при наличии пейсмейкерных нейронов корреляция между активностями популяций ГАМКергических нейронов существенно выше при значительной вариации параметров связи между популяциями и силе внешнего тока, имитирующего холинергическое возбуждение. В частности, при отсутствии пейсмейкерных нейронов ни в одном эксперименте мы не обнаружили устойчивого ритмического режима.
Формирование ритмической залповой активности в системе возбуждающих и тормозных нейронов.
В приведенной выше модели формировался устойчивый ритмический режим, однако модель требует предположения, что все глутаматергические нейроны имеют эндогенные залповые свойства, однако, как упоминалось выше, это не соответствует литературным данным. Ранее было показано, что в системе возбуждающих и тормозных интегрирующих нейронов возможно возникновение самопроизвольного залпового режима [2]. Мы предположили, что в септальной сети может реализовываться схожий механизм за счет взаимодействия между глутаматергическими и непроецирующимися к гиппокампу ГАМКергическими нейронами. Мы проверили наши предположения в модели (рис. 2).
а 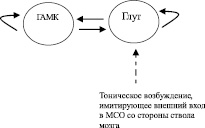 б
б 
Рис. 2. Формирование залпового режима в системе возбуждающих и тормозных нейронов: а – схема связи между нейронами, Глутаматергические нейроны (40) и ГАМКергические нейроны (40) быстро-разряжающиеся; б – Растровая развертка активности сети, сила связи от глутаматергических нейронов на ГАМКергические 0,1, масштаб 200 мс
В данной модели мы использовали быстро-разряжающиеся нейроны, 40 глутаматергических и 40 ГАМКергических. Мы обнаружили, что при наличии слабого глутаматергического воздействия (значение для глутаматергических синапсов на ГАМКергических нейронах w = 0,1) на ГАМКергические нейроны в системе спонтанно возникает устойчивый залповый режим. Таким образом, в системе быстро-разряжающихся нейронов может эндогенно формироваться залповый режим при наличии в системе возбуждающих и тормозных нейронов, при слабой связи от глутаматергической популяции к ГАМКергической.
Формирование ритмического противофазного режима в системе проекционных ГАМКергических нейронов.
Разделение проекционных ГАМКергических нейронов на субпопуляции обнаружено электрофизиологическими [1] и гистологическими методами [6]. В данной работе мы использовали предположение, высказанное в [12] о том, что только одна субпопуляция может получать глутаматергический вход. Наличие ассиметричного входа в эксперименте не показано, однако косвенные данные говорят о такой возможности. Показано, что только около 60 % проекционных ГАМКергических нейронов имеют глутаматергический вход [4]. Известно, что различные субпопуляции ГАМКергических нейронов топографически расположены в разных частях септума [6], что может указывать на получение ими разных входов. С другой стороны, показано, что сила иннервации между популяциями ГАМКергических нейронов не одинакова [6], что очевидно важно для формирования устойчивого противофазного режима. ГАМКергические нейроны преимущественно являются быстро-разряжающимися, т.е. не имеют эндогенных ритмических свойств. Поэтому проблема устойчивости такой системы становится очень актуальной. Имеющиеся в литературе данные указывают на чрезвычайную важность h-токов для формирования ритмической активности в МСО [3]. Кроме того, показано, что плотность HCN-каналов значительна среди проекционных ГАМКергических клеток [13]. Предложенный нами механизм увеличения стабильности за счет введения в систему пейсмейкерых нейронов соответствует имеющимся литературным данным и позволяет объяснить роль h-токов в формировании ритмического выхода в гиппокамп.
Формирование ритмической залповой активности в системе возбуждающих и тормозных нейронов.
Глутаматергические нейроны в МСО интенсивно коммуницируют друг с другом, а также с другими нейронными популяциями МСО [10]. Показано, что глутаматергические клетки вовлекаются в ритмическую активность [10], однако механизмы этого не известны. Не проецирующиеся к гиппокампу ГАМКергические нейроны наиболее слабо изучены. Можно предполагать, что они интенсивно иннервируют глутаматергические и холинергические нейроны. С одной стороны, в МСО показано мощное тоническое ГАМКергическое влияние на все группы нейронов [9], с другой – показано, что проекционные ГАМКергические нейроны не взаимодействуют с глутаматергическими и холинергическими нейронами [6]. В данной работе нами было высказано предположение о том, что залповый ритмический режим может формироваться в системе взаимодействий между глутаматергическими и ГАМКергическими нейронами. Данная гипотеза не противоречит имеющимся литературным данным, однако содержит определенные допущения, которые требуют экспериментальной проверки.
Заключение
В данной работе мы предложили два принципа, на основе которых может осуществляться пейсмейкерная функция МСО. Можно предполагать, что таких принципов может быть больше. Кроме того, можно ожидать, что предложенные нами принципы могут вносить разный вклад в различных состояниях мозга. Эти вопросы требуют дальнейшего изучения; тем не менее высказанные нами принципы вносят вклад в понимание функционирования септо-гиппокампальной системы и нейрональных механизмов внимания и памяти.
Рецензенты:
Архипов В.И., д.б.н., ведущий научный сотрудник лаборатории экспериментальной нейробиологии, ФГБУН «Институт теоретической и экспериментальной биофизики Российской академии наук», г. Пущино;
Журавлева З.Н., д.б.н., ведущий научный сотрудник лаборатории системной организации нейронов, ФГБУН «Институт теоретической и экспериментальной биофизики Российской академии наук», г. Пущино.
Работа поступила в редакцию 11.11.2013.
Библиографическая ссылка
Мысин И.Е., Мысин И.Е., Казанович Я.Б., Кичигина В.Ф., Кичигина В.Ф. МОДЕЛИРОВАНИЕ НЕЙРОНАЛЬНОЙ СЕТИ МЕДИАЛЬНОЙ СЕПТАЛЬНОЙ ОБЛАСТИ КАК ПЕЙСМЕКЕРА ТЕТА-РИТМА // Фундаментальные исследования. 2013. № 11-4. С. 691-695;URL: https://fundamental-research.ru/ru/article/view?id=33186 (дата обращения: 20.02.2026).



