Хитозаны являются сополимерами 2-амино-2-дезокси-β-D-глюкозамина и 2-ацетамидо-2-дезокси-β-D-глюкозамина, связанных β (1 → 4) связями. Функциональные свойства этих катионных полиэлектролитов зависят от молекулярной массы, полидисперсности, степени деацетилирования (СД) и микроструктуры (распределения сомономеров по длине цепи) [1]. Молекулы хитозана содержат гидроксильные и аминогруппы, его полимерная матрица позволяет иммобилизовать ферменты как внутри сетки, так и на ее поверхности. Производные хитозанов характеризуются нетоксичностью, биоразлагаемостью, биосовместимостью и слабой иммуногенностью [2, 3]. Хитозан является слабым основанием с pKa = 6,5, что близко значению pKa остатков D-глюкозамина [4].
При закреплении ферментов на нерастворимых носителях получаются гетерогенные биокатализаторы, которые обладают рядом преимуществ: значительно повышается не только стабильность, но и эффективность полученного препарата за счет возможности управления процессом протекания реакции. Однако практика показывает, что использование одного и того же метода иммобилизации в случае различных ферментов приводит к резко отличающимся конечным результатам.
Целью нашей работы была разработка эффективной методики адсорбционной иммобилизации трипсина на матрице хитозана.
Материалы и методы исследования
В качестве объекта исследования был выбран бычий трипсин фирмы «MP biomedicals». В качестве носителя использовали четыре вида хитозана, синтезированных ЗАО «Биопрогресс»: хитозан пищевой кислоторастворимый ХТЗ № 07 (Мr = 200 кДа, степень деацелирования СД 82 %), хитозан кислоторастворимый высокомолекулярный ХТЗ № 12 (Мr = 350 кДа, СД = 94,85 %), хитозан пищевой низкомолекулярный (ХТЗ пищ) и сукцинат хитозана водорастворимый ХТЗ № 02.
Иммобилизацию трипсина на хитозане осуществляли адсорбционным методом. К 50 мг хитозана добавляли 1 мл буферного раствора и 1 мл раствора трипсина (в концентрации 5·10–5М), инкубировали в течение 24 часов с периодическим перемешиванием. О степени иммобилизации судили по количеству белка в надосадочной жидкости, отобранной после инкубации фермента с носителем и центрифугирования при 1.500 g в течение 10 мин (выражается в процентном соотношении адсорбированного белка к исходной концентрации фермента). Определение количества белка осуществляли модифицированным методом Лоури (по реакции Фолина‒Чикальтэу) [5]. При подборе оптимальных условий для иммобилизации трипсина использовали 0,1 М цитратный буфер (рН 3,0–5,0), 0,1 М фосфатный буфер (рН 5,8–7,5) и 0,1 М трис-буфер (рН 8,0–11,0). Каталитическую активность фермента определяли спектрофотометрически по количеству окрашенного продукта реакции в результате расщепления N-α-бензоил-DL-аргинин-п-нитроанилида (BAPNA) [6].
Результаты исследования и их обсуждение
Установлено, что сукцинат хитозана и низкомолекулярный хитозан в отличие от высокомолекулярных хитозанов вносят значительный вклад в окрашивание среды в реакции Фолина‒Чикальтэу (рис. 1).
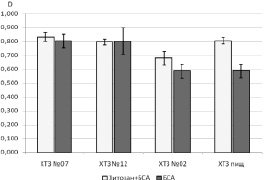
Рис. 1. Зависимость величины оптической плотности от типа используемого хитозана в реакции Фолина‒Чикальтэу
При сравнительном анализе степени иммобилизации (α) трипсина на четырех видах хитозана нами установлено, что наиболее эффективной является иммобилизация трипсина на высокомолекулярных видах носителя (ХТЗ № 12 и № 07), для пищевого низкомолекулярного хитозана и сукцината хитозана степень иммобилизации была ниже 20 %, что, вероятно, связано с низкой стерической доступностью активных групп носителя для адсорбции фермента, так как он в данных условиях имеет гелеобразную структуру. При кислых значениях рН низкомолекулярный хитозан полностью растворялся, а сукцинат хитозана приобретал желатинообразную консистенцию, поэтому определение степени иммобилизации фермента на матрицу оказывалось затруднительным.
В следующей серии экспериментов нами была проведена иммобилизация трипсина при рН 3,0; 4,0; 5,0; 5,8 и 6,5. Степень иммобилизации на хитозан № 12 была выше, чем на хитозан № 7 во всех случаях и составила 55,2; 43,8; 32,2; 64,9 и 59,9 % соответственно, для хитозана № 7 – 40,6; 19,5; 19,7; 40,6 и 29,2 % (рис. 2).
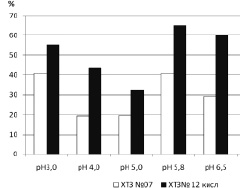
Рис. 2. Степень иммобилизации (α) трипсина на хитозан № 07 и № 12 при различных значениях рН
Сравнение активности иммобилизованного трипсина на ХТЗ № 12 и № 07 при рН 3,0; 4,0; 5,0, 5,8 и 6,5 показало, что наибольшую активность проявлял фермент, иммобилизованный на ХТЗ№ 12, при большинстве используемых значений рН и составила 32,6; 43,5; 78,6; 57,4 и 65,4 % от активности свободного фермента соответственно. Для трипсина, иммобилизаванного на ХТЗ № 07, активность составила 36,0; 38,8; 76,5;43,3 и 61,1 % соответственно (рис. 3). Активность свободного фермента варьировалась от 4,37 до 5,47 мкМ/мин.
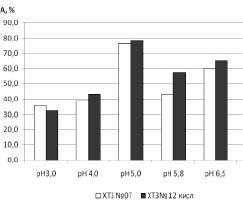
Рис. 3. Общая каталитическая активность трипсина (А), иммобилизованного на ХТЗ № 07 и ХТЗ№ 12 при различных значениях рН (% от активности свободного фермента)
В ходе хранения высушенных иммобилизованных на матрице хитозана образцов трипсина в течение трех суток в холодильнике активность гетерогенного биокатализатора снизилась в среднем на 20 % и составляла от 30 до 55 % от активности свободного фермента. Наибольшую каталитическую способность (2,12 мкМ/мин) сохранял трипсин, иммобилизованный на ХТЗ№ 07 при рН 6,5 (рис. 4).
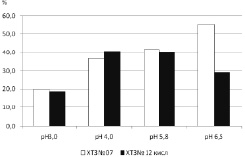
Рис. 4. Общая каталитическая активность трипсина (А), иммобилизованного при различных рН среды на хитозан № 07 и № 12, после хранения в течении 3 суток (% от активности свободного фермента)
Заключение
Таким образом, нами было показано, что ХТЗ № 12 наиболее эффективен для использования в качестве матрицы для иммобилизации, так как обладает большей сорбционной емкостью по сравнению с хитозаном № 07. В ходе проведенных исследований была разработана методика адсорбционной иммобилизации трипсина на матрице хитозана, в результате которой сохраняется до 78 % активности фермента при степени иммобилизации до 65 %. Оптимальными условиями для иммобилизации оказались значения рН 5,0–6,5, что, вероятно, связано с тем, что рКа хитозана колеблется около величин 6,3–6,5 в зависимости от степени деацелирования молекулы. Мы также установили, что активность иммобилизованного на ХТЗ № 07 и № 12 трипсина сохраняется на 30–55 % в течение трех суток при хранении образцов в высушенном состоянии.
Рецензенты:
Епринцев А.Т., д.б.н., профессор, заведующий кафедрой биохимии и физиологии клетки, Воронежский государственный университет, г. Воронеж;
Селеменев В.Ф., д.х.н., профессор, заведующий кафедрой аналитической химии, Воронежский государственный университет, г. Воронеж.
Работа поступила в редакцию 16.12.2013.
Библиографическая ссылка
Логинова О.О., Холявка М.Г., Артюхов В.Г., Беленова А.С. РАЗРАБОТКА МЕТОДИКИ ПОЛУЧЕНИЯ ГЕТЕРОГЕННОГО БИОКАТАЛИЗАТОРА НА ОСНОВЕ ТРИПСИНА, ИММОБИЛИЗОВАННОГО НА МАТРИЦЕ ХИТОЗАНА // Фундаментальные исследования. 2013. № 11-3. С. 484-487;URL: https://fundamental-research.ru/ru/article/view?id=33148 (дата обращения: 02.02.2026).



