Диагностика и лечение миомы матки – актуальная проблема современной гинекологии [1, 2, 3]. В зависимости от характера пролиферативных процессов в миоматозном узле выделяют морфологические формы миомы матки: простая и пролиферирующая. Лечебные мероприятия во многом определяются особенностями строения и ангиогенезамиоматозных узлов [8]. При этом гистерэктомию проводят в 1–92 % случаев, а реконструктивно-пластические операции – только в 8–19 %, что связано с поздней выявляемостью заболевания и отсутствием четких критериев диагностики между его различными морфологическими формами [4, 5, 6, 11]. В последние годы в медицинской практике нашли применение различные методы компьютерного прогнозирования тех или иных патологических состояний, призванные создать модель индивидуального прогноза течения заболевания, что позволяет оптимизировать лечебные мероприятия [7].
Цель – разработка алгоритма дифференциальной диагностики простой и пролиферирующей миомы матки по данным ультразвукового исследования.
Материалы и методы исследования
На основании изучения результатов гистологического строения опухолей, полученных при хирургическом лечении 193 пациенток (в 131 случае имела место простая миома, в 62 – пролиферирующая миома) репродуктивного возраста (средний возраст составил 35,2 ± 5,6 лет), оперированных по поводу миомы матки в Базовой акушерско-гинекологической клинике КубГМУ Минздрава РФ в период с 2009 по 2012 год, был проведен ретроспективный анализ эхографических, допплерографических, допплерометрических, гистографических показателей. Для определения диагностической ценности изучаемых параметров в качестве «золотого стандарта» использовали результаты, полученные при гистологическом исследовании удаленных миоматозных узлов. Исследование внутренних половых органов осуществляли на сканере PHILIPSHD – 11. При эхографической визуализации опухолевидных образований матки определяли локализацию, форму, размеры, тип эхоструктуры. При помощи ЦДК визуально оценивали наличие кровотока, тип кровотока, количество цветовых локусов на единицу площади. При импульсной допплерометрии оценивали следующие показатели: максимальная систолическая скорость артериального кровотока (МАС), максимальная скорость венозного кровотока (МВС), пульсационный индекс (ПИ), индекс резистентности (ИР). При анализе гистограмм оценивали: среднее значение яркости в исследуемой и фоновой зонах, минимальные (Отклmin) и максимальные (Отклmax) отклонения в исследуемой и фоновой зонах, критерий эхооднородности исследуемой зоны (КЭО), критерий изоэхогенности исследуемой зоны (КИЗ). Критерий эхооднородности определяли по формуле:
КЭО = ПОткл2 – Откл,
где ПОткл2 – погрешность отклонения в фоновой зоне (ПОткл2 = Отклmax – Отклmin); Откл – разница отклонений в исследуемой и фоновой зоне.
Критерий изоэхогенности исследуемой зоны определяли по формуле:
КИЗ = |Срярк|-Откл2,
где |Срярк| – модуль разницы средних значений яркости в исследуемой и фоновой зонах; Откл 2 – отклонение в фоновой зоне [9, 11].
Количественные переменные описывались следующими статистиками: числом пациентов, средним арифметическим значением, стандартным отклонением от среднего арифметического значения. Качественные переменные описывались абсолютными и относительными частотами (процентами). Различия считались статистически значимыми при уровне значимости p < 0,05. Для количественных переменных проводился тест на нормальность распределения при помощи критерия Шапиро–Вилка. Для сравнения двух групп нормально распределенных данных использовали t-критерий Стьюдента. При сравнении двух групп данных, распределение которых отличалось от нормального, применяли критерий Манна–Уитни в случае независимых признаков и критерий Вилкоксона для зависимых признаков. При анализе качественных признаков данные представляли в виде количественных признаков и анализировали с помощью критерия Фишера и критерия c-квадрат Пирсона. Чувствительность, специфичность показателей, а также их диагностическую ценность определяли при помощи ROC (Receiver Operator Characteristic) – анализа с последующим вычислением площади под ROC-кривой (AUC). Для разработки математической модели, позволяющей дифференцировать различные типы миомы матки, использовали логистический регрессионный анализ. Вероятность наступления события для некоторого случая рассчитывается по формуле:
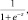
где –z = B1x1 + B2x2 + ...+ Bnxn + С.
Качество приближения регрессионной модели оценивали при помощи функции правдоподобия, мерой которой служит отрицательное удвоенное значение логарифма этой функции (-2LL). Меру определенности, показывающую часть дисперсии выборки, которую можно объяснить с использованием исследуемой модели, оценивали при помощи критериев Кокса–Шела и Наделькеркеса. Проверку значимости коэффициентов проводили при помощи статистики Вальда (ZW), используя распределение χ-квадрат.
Из-за вовлечения в анализ большого количества переменных для упрощения модели проводили отбор переменных. Отбор переменных для математической модели осуществляли методом обратной селекции на основании статистики Вальда. То есть из первичной модели, включающей в себя все предикторы, пошагово исключались предикторы с наименьшим значением статистики Вальда. На каждом шаге данного алгоритма проводился расчет доли верно классифицированных наблюдений. Алгоритм остановился, когда исключение переменной с наименьшим значением статистики Вальда привело к статистически значимому снижению доли верно классифицированных случаев. Прогностическую ценность полученной регрессионной модели проверили при помощи ROC-анализа по указанной выше методике.
Расчет выполнен на персональном компьютере с использованием приложения Microsoft Excel 2010 (MicrosoftCorp., USA), пакетов статистического анализа данных Statistica 8.0 forWindows (StatSoftInc., USA), SPSS 15.0 (IBM, USA), Medcalc (MedCalc Software, Belgium).
Результаты исследования и их обсуждение
Мультипиковый или сглаженный тип гистограммы встречался при пролиферирующей миоме в 40 (64,5 %) наблюдениях, что статистически значимо (p < 0,0001) чаще, чем при простой миоме, где данный вид гистограммы зафиксирован лишь в 5 (3,2 %) случаях. В непролиферирующих миоматозных узлах гистограмма в 96,8 % случаев представлена одновершинным равносторонним или асимметричным треугольником. В пролиферирующих миоматозных узлах гистограмм в виде равностороннего треугольника зафиксировано не было, асимметричный треугольник встречался у 22 (35,5 %) пациенток.
Таким образом, можно утверждать, что для простой миомы характерна гистограмма в виде равностороннего или асимметричного треугольника, а для пролиферирующей – мультипиковый или сглаженный тип гистограммы. Тем не менее вид гистограммы не может являться единственным ультразвуковым предиктором морфологического типа миомы, так как, обеспечивая высокую специфичность, составляющую 96,2 %, данный параметр обладает низкой чувствительностью – 64,5 %. Ложноотрицательные наблюдения, существенно снижающие чувствительность, появляются за счет гистограмм в виде асимметричного треугольника.
При анализе эхооднородности узлов выявлено, что в 96 (73,3 %) случаях при простом типе миомы встречаются изоэхогенные; гипо- и гиперэхогенные отмечены в 35 (26,7 %) наблюдениях. При простом типе миомы не отмечено появление неоднородных узлов. При пролиферирующей миоме преобладают гипо- и гиперэхогенные узлы, неоднородные встречаются значительно реже. Не было выявлено ни одного изоэхогенного пролиферирующего миоматозного узла. Как простые, так и пролиферирующие узлы с большой степенью вероятности могут отличаться по эхогенности от окружающего миометрия. Если считать признаком пролиферирующей миомы отличие эхогенности от окружающей ткани и неоднородную эхогенность узла, то можно получить диагностический критерий с чувствительностью 100,0 % и специфичностью 73,3 %. Если же считать пролиферирующими все неоднородные узлы, то специфичность достигает 100,0 %, но резко падает чувствительность – до 23,6 %.
Тип васкуляризации отличался в пролиферирующих и непролиферирующих миоматозных узлах. Показано, что при простом типе в 82 (62,6 %) случаях встречается огибающий, что приблизительно в два раза чаще, чем циркулярный – в 46 (35,1 %) наблюдениях; в 3 (2,3 %) случаях выявлен смешанный тип васкуляризации. В пролиферирующих миоматозных узлах преобладает смешанный тип, циркулярный встречается приблизительно в 2 раза реже. Огибающего типа васкуляризации в пролиферирующих узлах зафиксировано не было. Таким образом, аналогично типу гистограммы и эхогенности тип васкуляризации не может служить самостоятельным высокоэффективным диагностическим критерием, так как, хотя он и обладает высокой специфичностью – 97,7 %, значение его чувствительности достигает лишь 66,1 %.
При анализе количественных ультразвуковых данных, полученных при исследовании миоматозных узлов, получены высоко статистически значимые различия (p < 0,01) по следующим параметрам: увеличение максимального размера узла при динамическом наблюдении в течение 6 месяцев, количество цветовых пикселей на 1 см2 площади миоматозного узла, ИР в маточных артериях, МАС в маточных артериях, МВС в отводящих маточных венах, ИР в сосудах очаговых образований, Vmax в артериальных сосудах миоматозных узлов, VVmax венозного кровотока в узле. Между исследованными группами не получено статистически значимых (p = 0,660) различий размеров миоматозных узлов (табл. 1).
Таблица 1
Различия количественных ультразвуковых параметров между исследуемыми группами
|
Параметры |
Простая миома (n = 131) |
Пролиферирующая миома (n = 62) |
p |
|
Размеры миоматозных узлов, мм |
38,1 ± 6,5 |
39,3 ± 6,6 |
0,660 |
|
Прирост максимального узла при динамическом наблюдении, мм |
0,54 ± 0,23 |
1,71 ± 0,45 |
< 0,001 |
|
Количество цветовых пикселей на 1 см2 |
2,01 ± 1,56 |
5,07 ± 1,22 |
< 0,001 |
|
ИР в маточных артериях |
0,77 ± 0,05 |
0,64 ± 0,08 |
0,001 |
|
МАС в маточных артериях, см/с |
35,0 ± 2,4 |
44,0 ± 4,4 |
< 0,001 |
|
МВС в отводящих маточных венах |
9,5 ± 2,5 |
20,4 ± 3,3 |
< 0,001 |
|
ИР в сосудах очаговых образований |
0,66 ± 0,15 |
0,45 ± 0,15 |
< 0,001 |
|
Vmax в артериальных сосудах очаговых образований |
12,2 ± 4,6 |
29,3 ± 2,3 |
< 0,001 |
|
VVmax скорость венозного кровотока в узле |
6,4 ± 1,6 |
11,3 ± 2,3 |
< 0,001 |
Рассмотренные выше качественные и количественные параметры были включены в модель многофакторной логистической регрессии. Исключение параметров, обладающих наименьшей диагностической ценностью, осуществлялось с помощью метода обратной селекции в соответствии со значением критерия Вальда.
При расчете было выполнено 8 шагов алгоритма, не более чем с 1000 итераций на каждом шаге. На 8 шаге при исключении параметра с наименьшим значением критерия Вальда происходило статистически значимое снижение качества приближения регрессионной модели, оцененное при помощи отрицательного удвоенного значения логарифма функции правдоподобия (-2LL). Кроме того, после выполнения 1000 итераций не удалось определить регрессионные коэффициенты модели с незначительными стандартными ошибками. Учитывая эти обстоятельства, алгоритм вычисления модели был остановлен на 8 шаге, за итоговую математическую модель, позволяющую диагностировать тип миомы матки, принята модель, полученная на шаге 7. Регрессионные коэффициенты приведены в табл. 2.
Уровень значимости, при котором не отвергается гипотеза о допустимо незначимых расхождениях между фактической и модельной классификацией – простая – пролиферирующая миома, оцененный по методу Хосмера–Лемешова, у разработанной модели был оптимальным и составил 95 %.
Таблица 2
Регрессионные коэффициенты переменных, использованных в конечном варианте модели
|
Параметры |
B |
Стандартная ошибка |
Статистика Вальда |
dF |
P |
|
Рост за 6 месяцев, мм |
0,71 |
0,21 |
11,6 |
1 |
0,001 |
|
Количество цветовых пикселей |
1,11 |
0,45 |
6,02 |
1 |
0,014 |
|
Vmax в маточных артериях |
0,27 |
0,13 |
4,23 |
1 |
0,040 |
|
Vmax в отводящих маточных венах |
–0,49 |
0,28 |
3,04 |
1 |
0,081 |
|
ИР в сосудах очаговых образований |
–17,2 |
4,89 |
12,3 |
1 |
0,000 |
|
Vmax в артериальных сосудах очаговых образований |
0,27 |
0,09 |
8,85 |
1 |
0,003 |
|
Константа |
–13,3 |
6,07 |
4,79 |
1 |
0,029 |
Полученная нами математическая модель обладает высокими операционными характеристиками диагностического теста. Вычисленная диагностическая чувствительность модели – 93,5 %, специфичность – 97,7 %, эффективность – 95,6 %, прогностическая ценность положительного результата – 95,1 %, прогностическая ценность отрицательного результата – 96,9 %. При проведении ROC-анализа также была показана очень высокая диагностическая эффективность разработанной модели. Площадь под ROC-кривой составила 0,992 (95 % ДИ 0,966 – 0,999, p < 0,0001).
Таким образом, учитывая полученные регрессионные коэффициенты, можно построить диагностическую модель вида:
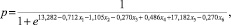
где x1 – увеличение в размерах за 6 месяцев, мм; x2 – количество цветовых пикселей; x3 – Vmax в маточных артериях, см/с; x4 – Vmax в отводящих маточных венах; x5 – ИР в сосудах очаговых образований; x6 – Vmax в артериальных сосудах очаговых образований.
Результат логистической регрессии можно представить графически.
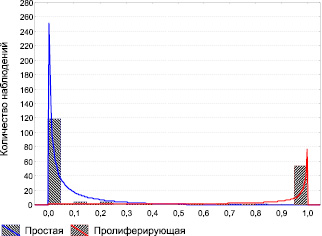
Распределение вероятности наличия различных типов миомы матки
На рисунке показано распределение вероятности, вычисленной при помощи разработанной формулы в группах, отличающихся по типу миоматозного узла. Если принимать за критический уровень прогноза вероятность, равную 0,5, то практически все исследованные наблюдения правильно описываются разработанной формулой.
Для упрощения оценки вероятности наличия пролиферирующей миомы нами была разработана шкала, приведенная в табл. 3.
Таблица 3
Шкала оценки прогноза типа миомы
|
P |
Вероятность наличия пролиферирующей миомы |
|
0,9–1,0 |
Очень высокая |
|
0,7–0,9 |
Высокая |
|
0,5–0,7 |
Средняя |
|
Менее 0,5 |
Неудовлетворительное |
Большинство рассмотренных нами случаев имело очень высокую вероятность, более 90 %.
Вывод
Таким образом, использование разработанной нами математической модели позволяет на основании комплексной оценки данных сонографии миоматозных узлов с высокой чувствительностью и специфичностью определять морфологический тип миомы матки, что было недоступно ранее при использовании отдельных ультразвуковых критериев.
Рецензенты:
Поморцев А.В., д.м.н., профессор, заведующий кафедрой лучевой диагностики, ГБОУ ВПО КубГМУ Минздрава России, г. Краснодар;
Астафьева О.В., д.м.н., доцент кафедры лучевой диагностики, ГБОУ ВПО КубГМУ Минздрава России, г. Краснодар.
Работа поступила в редакцию 14.10.2013.
Библиографическая ссылка
Бабкина А.В., Крутова В.А., Наумова Н.В. АЛГОРИТМ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ ПРОСТОЙ И ПРОЛИФЕРИРУЮЩЕЙ МИОМЫ МАТКИ НА ОСНОВАНИИ ДАННЫХ УЛЬТРАЗВУКОВОГО ИССЛЕДОВАНИЯ // Фундаментальные исследования. 2013. № 11-1. С. 17-21;URL: https://fundamental-research.ru/ru/article/view?id=33002 (дата обращения: 15.12.2025).



