На сегодняшний день хемилюминесценция представляет большую область науки, находящуюся на стыке между химией, физикой и биологией. При хемилюминесценции происходит прямое преобразование химической энергии в энергию электромагнитных колебаний, т.е. в свет. Используя хемилюминесценцию, можно узнать о том, как протекает реакция, каков ее механизм, что необходимо для эффективного и рационального проведения технологических процессов. Если технологический процесс получения какого-либо химического продукта сопровождается хемилюминесценцией, то ее интенсивность может служить мерой скорости процесса: чем быстрее идет реакция, тем ярче свечение. В ходе реакции хемилюминесценции получаются богатые энергией продукты, которые затем отдают энергию, излучая свет, т. е. химическая энергия превращается в энергию электромагнитного излучения [6].
Цель исследования – изучить возможность использования хемилюминесценции для оценки антиоксидантной активности пищевых веществ.
Результаты исследования и их обсуждение
Проблема оценки антиоксидантной активности пищевых веществ является весьма актуальной. Использование термина «антиоксидантная активность» для того, чтобы показать полезность того или иного продукта, зачастую делается без всякой химической и биохимической аргументации. Как правило, под антиоксидантной активностью любого вещества подразумевается эффективность снижения величины перекисного числа. Само же понятие перекисного числа также не совсем раскрывает свою химическую суть, поскольку не вполне соответствует кинетике и термодинамике стадий метаболизма того или иного пищевого продукта. К тому же эта величина используется для характеристики липидов в форме жиров [4]. Однако процессы окисления и формирования перекисей в организме происходят не только при употреблении жиров, но и других продуктов. Другими словами, содержание перекиси в том или ином продукте можно сказать «взвешивается» на своеобразных весах, где «эталонным весом» является единица концентрации в кислой среде иодид иона, окисленного перекисями, вследствие чего образуется молекулярный иод:
I– – е → I; (1)
I + I → I20. (2)
При титровании молекулярного иода раствором, содержащим тиосульфат натрия, устанавливается его концентрация и, следовательно, определяется количество окислителей иодид ионов, т.е. перекисных соединений, что собственно и называется перекисным числом [1]. Определение перекисного числа с помощью такого рода «взвешивания» основано на реакции, приведенной на рис. 1.
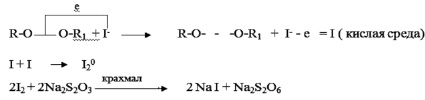
Рис. 1. Определение перекисного числа с помощью тиосульфата натрия
Таким образом, концентрация пероксидов определяется из уравнения
С(I2) = ϒ(C[–O–O–]), (3)
где ϒ – коэффициент корреляции между концентрацией молекулярного иода и концентрацией пероксидов.
Предлагаемый нами способ определения пероксидов в продуктах основан на хемилюминесценции люминола (C[лм]) в щелочной среде, интенсивность (Iхл) которой зависит от концентрации пероксидов (C[–O–O–]), в хемилюминесцентной пробе [2]:
IХЛ. = Ϧхл ω, (4)
где Ϧхл – квантовый выход хемилюминесценции; ω – скорость реакции с участием пероксидов:
kхлC[–O–O–] C[лм] = ω, (5)
где kхл – константа скорости реакции или при:
C[лм] kхл Ϧхл = К, (6)
имеем:
IХЛ = К C[ -O-O- ]. (7).
Количество пероксидов (–O–O–) определяется светосуммой (S):
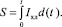 (8)
(8)
Величина S зависит от степени полноты расходования перекиси в хемилюминесцентной реакции.
Для определения константы К строится калибровочная кривая зависимости светосуммы S от концентрации перекиси, которую устанавливают титрованием:
S = f(С[–O–O–]). (9)
В качестве пероксидов используется перекись водорода Н2О2.
Затем сравниваются данные, полученные из уравнения (3) и (9). На основании сравнения ϒ и К делается вывод о согласовании механизмов реакций, лежащих в основе определения пероксидов указанными способами. Выявлено, что в этом интервале концентраций пероксидов ϒ и К действительно согласуются друг с другом и поэтому их можно использовать для определения перекисного числа [2].
Хемилюминесценцию наблюдали в щелочной среде, содержащей люминол (5-амино-1,2,3,4-тетрагидро-1,4-фталазиндион, гидразид 3-аминофталевой к-ты, H2L). Регистрировали ее с помощью хемилюминесцентной установки, включающей стеклянный вакуумный фотоумножитель. Питание фотоумножителя осуществляется с помощью высоковольтного выпрямителя (7), сопряженного с блоком (9), усиливающим сигнал фотоумножителя, который регистрируется на дисплее монитора компьютера (5).
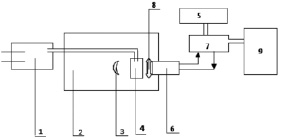
Рис. 2. Регистрация хемилюминесценции анализируемого продукта: 1 – насос-дозатор; 2 – светонепроницаемая камера; 3 – зеркало; 4 – кювета; 5 – компьютерная система; 6 – фотоумножитель; 7 – высоковольтный выпрямитель; 8 – устройство, позволяющее определять спектральную область хеминилюминесцентного излучения; 9 – блок, усиливающий сигнал фотоумножителя
Насос-дозатор (1) необходим для ввода анализируемой пробы в кювету (4), содержащую хемилюминисцирующий раствор люминола. Данный дозатор выполняет роль перемешивателя вводимой пробы с хемилюминесцирующим раствором. Для усиления скорости реакции и интенсивности хемилюминесценции к люминолу добавляли раствор железосинеродистого калия. Перемешивание производится пузырьками воздуха, полученными при прокачивании насосом воздуха через жидкость раствора. Зеркало (3), находящееся в светонепроницаемой камере (2), служит для лучшего светосбора хемилюминесцентного излучения, падающего на фотокатод фотоумножителя (6), вмонтированного в светонепроницаемую камеру. Дозатор позволяет вводить нужные компоненты жидкости в кювету, не открывая светонепроницаемой камеры (2) во время опытов. При этом указанные жидкости поступают в кювету (4) по стеклянным либо пластмассовым трубкам. Компьютерная система позволяет регистрировать зависимость интенсивности свечения I от времени t, то есть кинетику хеминилюмисценции:
I = f(t). (10)
Компьютерная система отражает константы нарастания и спада в функции I = f(t), которые сопрягаются с константами скоростей реакций, обуславливающих хемилюминесценцию, то есть с их кинетиками [5]. В хемилюминесцентную камеру включается устройство (8), позволяющее определять спектральную область хемилюминесцентного излучения, то есть зависимость:
I = f1(λ). (11)
Этот блок представляет собой кассету в виде диска, в которую вмонтированы граничные светофильтры. Смена светофильтров осуществляется поворотом кассеты диска относительно горизонтальной оси, соединяющей центры плоскости светофильтров и плоскости фотокатода фотоумножителя.
Процесс измерения осуществляется следующим образом:
1. Устанавливается реакция фотоумножителя на изменения напряжения его питания и на изменение интенсивности эталонного источника света, который падает на его катод.
2. Производится заполнение кюветы раствором люминола в щелочной среде.
3. Осуществляется заполнение дозатора анализируемой пробой.
4. Регистрируется зависимость интенсивности хемилюминесценции от времени t. Наблюдения за хемилюминесценцией осуществляется до момента времени t1, при котором изменение I1 от времени t минимально: I1 = f1(t).
5. Подается с помощью дозатора порция анализируемого раствора.
6. Наблюдается хемилюминесценция анализируемой пробы, кинетика которой I = f(t).
На рис. 3 представлен график зависимости функций (I1 = f1(t)), сопряженный с графиком (I = f(t)), после введения анализируемого раствора.
Как видно из рис. 3, интенсивность хемилюминесценции люминола меняется: за резким подъемом следует резкий спад свечения после добавления анализируемой пробы.
Поскольку усиление хемилюминесценции при окислении люминола связано с образованием пероксидов, то снижение интенсивности хемилюминесценции после введения анализируемой пробы свидетельствует об уменьшении их количества [6]. Следовательно, можно говорить о наличии антиоксидантной активности у соединений, входящих в состав анализируемой пробы.
Необходимо отметить, что в качестве анализируемой пробы использовался полученный путем сухой низкотемпературной перегонки экстракт одуванчика, в состав которого входят фенольные соединения, известные своей высокой антиоксидантной активностью.
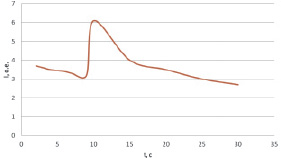
Рис. 3. График зависимости функций (I1 = f1(t)), сопряженный с графиком (I = f(t)), после введения анализируемого раствора
Кроме того, в ходе эксперимента установлено, что при помощи хемилюминесценции можно определять количество пероксидов в сверхразбавленных системах, что важно для оценки начала окисления продуктов, например, в процессе их хранения [3].
Таким образом, проведенные исследования показали, что способ определения пероксидов в продуктах, основанный на хемилюминесценции люминола в щелочной среде, позволяет оценить антиоксидантную активность пищевых веществ и может быть использован для установления антиоксидантных свойств различных пищевых соединений.
Рецензенты:
Литвинова Е.В., д.т.н., профессор кафедры технологии, организации и гигиены питания, ФГБОУ ВПО «ОрелГИЭТ», г. Орел;
Ковалева О.А., д.б.н., директор ИНИИЦ, ФГБОУ ВПО «Орловский государственный аграрный университет», г. Орел.
Работа поступила в редакцию 08.11.2013.
Библиографическая ссылка
Паничкин А.В., Большакова Л.С., Милентьев В.Н., Санников Д.П., Казьмин В.М. ИСПОЛЬЗОВАНИЕ ХЕМИЛЮМИНЕСЦЕНЦИИ ДЛЯ ОЦЕНКИ АНТИОКСИДАНТНЫХ СВОЙСТВ ПИЩЕВЫХ ВЕЩЕСТВ // Фундаментальные исследования. 2013. № 10-11. С. 2436-2439;URL: https://fundamental-research.ru/ru/article/view?id=32810 (дата обращения: 23.02.2026).



