Год от года смертность от сердечно-сосудистых заболеваний не снижается и занимает ведущие позиции в медицинской статистике во всем мире. Причем 62 % смертности от сердечно-сосудистых заболеваний приходится именно на патологию, связанную с утратой части работоспособного миокарда (ишемия, инфаркт и др.), что приводит к нарушению основной функции сердца – нагнетательной.
В настоящее время изучение закономерностей процессов гистогенеза, морфологических основ функционирования и репаративного, и регенеративного потенциала сердечной мышечной ткани считается одной из основных проблем, имеющих как фундаментальные, так и прикладные аспекты. В связи с этим неудивительно сохранение устойчивого интереса исследователей к морфологическим изменениям кардиомиоцитов, возникающим при различных патологических процессах, нарушениях в ходе эмбриогенеза и действии различных физиологических и фармакологических факторов.
Цель настоящей работы – изучение морфологических изменений миокарда при экспериментальной патологии (синдром хронического стресса) и условиях введения витамина А.
Материал и методы исследования
В качестве объекта исследования были использованы белые беспородные крысы различных сроков эмбрионального и постнатального развития в соответствии с «Правилами проведения работ с использованием экспериментальных животных». Крыс с датированным сроком беременности получали по стандартной методике (Методы биологии развития, 1977). Первым днем беременности животных считали день обнаружения сперматозоидов во влагалищных мазках. Животные были разделены на несколько групп: 1 – интактные крысы (контроль); 2 – животные, подвергнутые хронической иммобилизации; 3 – животные, подвергнутые хронической иммобилизации и получавшие витамин А в дозе 10000 МЕ ежедневно с первого дня беременности; 4 – животные, получавшие витамин А в дозе 10000 МЕ ежедневно с первого дня беременности. Иммобилизационный стресс воспроизводили ежедневным помещением животных в тесные пеналы, ограничивающие подвижность животных. Длительность иммобилизации составляла 6 часов (25 %) в течение 30 дней.
Для проведения светового исследования использовали фиксацию материала в 10 % нейтральном формалине на фосфатном буфере (рН 7,4), заливку в парафин.
Для электронной микроскопии использовали префиксацию в 2,5 % глутаральдегиде на 0,2 М какодилатном буфере (рН 7,4), фиксацию в 1 % ОsО4 и заливали в аралдит. Для обеспечения прицельного электронно-микроскопического анализа получали серийные полутонкие срезы толщиной 1–2 мкм, которые окрашивали 1 % раствором метиленового синего. Прицельные ультратонкие срезы толщиной 200–500 нм просматривали в электронном микроскопе Hitachi-HU-12. (Авторы приносят благодарность члену-корреспонденту РАМН, профессору Банину В.В. за помощь в проведении электронно-микроскопического исследования).
Результаты исследования и их обсуждение
Витамин А – вещество, являющееся компонентом пищи и очень широко используемое как БАД. Его активное применение началось с выявлением биологической активности в начале 1900-х годов. В то же время витамин А является уникальным среди витаминов из-за очень узкого интервала концентраций, при которых не проявляется ни его дефицит, ни его токсичность (малая широта терапевтического действия). Поэтому введением витамина А можно вызвать тератогенный эффект, приводящий к значительным изменениям органогенеза
Ретиноевая кислота является самым активным производным витамина А. Она участвует в регуляции эмбрионального развития, тканевого гомеостаза и клеточной дифференцировки и пролиферации.
Ультраструктурные перестройки диффренцирующихся кардиомиоцитов 18-дневных эмбрионов, по нашим данным, вероятно, вызываются действием витамина А на клеточные мембраны – плазмолемму, мембраны митохондрий. Мы отмечали митохондрии с повреждением крист разной степени, а также частично или полностью разрушенные органеллы. Наблюдавшиеся также участки повреждения плазмолеммы, вероятно, явились причиной развития внутриклеточного отека, что, как мы считаем, вызвало деструкцию и других органелл. Значительные повреждения оболочки клетки, по-видимому, явились следствием возникновения и интерстициального отека (рис. 1).
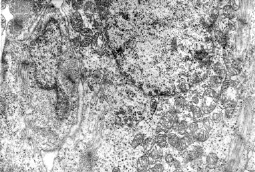
Рис. 1. Электронная микрофотография. Эмбрион крысы. 18 суток. Предсердие. Витамин А. Фрагмент кардиомиоцита: Я – ядро, Мх – митохондрии, Мф – миофибриллы, КГ – комплекс Гольджи. Ув. 10000
В рассматриваемый период наблюдались нарушения структуры кардиомиоцитов и в предсердиях, и в желудочках. Однако, на наш взгляд, их степень была выше в желудочках. Хотя зависимости между развитием органелл, в том числе и сократительного аппарата, мы не обнаружили. Стоит отметить и мозаичность повреждений. Так, встречались клетки с типичным строением и с повреждениями разной степени, соединенные через вставочный диск.
Действие витамина А в этом периоде развития, по нашим данным, не приводило к усилению процессов апоптоза. Возможно, это связано с описанным в литературе антиапоптозным влиянием метаболита витамина А – ретиноевой кислоты. Так, выключение экспрессии рецепторов ретиноевой кислоты RAR и RXR вызывает апоптоз кардиомиоцитов в нормальных условиях.
У новорожденных крысят, наряду с реактивными изменениями, преобладавшими в кардиомиоцитах 18-дневных эмбрионов, наблюдали и дегенеративные нарушения ультраструктуры. Углублялись перестройки ядер. В них появлялись глубокие инвагинации ядерной оболочки, вплоть до образования сегментов, фрагментировалась ядерная оболочка, увеличивалась электронная плотность кариоплазмы. Ядра принимали пикнотический вид. Становились более выраженными и повреждения структур цитоплазмы. Чаще встречались клетки с обширными зонами внутриклеточного отека. Повреждение и разрушение митохондрий вынуждало клетки использовать анаэробные пути получения энергии, о чем свидетельствует уменьшение количества гранул гликогена в цитоплазме (рис. 2).
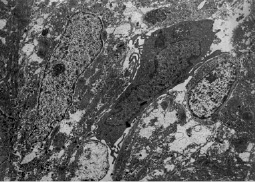
Рис. 2. Электронная микрофотография. Новорожденная крыса. Предсердие. Витамин А. Группа клеток с цитоплазмой разной электронной плотности. «Светлые» кардиомиоциты имеют многочисленные участки отека и лизиса в цитоплазме. Ув. 7000
De Oliveira и др. (2012) показали, что после введения крысам высоких доз витамина А, митохондрии in vitro были менее устойчивы к действию повреждающих факторов [1]. В то же время введение беременным крысам низких доз ретиноевой кислоты приводит к постнатальному уменьшению активности ферментов митохондрий в мозжечке [6].
Развитие и накопление органелл давало клетке больше возможностей для внутриклеточной регенерации. В кардиомиоцитах новорожденных мы наблюдали скопление лизосом в участках, где наблюдалось разрушение органелл. Усиление темпов миофибриллогенеза выявляло влияние витамина А и на этот процесс. Данные литературы свидетельствуют, что ретиноевая кислота положительно влияет на образование миофибрилл. В опытах Rohrer и др. (1991) ретиноевая кислота усиливала экспрессию матричной РНК тяжелых цепей миозина и альфа актинина в миоцитах новорожденной крысы в культуре [5]. А Vélez с сотр. (2003) установили, что ретиноевая кислота увеличивала уровни альфа – тропомиозина и тропонина – Т в кардиомиоцитах куриных эмбрионов на разных стадиях развития [7]. По нашим данным, с ростом миофибрилл становились более заметны и повреждения их структуры. Однако, учитывая стимулирующее действие ретиноевой кислоты на синтез миофибриллярных белков, наблюдаемое повреждение миофибрилл скорее вторично и, вероятнее всего, связано с деструктивным действием внутриклеточного отека.
Изучение электронно-микроскопического строения миокарда на ранних постнатальных этапах развития показало постепенное уменьшение количества деструктивно измененных кардиомиоцитов и степени их поврежденности. В течение первой недели после рождения наблюдались главным образом реактивные изменения ультраструктуры, тогда как повреждения деструктивного характера почти отсутствовали (рис. 3).
Возможно это объясняется увеличением устойчивости к повреждающему действию витамина А у более дифференцированных кардиомиоцитов. Также можно предположить, что увеличение количества клеток, как мышечных, так и соединительнотканных, приводит к увеличению потребности миокарда в ретиноидах и, соответственно, снижении количества витамина А, воздействующего на одну клетку.
По нашим наблюдениям, в этом возрасте продолжает развиваться интерстициальный компонент миокарда – растут сосуды, увеличивается количество соединительнотканных клеток. Наши результаты свидетельствуют, что кардиомиоциты, по крайней мере, не поврежденные или мало поврежденные, сохраняют способность к эндомитозу. Более того, ретиноевая кислота в малых физиологических дозах способствует возникновению гипертрофии кардиомиоцитов [2]. Увеличение количества ДНК в клетке приведет к увеличению количества рецепторов витамина А в клетке и, соответственно, к увеличению потребности клетки в витамине А.
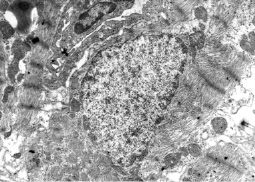
Рис. 3. Электронная микрофотография. Крыса 3 суток после рождения. Предсердие. Витамин А. Кардиомиоциты имеют зоны отека и повреждения органелл. Капилляр в интерстиции спазмирован. Ув. 7000
С возрастом, по нашим данным, происходит дальнейшее ослабление ультраструктурных проявлений действия витамина А. Так, у одномесячного крысенка уже практически не встречаются разрушающиеся клетки, а наблюдаемые изменения строения носят характер адаптивно-реактивных.
Несколько неожиданными оказались результаты, полученные при введении витамина А на фоне стресса. Данные, полученные в первой части работы, свидетельствуют о деструктивном влиянии витамина А на структуру кардиомиоцитов. Многочисленные литературные данные о влиянии стресса разного генеза на миокард также говорят о его повреждающем эффекте. Казалось бы, следует ожидать, что наложение двух повреждающих факторов приведет к суммации их воздействия на кардиомиоциты. Однако мы наблюдали незначительное увеличение как степени повреждений, так и количества поврежденных клеток. Вероятно, это обусловлено тем, что стресс вызывает у крыс уменьшение количества витамина А в печени, почках и яичках. В физиологических дозах витамин А оказывает защитное действие при стрессах, а его недостаток усиливает повреждения, вызванные окислительным стрессом и запускает программу уничтожения клетки [3, 4]. Однако, цитопротекторное влияние витамина А не смогло полностью компенсировать деструктивное влияние стресса. Об этом свидетельствуют наблюдавшиеся нами отек и участки лизиса компонентов цитоплазмы кардиомиоцитов. Следует отметить тот факт, что митохондрии в таких клетках не имели повреждений структуры. Это, по–видимому, также объясняется положительным влиянием витамина А. О не полном компенсировании действия стресса свидетельствуют и повреждения компонентов интерстиция, в частности капилляров, а также наблюдавшаяся нами склеротизация интерстиции в предсердиях.
Заключение
В целом, действие витамина А на кардиомиогенез характеризуется комплексом реактивных морфологических изменений, которые характеризуются интенсивностью их нарастания вплоть до рождения и последующим ослаблением в постнатальный период. Наиболее выраженным влиянием витамин А обладает на желудочковые кардиомиоциты. Введение витамина А на фоне стресса частично купирует его деструктивное влияние, защищая митохондрии, а также оказывая антиапоптозный эффект.
Рецензенты:
Суворова Г.Н., д.м.н., профессор, заведующая кафедрой анатомии человека, ГБОУ ВПО «Самарский государственный медицинский университет» Минздравсоцразвития РФ, г. Самара;
Колсанов А.В., д.м.н., профессор, заведующий кафедрой оперативной хирургии и клинической анатомии человека с курсом инновационных технологий, ГБОУ ВПО «Самарский государственный медицинский университет» Минздравсоцразвития РФ, г. Самара.
Работа поступила в редакцию 30.10.2013.
Библиографическая ссылка
Шурыгин С.А., Ямщиков Н.В., Балашов В.П., Абрамов В.Н., Шурыгина О.В. МОРФОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА КАРДИОМИОГЕНЕЗА КРЫС В УСЛОВИЯХ ХРОНИЧЕСКОГО СТРЕССА И ВОЗДЕЙСТВИЯ ВИТАМИНА А // Фундаментальные исследования. 2013. № 9-5. С. 949-953;URL: https://fundamental-research.ru/ru/article/view?id=32799 (дата обращения: 05.01.2026).



