В последние годы обнаружена группа заболеваний, характеризующихся прогрессирующим поражением различных отделов нервной системы и имеющих необычный генетический механизм возникновения и развития. На основании сходства морфологического дефекта при этих заболеваниях их объединяют в группу трансмиссивных спонгиоформных энцефалопатий (прионных болезней).
В мире известно шесть прионных болезней животных и четыре – человека. В группу прионных заболеваний человека входят: куру, болезнь Крейтцфельдта–Якоба (БКЯ), болезнь Герстмана–Штросслера и смертельная семейная бессонница. Среди прионных болезней животных основными являются скрепии (медленно развивающаяся прионная инфекция овец, аналог коровьего бешенства) и губкообразная энцефалопатия крупного рогатого скота.
Ключевой характеристикой прионных заболеваний является образование белка патогенной формы (PrPSc), который представляет собой посттрансляционно модифицированную изоформу нормального прионного белка (PrPC). Изоформа PrPSc, как и PrPC, кодируется геном PRNP, расположенным на коротком плече 20-й хромосомы [4].
Начало заболевания наступает, как правило, в среднем или позднем возрасте. Заражение человека чаще всего происходит при употреблении в пищу мясопродуктов, полученных от зараженных животных, либо при нейрохирургических вмешательствах, трансплантации тканей, назначении гормонов, полученных от зараженных доноров с нераспознанной прионной инфекцией [2].
Основными методами диагностики прионных заболеваний животных остаются различные варианты иммунологического анализа, а именно: иммуногистохимическое выявление аномальной формы приона на срезах тканей мозга, электроэнцефалография, вестерн-блоттинг и имунноферментный анализ (ИФА). В основе метода ИФА лежит присоединение растворимых антигенов или антител к твердой фазе с сохранением иммунологической активности и применение фермента в качестве маркера иммунологической реакции, происходящей на твердой фазе. Чувствительность метода составляет от 10–1 до 10–12 г/мл [6].
Наибольшее распространение, в том числе и в России, получила система TeSeE™ (набор реагентов для очистки и определения методом ИФА in vitro патогенной формы прионного белка). Данная система в рамках Европейского союза утверждена в качестве экспресс-теста на губчатые энцефалопатии и скрепии крупного рогатого скота, овец и коз. Основным недостатком набора TeSeE™ является недостаточная чувствительность определения и возможная инфекционная опасность для оператора.
Также одним из недостатков существующих методов диагностики прионных инфекций является использование в качестве объекта исследования тканей мозга или лимфоидных тканей животных, что может повлечь возникновение перекрестной контаминации в процессе переработки животного сырья и заражение патогенной формой прионного белка нормальных прионов, присутствующих в других частях туши.
Целью работы является разработка прототипов молекулярно-генетических тест-систем на основе полимеразной цепной реакции для выявления патогенного прионного белка крупного рогатого скота.
ПЦР-диагностика позволяет проводить анализ содержания патогенной формы прионного белка на основе анализа нуклеотидных последовательностей. Проведение полимеразной цепной реакции позволяет многократно увеличивать специфический участок нуклеотидной последовательности до концентрации, необходимой для идентификации патогенной формы прионного белка, что существенно повышает чувствительность метода и позволяет увеличить наименование образцов, пригодных для исследования. Также при проведении ПЦР в режиме реального времени, когда проба находится в закрытой пробирке, происходит снижение инфекционной опасности для оператора [7].
В данной работе приводятся результаты проведенных исследований по созданию ПЦР-тест системы для определения патогенного прионного белка крупного рогатого скота.
Материалы и методы исследования
Для проведения исследования по определению образцов животного происхождения, потенциально инфицируемых патогенной формой прионного белка, были подготовлены образцы проб крупного рогатого скота и животного сырья. В качестве объектов использовали образцы говядины, говяжью кровь, желатин, цельное молоко, сыр.
Определение содержания общего белка в пробах проводили по методике выполнения измерений массовой доли общего и белкового азота в мясе, мясных продуктах и белоксодержащих пищевых продуктах методом сжигания по Дюма на анализаторе белкового азота «Rapid N cube».
Молекулярно-массовое распределение белков в объектах оценивали с помощью белкового электрофореза в полиакриламидном геле (ПААГ) методом Лэмли. Просмотр и фотографирование гелей проводили на УФ-трансиллюминаторе TCP-20M («Vilber Lourmat», США) при длине волны излучения – 312 нм [5].
Идентификацию белков проводили методом фингерпринта пептидных масс, для чего получали масс-спектр аминокислотной последовательности белка после проведения гидролиза трипсином в ПААГ. Масс-спектры обрабатывались с помощью программы «FlexAnalysis 2.4».
Результаты исследования и их обсуждение
Поскольку различные фракции белков, получаемые из туши крупного рогатого скота, используются в разных областях пищевой и фармацевтической промышленности, были проведены работы по выделению этих белков и оценке их содержания в первоначальном сырье. Результаты исследований представлены в табл. 1.
В дальнейшем было проведено исследование электрофоретического разделения в ПААГ белковых фракций в образцах. Подобрать условия для электрофоретического разделения образцов, состоящих из цельной крови крупного рогатого скота, не удалось, поэтому проводили исследование плазмы крови, которую получали центрифугированием при 3 000 об/мин в течение 5 мин. Результаты распределения белковых фракций в исследуемых образцах представлены на рис. 1.
Электрофоретическое разделение белков в образцах свидетельствуют о том, что фракция водорастворимых белков говядины и плазма крови, содержащие в своем составе белковые фракции массой от 30 до 40 кДа, соответствующие массе нормального прионного белка, имеют потенциально высокую степень инфективности в отношении патогенной формы прионного белка. Отсутствие белковых фракций с молекулярной массой 30-40 кДа подтверждает низкую вероятность содержания прионного белка в образцах цельного молока, сыра, желатина, фракциях солерастворимых белков и белков стромы говядины.
Таблица 1
Общее количественное содержание белка в образцах
|
Объект исследования |
Вес, мг |
Содержание общего азота, % |
Коэффициент пересчета |
Общий белок, % |
Погрешность измерения, ± δ, % |
|
Цельное молоко |
195,60 |
0,656 |
4,64 |
3,02 |
0,31 |
|
192,40 |
0,648 |
||||
|
Желатин |
188,12 |
15,123 |
5,55 |
84,32 |
0,89 |
|
180,72 |
15,538 |
||||
|
Цельная кровь |
214,50 |
3,462 |
6,25 |
21,97 |
1,32 |
|
254,80 |
3,571 |
||||
|
Сыр |
189,70 |
4,686 |
4,64 |
21,46 |
0,95 |
|
229,60 |
4,653 |
||||
|
Говядина |
126,50 |
3,222 |
5,62 |
18,46 |
1,11 |
|
110,00 |
3,347 |
||||
|
Фракция водорастворимых белков говядины |
97,40 |
1,148 |
5,62 |
6,48 |
0,41 |
|
96,50 |
1,167 |
||||
|
Фракция солерастворимых белков говядины |
136,30 |
1,520 |
5,62 |
8,52 |
0,53 |
|
142,25 |
1,528 |
||||
|
Фракции белков стромы говядины |
186,80 |
0,675 |
5,62 |
3,78 |
0,23 |
|
171,20 |
0,679 |
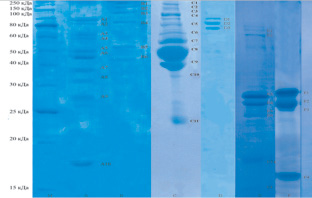
Рис. 1. Электрофорез в полиакриламидном геле: M – маркер; A – фракция водорастворимых белков говядины; B – фракция солерастворимых белков говядины; C – плазма крови; D – желатин; E – цельное молоко; F – сыр
В связи с этим фракция водорастворимых белков говядины и плазма крови были выбраны в качестве дальнейших объектов исследования.
Для изготовления ПЦР-тест-системы были использованы:
1. В качестве реактивов: промывочный буфер, содержащий 50 ммоль/л Tris, 150 ммоль/л NaCl, 0,5 мл/л Tween 20, производства компании «Амтео» (Россия); раствор PBS для блокировки свободных мест связывания, содержащий бычий сывороточный альбумин; раствор PBS, содержащий 1 мл/л Tween компании «Invitrogen» (США), рекомбинантный стрептавидин, биотиниллированное моноклональное антитело к патогенному прионному белку 15В3 (которое реагирует с PrPsc человека, крупного рогатого скота, овцы, олени, мыши и хомяка, но не реагирует с нормальными РrPc прионами, поэтому 15В3 был использован в качестве детектирующего антитела для проведения анализа).
2. Для проведения специфической ПЦР-реакции: матричная ДНК-мишень (несуществующая в природе и специально разработанная для предотвращения ложных срабатываний за счет экзогенных загрязнений), два искусственно синтезированных праймера, ПЦР буфер (который включает Tris-HCl, KClи неионный детергент Triton X-100), МgCl2, Taq ДНК-полимераза флуоресцентные зонды.
Таким образом, экспериментальным путем был установлен оптимальный состав реакционной смеси для амплификации специфического фрагмента ДНК методом иммуно-ПЦР в реальном времени (табл. 2).
Таблица 2
Состав реакционной смеси ПЦР
|
Компонент |
Конечная концентрация |
Количество компонента на 50 мкл смеси |
|
10X ПЦР-буфер |
1X |
2,5 мкл |
|
10мМ смесь дНТФ |
0,2 мМ каждого |
0,5 мкл |
|
Праймер 1 (50 мкМ) |
1 мкМ |
0,5 мкл |
|
Праймер 2 (50 мкМ) |
1 мкМ |
0,5 мкл |
|
Taq-ДНК-полимераза |
1,25 ед. |
0,25 мкл |
|
25 мМ МgCl2 |
1,5 мМ |
1 мкл |
|
ДНК-матрица |
0,1–1 мкг |
Варьируется от концентрации образца |
|
Деионизированная вода |
– |
До 25 мкл |
Исследования с использованием метода ПЦР были осуществлены в соответствии с требованиями нормативно-технической документацией относительно определения патогенных микроорганизмов в продуктах переработки крупного рогатого скота [1, 3].
Методика изготовления ПЦР-тест-системы, представленная на рис. 2, включает в себя следующие операции: анализ нуклеотидных последовательностей ДНК, кодирующих синтез гена PRNP прионного белка, включающий филогенетический и сравнительный анализ нуклеотидных последовательностей гена нормального и патогенного прионного белка крупного рогатого скота (для проведения данных анализов использовали базы данных NCBI и GenBank, компьютерную программу «ОligoСalc»); конструирование универсальных праймеров для амплификации гена PRNP патогенного прионного белка; подбор и синтез универсальных праймеров для амплификации гена PRNP патогенного прионного белка (с помощью компьютерных программ «NSBI Blast2» и «Primer3 Output»); оптимизация параметров реакции амплификации, разработка положительного контрольного и внутреннего контрольного образцов для оценки эффективности протекания ПЦР, обеспечения высокой чувствительности анализа и предотвращения ошибок персонала ПЦР-лаборатории.

Рис. 2. Методика изготовления ПЦР-тест-системы
Разработанная ПЦР-тест-система для анализа и идентификации патогенного прионного белка содержит все необходимые положительные и внутренние контрольные образцы и представлена в виде готовых пробирок с реакционной смесью, в которые только требуется внести образец исследуемой ДНК. Такая форма снижает вероятность ошибок оператора и риск контаминации реактивов при приготовлении смеси, повышает воспроизводимость результатов, а также уменьшает время и трудоемкость анализа.
ПЦР-тест-система разработана специально для прижизненной идентификации заболеваний животных в ветеринарии, контроля качества сырья животного происхождения для дальнейшего использования при производстве продуктов, используемых в пищевой промышленности. Данная ПЦР-тест-система позволяет произвести как качественный, так и количественный анализ содержания инфекционного прионного белка. Отличительными особенностями системы является быстрота выделения ДНК и наличие специально подобранных высокоспецифичных и уникальных праймеров.
Потенциальными потребителями ПЦР-тест-системы являются: ветеринарные лаборатории, занимающиеся идентификацией заболевания у животных, лаборатории, проводящие контроль качества сырья животного происхождения и оценку содержания патогенной формы прионного белка в продуктах питания, предприятия-производители кормов и кормовых добавок для сельскохозяйственных животных, ветеринарные клиники и другие организации, заинтересованные в приобретении неинфицированных кормов, кормовых добавок и сырья для их производства.
С целью определения условий хранения разработанной ПЦР-тест-системы, состоящей из набора реагентов для выделения ДНК, набора реагентов для амплификации ДНК и набора реагентов для проведения электрофореза, проверяли сохранение активности исходных тест-систем в реакции с контрольными образцами патогенного прионного белка, непосредственно после нанесения на планшет, через 1, 2, 3 и 4 месяца хранения.
Были проведены три серии экспериментов с разными условиями хранения готовых ПЦР-тест-систем:
1) температура хранения (4 ± 2) °С;
2) температура хранения (18 ± 2) °С;
3) температура хранения (22 ± 2) °С.
Для всех вариантов условий хранения выполнялось условие: ПЦР-тест-система должна храниться в сухом, защищенном от света месте. На основании проведенных исследований установили, что оптимальной температурой хранения ПЦР-тест-системы является температура (4 ± 2) °С, поскольку в этом случае через 4 месяца сохраняется 99,8 % активности. Наименее предпочтительной является температура хранения (22 ± 2) °С, в данном случае в конце исследуемого срока хранения (4 месяца) сохраняется 74,4 % активности тест-системы.
Для установления достоверных сроков пригодности невскрытой ПЦР-тест-системы были проведены исследования, где измеряемыми параметрами тест-системы были эффективность и чувствительность, в качестве варьируемого параметра выступала продолжительность хранения тест-системы (рис. 3).
Измерения проводили на протяжении четырех месяцев с интервалом, равным одной неделе, при условиях хранения тест-системы, выбранных на предыдущем этапе исследований – температура (4 ± 2) °С.
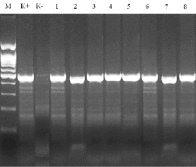
Рис. 3. Результаты исследования чувствительности ПЦР-тест-системы в зависимости от срока хранения: М – маркер, К+ – положительный контроль, К– – отрицательный контроль: 1 – срок хранения 2 недели; 2 – 4 недели; 3 – 6 недель; 4 – 8 недель; 5 – 10 недель; 6 – 12 недель; 7 – 14 недель; 8 – 16 недель
В число исследуемых образцов входили: 500 образцов, не содержащих патогенного прионного белка; 150 образцов с содержанием патогенного прионного белка 2,0–5,0 пг/мкл; 95 образцов с содержанием патогенного прионного белка 5,5–10,0 пг/мкл, 144 образца с содержанием патогенного прионного белка 10,5–12,0 пг/мкл.
Испытания эффективности и чувствительности разработанной ПЦР-тест-системы, проводимые на протяжении четырех месяцев, позволяют сделать вывод о том, что в пределах изучаемого периода тест-система сохраняет высокие значения показателей ее эффективной работы (процент положительных проб от общего числа исследованных составляет не ниже 96,6 %, чувствительность – 10 пг ДНК крупного рогатого скота в пробе ПЦР).
Заключение
Разработанная ПЦР-тест-система для идентификации патогенного прионного белка крупного рогатого скота отличается высокой чувствительностью, специфичностью и воспроизводимостью результатов, что исключает возможность получения ложных результатов в отличие от метода иммуноферментного анализа, где нередки ошибки в связи с перекрестно-реагирующими антигенами.
Работа выполнена в рамках Федеральной целевой программы «Исследования и разработки по приоритетным направлениям развития научно-технического комплекса России на 2007–2012 годы». Государственный контракт от 16 февраля 2011 г. № 16.512.11.2077.
Рецензенты:Просеков А.Ю., д.т.н., профессор, зав. кафедрой «Бионанотехнология», ФГБОУ ВПО «Кемеровский технологический институт пищевой промышленности», г. Кемерово;
Курбанова М.Г., д.т.н., профессор, зав. кафедрой «Технология хранения и переработки сельскохозяйственной продукции», ФГБОУ ВПО «Кемеровский государственный сельскохозяйственный институт», г. Кемерово.
Работа поступила в редакцию 17.10.2013.
Библиографическая ссылка
Драгунова Е.Е., Милентьева И.С., Кригер О.В., Новоселова М.В. ПЦР-ТЕСТ-СИСТЕМА ДЛЯ ИДЕНТИФИКАЦИИ ПАТОГЕННОГО ПРИОННОГО БЕЛКА: НЕОБХОДИМОСТЬ РАЗРАБОТКИ, МЕТОДИКА ИЗГОТОВЛЕНИЯ И ОСНОВНЫЕ ХАРАКТЕРИСТИКИ // Фундаментальные исследования. 2013. № 10-8. С. 1739-1744;URL: https://fundamental-research.ru/ru/article/view?id=32654 (дата обращения: 31.12.2025).



