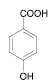
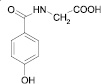
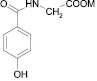
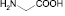Производные 2-гидроксибензойной (салициловой) кислоты демонстрируют различные виды фармакологической активности: жаропонижающую, седативную, противосудорожную и значительную желчегонную активность [1]. Эфиры 4-гидроксибензойной кислоты (парабены) применяются в промышленности в качестве консервантов, проксиметакаин (2-(диэтиламино)этиловый эфир 3-амино-4-пропоксибензойной кислоты) местноанестезирующее [4], нифуроксазид (гидразид [(5-нитро-2-фуранил)метилен]-4-гидроксибензойной кислоты) – антибактериальное средство – блокирует дегидрогеназы и угнетает дыхательные цепи, цикл трикарбоновых кислот и ряд других биохимических процессов в микробной клетке, разрушает микробную стенку или цитоплазматическую мембрану, снижает продукцию токсинов микроорганизмами [3]. Глицин (аминоуксусная кислота) как средство, повышающее умственную работоспособность и уменьшающее психоэмоциональное напряжение [3]. N-(4-гидроксибензоил)глицин и его производные являются потенциальными веществами, которые могут быть использованы для лечения раковых заболеваний и синтеза новейших инсектицидов. Производные N-(4-гидроксибензоил)глицина специфично связываются с ферментом РНМ (Peptidyl α-hydroxylating monooxygenase), который in vivo регулирует биосинтез α-амидированных белковых гормонов млекопитающих и насекомых [9]. Производные 4-гидроксигиппуровой кислоты демонстрируют значительную противовоспалительную активность [8] и снижает апоптоз гранулоцитов [10]. Таким образом, спектр активности производных оксибензойных кислот далеко не исчерпан. Целью работы является синтез новых производных оксибензойных кислот с широким спектром биологического действия в сочетании с низкой токсичностью и меньшим побочным эффектом.
Материалы и методы исследования
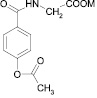
N-(4-гидроксибензоил)глицин был получен путем взаимодействия хлорангидрида 4-гидроксибензойной кислоты с глицином. В качестве основания, связывающего образующийся хлороводород, использовалась гидроокись натрия. Для определения оптимальных условий протекания реакций, обеспечивающих высокий выход амида, в работе использовались две методики получения амидов карбоновых кислот:
1) в водном растворе NaOH;
2) в водно-органическом растворителе (вода и N,N-диметилформамид (ДМФА) в соотношении 1:3) в присутствии NaOH (табл. 1). Как показано в табл. 1, более высокий выход целевого амида был в водной среде. Возможно, влияние растворителя на скорость реакции ацилирования связано со специфической сольватацией функциональных групп, участвующих в реакции, что приводит к образованию молекулярных комплексов и определяет их реакционную способность. N-(4-ацетоксибензоил)глицин получали ацилированием N-(4-гидроксибензоил)глицина по известной методике [7]. Структура полученных соединений была подтверждена данными ИК и ЯМР 1H спектроскопии.
Таблица 1
Выход N-(4-гидроксибензоил)глицина в зависимости от условий реакции
|
Исходная кислота |
Реагент |
Продукт |
Выход амида*, % |
|
|
|
|
78.0 (А) 61.2 (Б) |
Примечание. * условия: (А) NaOH, H2O; (Б) NaОН, H2O:ДМФА = 1:3.
Для получения водорастворимых биологически доступных форм N-(4-гидроксибензоил)глицина и N-(4-ацетоксибензоил)глицина, а также изучения влияния природы катиона на их фармакологическую активность были получены калиевая, натриевая и литиевая соли (табл. 2) путем взаимодействия исходного амида с этилатом или фенолятом натрия или калия и гидроксидом лития в среде бензола.
Таблица 2
Соли N-(4-гидроксибензоил)глицина и его ацилированного производного
|
Шифр |
Катион, M |
Выход, % |
|
|
|
IА |
K + |
89,0 |
|
IIA |
Li + |
95.2 |
|
|
IIIA |
Na + |
97.1 |
|
|
|
IB |
K + |
96,6 |
|
IIB |
Li + |
98,1 |
|
|
IIIB |
Na + |
98,2 |
В настоящей работе было проведено изучение спектра психотропной активности N-(4-гидроксибензоил)глицина и N-(4-ацетоксибензоил)глицина в виде водорастворимых солей с использованием следующих моделей фармакологического скрининга: «открытое поле»; приподнятый «плюс-лабиринт»; метод условной реакции пассивного избегания с отрицательным подкреплением (УРПИ) [1, 5]. Исследуемые соединения использовались в дозах 10 и 50 мг/кг, разведенных в изотоническом 0,9 % растворе NaCl при комнатной температуре. Вещества вводилось однократно за 60 минут до начала эксперимента. Результаты проведенных исследований подвергнуты статистической обработке, достоверность различий оценивали с помощью критерия Стьюдента с поправкой Бонферрони.
Метод изучения спонтанно-двигательной активности «открытое поле» позволяет изучить спонтанную двигательную активность, ориентировочно-исследовательское поведение и уровень эмоционального реагирования животных. В течение трех минут наблюдения за животным регистрировали следующие показатели: число пересеченных квадратов (горизонтальная активность), число вставаний на задние лапы и заглядываний в отверстия (ориентировочно-исследовательская активность), количество выходов в центральную зону, число актов груминга и количество фекальных болюсов (эмоциональный фактор).
Метод приподнятого «плюс»-лабиринта позволяет оценить анксиолитическое (транквилизирующее, антифобическое) действие психотропных средств. Лабиринт поднят над уровнем пола на высоту 70 см и представляет собой квадратную площадку (10×10 см) с четырьмя крестообразно расположенными рукавами длиной 50 см и шириной 10 см. Два рукава имеют непрозрачные ограждения высотой 40 см, два рукава открыты. Крысу помещали на центральную площадку лабиринта хвостом к экспериментатору. В течение двух минут наблюдения фиксировали число посещений открытых рукавов и время нахождения в них. Увеличение количества выходов в открытые рукава и времени пребывания в них по сравнению с таковыми показателями в контрольной группе оценивали как проявление анксиолитического (антифобического) действия вещества.
Для изучения ноотропной активности соединений была использована методика выработки условной реакции пассивного избегания (УРПИ). В работе использовали модификацию этой методики, специально разработанную для крыс. Выработку условной реакции избегания затемненного отсека производили в экспериментальной камере, которая состояла из двух смежных отсеков, большого освещенного (60×40 см) и малого затемненного (15×15 см), снабженного электродным полом. Крыса считалась обученной, если в течение 30 секунд после сеанса обучения она не заходила в темный отсек экспериментальной камеры. Тест на воспроизведение памятного следа осуществлялся через 24 часа после обучения. Животное помещали в светлый отсек камеры и в течение трех минут регистрировали три показателя: латентный период первого захода в темный отсек, количество заходов и общее время пребывания в темной камере. Ноотропный эффект исследуемого вещества выражался в увеличении латентного периода первого захода животного в темный отсек, уменьшении количества заходов в этот отсек и времени пребывания в нем по сравнению с животными контрольной группы.
Анальгетическая активность соединений оценивалась по изменению порога вокализации при постепенном увеличении напряжения переменного тока до возникновения электроболевого раздражения и вокализации. Установка представляет собой бокс, состоящий из электродного пола, ограниченного по периметру пластиковыми бортами. После помещения животного в установку подавались импульсы электрического тока с постепенным увеличением напряжения (скорость нарастания 5 В/с, длительность импульсов – 0,2 с). Порог переносимости электроболевого раздражения регистрировали при появлении вокализации у животного.
Острую суточную токсичность (ЛД50) при однократном введении изучали на мышах-самках массой 25–30 г. Исследуемое соединение в изотоническом растворе хлорида натрия вводили животным внутрибрюшинно в различных возрастающих дозах однократно. Наблюдение за животными проводили в течение суток, отмечая количество погибших животных. Расчет ЛД50 проводили по методу Литчфилда и Уилкоксона.
Результаты исследований и их обсуждение
Введение соединения IIА в дозе 10 мг/кг отмечена статистически достоверная тенденция к снижению тревожности животных – число актов груминга в тесте открытого поля снизилось на 73 %. Полученные данные в других тестах свидетельствуют о том, что IIA не оказывало статистически достоверного влияния на поведение животных и не оказывало какого-либо действия. Введение соединения IIB в дозе 10 мг/кг отмечена тенденция к снижению тревожности животных – число актов груминга в тесте открытого поля снизилось на 83 %. Антифобическое действие подтверждается статистически достоверным увеличением времени пребывания в открытых рукавах в 5 раз. Кроме того, это соединение проявило антиамнестический эффект: в дозе 10 мг/кг вызывало статистически достоверное увеличение латентного периода первого захода в темный отсек на 614 % и уменьшение общего времени пребывания в нем на 65 % в тесте УРПИ. После введения IIB в дозе 50 мг/кг соединение проявило общий психостимулирующий эффект, увеличивая вертикальную и горизонтальную активность, количество заглядываний в отверстия и число выходов в центральную зону, все данные статистически достоверны. Соединение IIB в дозе 50 мг/кг статистически достоверно повышали порог болевой чувствительности на 89 %, проявляя тем самым анальгетическое действие. Острая суточная токсичность соединения IIB, как проявившего наибольшую активность, составляет 3751,11 мг/кг. Соединение IIIB в дозах 10 и 50 мг/кг достоверно не влияло на поведение крыс в «открытом поле». Тем не менее отмечена тенденция к повышению исследовательской активности и снижению тревожности животных – увеличение выходов в центральную зону на 73 %. Однако эта активность не подтверждается в других тестах. Кроме того, IIIB в дозе 10 мг/кг вызывало статистически достоверное снижение порога электроболевой чувствительности. Следует отметить, что в дозе 50 мг/кг соединение IIIB вызывало однонаправленные изменения в тесте УРПИ – увеличивался латентный период первого захода в темный отсек на 238 % и уменьшалось общее время пребывания в нем на 79 %, что свидетельствует о тенденции к проявлению антиамнестических свойств. Остальные соединения не проявляли статистически достоверной психотропной активности ни в одном из тестов.
Сравнение IIB c отечественным лекарственным препаратом Мексидолом (этилметилгидроксипиридина сукцинат), проявляющим ноотропную, нейропротекторную, анксиолитическую и другие виды активности [2], показало, что терапевтический индекс соединения IIB, вычисляемый по соотношению ЛД50/ЭД50, более чем в 14 раз превышает терапевтический индекс Мексидола (табл. 3).
Таблица 3
Сравнительная характеристика IIB с Мексидолом
|
ЛД50, мг/кг |
Терапевтический индекс ЛД50/ЭД50 |
|
|
IIB |
3751,11 (3638,84–3866,85) |
375,1 |
|
Мексидол (внутрибрюшинно) [2] |
475 |
16,4 |
Примечание. *– данные статистически достоверны, критерий Стьюдента с поправкой Бонферрони, р < 0,05.
Заключение
Работа выполнена при финансовой поддержке научного гранта Администрации Волгоградской области (постановление № 77/3323 от 06.12.2012). Выражаем глубокую благодарность за содействие в исследовании биологической активности и токсичности веществ НИИ фармакологии Волгоградского государственного медицинского университета, в лице заведующего лабораторией психофармакологии, доктора медицинских наук Ковалёва Д.Г.
Выводы
1. В ходе изучения влияния условий на выход амидов оксибензойных кислот было выявлено, что в сильнощелочной водной среде выход целевых продуктов на 17 % выше, чем в водно-органическом растворителе в присутствии гидроксида натрия.
2. При исследовании психотропной активности синтезированных соединений выявлено, что производные N-(4-гидроксибензоил)глицина и калиевая соль N-(4-ацетоксибензоил)глицина практически не проявляли психотропной активности.
3. Острая суточная токсичность литиевой соли N-(4-ацетоксибензоил)глицина, проявившая значительную антифобическую, антиамнестическую и анальгетическую активности, при внутрибрюшинном введении составила более 1 г/кг и по классификации опасности (вредности) веществ они относятся к классу умеренно токсичных соединений [6].
4. При сравнении терапевтических индексов литиевой соли N-(4-ацетоксибензоил)глицина и Мексидола, можно заключить, что соединение обладает широким диапазоном терапевтического действия и низкой токсичностью
Рецензенты:Озеров А.А., д.х.н., профессор, зав. кафедрой фармацевтической и токсикологической химии Волгоградского государственного медицинского университета, г. Волгоград;
Навроцкий В.А., д.х.н., профессор, декан химико-технологического факультета, Волгоградского государственного технического университета, заслуженный химик РФ, г. Волгоград.
Работа поступила в редакцию 17.10.2013.
Библиографическая ссылка
Брель А.К., Лисина С.В., Будаева Ю.Н., Родина Н.В. СИНТЕЗ И ПСИХОТРОПНАЯ АКТИВНОСТЬ СОЛЕЙ N-(4-ГИДРОКСИБЕНЗОИЛ)ГЛИЦИНА И N-(4-АЦЕТОКСИБЕНЗОИЛ)ГЛИЦИНА // Фундаментальные исследования. 2013. № 10-9. С. 1963-1967;URL: https://fundamental-research.ru/ru/article/view?id=32568 (дата обращения: 15.12.2025).