В эпоху глобального загрязнения окружающей среды зольный состав растений рассматривается как один из существенных показателей качества, без которого невозможна оценка сырья для производства продуктов питания.
Средние уровни содержания большинства тяжелых металлов в семенах растений, произрастающих в Орловской области в условиях производственных посевов, в целом соответствуют общим закономерностям, установленным для переноса макро- и микроэлементов в звене «почва – растение», и отражают существующие различия в химических свойствах и биологической роли элементов, видовых особенностях растений. Однако отмечается превышение 0,51 уровня ДУ и наличие сопоставимых с порогом фитотоксичности пределов накопления никеля и свинца, которые определены приоритетными загрязнителями исследованных агроценозов [2]. Именно этот факт придает особую актуальность выявлению механизмов химического отклика растений на токсическое действие тяжелых металлов и поиску способов снижения содержания загрязнителей в хозяйственно полезных частях растений. В то же время в растительной продукции в исследуемом регионе наблюдается недостаток биогенного химического элемента кобальта, а недостаточное поступление какого-либо микроэлемента приводит к отклонению от нормы роста растения или к прекращению развития [5]. В целях диагностики недостатка поступления кобальта в растительную продукцию и своевременной ликвидации дефицита элемента с помощью микроудобрений может представлять интерес гистохимический метод идентификации ионов кобальта в семенах растений.
Известно, что важным механизмом концентрирования тяжелых металлов, содержащихся в клетках растений, является их хелатирование – образование комплексных соединений. Лигандами могут быть органические кислоты, аминокислоты, фитохелатины, глютатион, никотинамид и другие органические соединения. Органические хелаты нашли широкое применение при разработке приемов снижения доступности тяжелых металлов растениям [3, 6], выявлении механизма детоксикации [1], изучении распределения по анатомическим частям органов растений [4].
Несмотря на огромное разнообразие природных соединений, образующих комплексы с тяжелыми металлами, набор функциональных групп, образующих непосредственно координационные связи с Pb2+, Ni2+, Со2+ в природных объектах, не велик. Хорошо окрашенные устойчивые комплексы образуются при взаимодействии тяжелых металлов с формазанами – органическими соединениями, содержащими группировки R1N = N–C(R2) = N–NH–R3.
Целью представленного исследования является изучение возможности использования комплексонов хиназолил-формазанового ряда для идентификации ионов Pb2+, Ni2+, Со2+ в семенах растений. Объектом исследования были зерно пшеницы и семена гороха. Материал для исследования представлен комплексонами, синтезированными по основному методу синтеза формазанов – азосочетанием соответствующих 2-хиноксалилгидразонов с арилдиазонией хлоридами при низкой температуре (t = 0–+ 5 °С) в присутствии десятикратного объема соляной кислоты. Строение формазанов подтверждено сходством их УФ- и ИК-спектров и окислением в соли тетразолия с последующим восстановлением в исходные формазаны. Полученные соединения – стабильные кристаллические вещества с температурами плавления от 102 до 180 °С, с максимумом поглощения в видимой области от 400 до 480 нм. Очистка формазанов проводилась кристаллизацией и хромотографически.
Состав комплексов и область значений рН, в которой они устойчивы, зависят не только от природы металла, но и от состава и строения групп радикалов. Были синтезированы 4 вида данного комплексона с разными радикалами Х, которые представлены распространенными в биологических объектах функциональными группами: –Н, –СН3, –OCH3, –NO2.Формула синтезированного комплексона представлена на рис. 1.
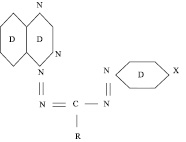
Рис. 1. Комплексон 1-(хиназолил-4’)-3-фенил-5(п-фенил)-формазан, где Х = H, CH3, OCH3 или NO2
В состав молекулы каждого формазана входит комплексообразующий центр – имин (NH) формазановой группировки. Наличие такого реакционного центра обусловливает способность выбранных формазанов к комплексообразованию с ионами тяжелых металлов. Комплексообразователи подобраны таким образом, что они содержат как доноры, так и акцепторы электронной плотности. Выбор заместителей (доноров – акцепторов) предпринят с целью избирательности комплексообразователей к ионам металлов (увеличение разрешающей способности для обнаружения тех или иных металлов).
Для проведения дальнейших исследований готовили растворы формазанов с концентрацией 1 ммоль/л растворением точных навесок формазанов в водно-спиртовом растворе (соотношение воды и спирта Н2О:С2Н5ОН = 1:4) непосредственно перед использованием. Все растворы имели окраску различных оттенков желтого цвета. Для выявления способности давать окрашенные комплексы и определения максимума спектра поглощения готовили стандартные растворы Pb2+, Cd2+, Ni2+ с концентрацией 1 ммоль/л. Спектрофотометрическое исследование оптической плотности комплексных соединений и свободных комплексонов проводили на приборе СФ-46 в прямоугольной кварцевой кювете К-10. Значения оптической плотности определяли в диапазоне 220–680 нм. Контроль рН осуществляли с использованием рН-150М. Для проведения гистохимических исследований проводилась обработка продольных срезов семян растений водно-спиртовым раствором формазанов и при помощи микроскопа Axioskop 2 MAT фирмы «Carl Zeiss» методом контрастирования в светлом поле по характерному окрашиванию тканей идентифицировали места локализации ионов изучаемых химических элементов. С помощью электронного сканирующего микроскопа JEOL JSM 6390 была рассмотрена микроструктура внутренней части наружных покровов зерна пшеницы и семени гороха на продольных срезах нативных и обработанных хиназолил-формазаном семян.
Для выявления максимумов поглощения синтезированных формазанов были сняты спектры поглощения. Раствором сравнения служил водно-спиртовой раствор Н2O:С2Н5ОН = 1:4), толщина поглощающего слоя L = 10 мм. Спектрофотометрическое исследование полученных растворов комплексных соединений ТМ с лигандами хиназолил-формазанов показали, что в видимой и УФ-области спектров поглощения происходит изменение положения максимума по сравнению со спектрами свободных комплексообразователей. Результаты по комплексообразованию вышеперечисленных металлов с выбранными комплексонами представлены в таблице.
Проведенные исследования показали, что в результате комплексообразования с Ni2+ в видимой области спектра наблюдается появление новых максимумов поглощения по сравнению со спектрами свободных лигандов на длинах волн 450, 510, 600 нм (радикал -H), 590 нм – с радикалом –CH3, 450, 580, 600 нм (с радикалом –OCH3), 490, 500, 625 нм – с радикалом –NO2.
При образовании комплексных соединений хиназолил-формазанов с солью Pb2+ происходит изменение спектров поглощения комплексов по сравнению со спектрами свободных лигандов. У комплекса с формазаном, имеющим радикал –Н, – это максимум в видимой области спектра при длинах волн 425, 435, 445, 460 и 495 нм. У комплекса с радикалом –CH3 – это максимумы при длинах волн 490, 575 нм. У комплекса с радикалом -NO2 – новые максимумы при длинах волн 490, 505, 520, 535, 620 нм. У комплекса с радикалом –OCH3 появляется новый максимум на длине волны 490 нм, максимумы свободного лиганда на длинах волн 345, 540, 565, 600 нм исчезают.
Изменения, наблюдаемые в видимой и УФ-областях спектров поглощения при комплексообразовании с Pb2+, Ni2+, Со2+
|
Комплексообразователь, имеющий радикал |
Положение максимума в спектре поглощения, нм |
|||
|
Свободный комплексон |
Комплекс с Pb2+ |
Комплекс с Ni2+ |
Комплекс с Со2+ |
|
|
–Н |
245, 295, 365 |
225, 240, 265, 355, 425, 435, 460,495 |
245, 280, .330, 385, 450, 510, 610 |
245, 275, 335, 375, 505 |
|
–CH3 |
270, 335, 345 |
240, 275, 335, 355, 490, 575 |
245, 275, 330, 375, 590 |
245, 275, 335,515 |
|
–OCH3 |
270, 335, 345, 410, 540, 565, 600 |
240, 275, 490 |
275, 335, 450, 580, 600 |
275, 335 |
|
–NO2 |
270, 335, 430, 450 |
240, 275, 335, 490, 505, 520, 535,620 |
270, 325, 335,625 |
270, 340, 490, |
Для кобальтовых хелатных соединений характерно сохранение λmax – 270 нм в случае с формазаном, имеющим радикал NO2 (небольшое смещение на 5 нм с комплексонами¸ имеющими радикалы –CH3 и –OCH3) и λmax = 335 нм со смещением вправо на 5 нм относительно спектра свободного лиганда. При этом исчезают в видимой области λmax = 410, 540, 565, 600 в случае с комплексоном, содержащим радикал –OCH3; λmax = 430, 450 нм – с ; с формазанами, имеющими радикалы NO2 и –CH3, наоборот, появляются новые в области 515 нм.
При смешивании растворов лигандов с растворами солей свинца, никеля и кобальта наблюдались видимые изменения окраски растворов. Комплексные соединения хиназолил-формазанов, содержащие в своем составе все 4 радикала с солью Ni2+, имели насыщенное синее окрашивание; с солью РЬ2+ – розовое окрашивание; с солью Со2+ наблюдалась окраска от светло-серого до темно-серого цвета.
Наибольшую интенсивность при одинаковых длинах волн имеют комплексные соединения исследуемых тяжелых металлов с хиназолил-формазаном, содержащим в качестве радикала –СН3.Окраска этих комплексов, наблюдаемая визуально, имеет более интенсивные по яркости оттенки.
Поэтому для дальнейших гистохимических исследований было отдано предпочтение комплексону 1-(хиназолил-4’)-3-фенил-5-(п-метилфенил) формазану, содержащему в качестве радикала –СН3.
Обработка зерна злаковых культур формазаном позволяет при гистохимическом исследовании зерновки обнаружить локализацию тяжелых металлов в ее периферических частях по характерному окрашиванию тканей.
Результаты микроскопических исследований, проводимые с использованием микроскопа Axioskop 2 MAT фирмы «Carl Zeiss» методом контрастирования в светлом поле представлены на рис. 2.
В результате микроскопических исследований обнаружено, что комплексы с никелем и кобальтом расположены главным образом в межклетниках, по которым осуществляется транспорт ионов. Комплексы со свинцом распределены в периферических слоях зерновки более равномерно, обнаруживаются в оболочках и клетках алейронового слоя. Это указывает как на сорбцию ионов структурными полисахаридами матрикса клеточных стенок, так и на локализацию их в вакуолях и других клеточных структурах.
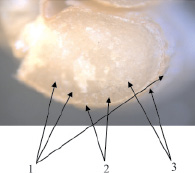

Рис. 2. Локализация тяжелых металлов в периферических частях зерновки пшеницы: 1 – синее окрашивание, характерное для комплексов с никелем; 2 – розовое окрашивание, характерное для комплексов со свинцом; 2 – серое окрашивание, характерное для комплексов с кобальтом
С помощью электронного сканирующего микроскопа JEOL JSM 6390, используя увеличение х2000, была рассмотрена микроструктура внутренней поверхности семенной оболочки зерновки пшеницы и семени гороха на продольных срезах нативного семени и обработанного хиназолил-формазаном (рис. 3).
1 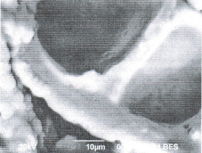 2
2 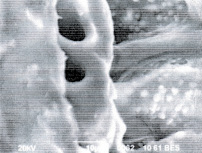
 4
4 
Рис. 3. Микроструктура внутренней поверхности семенной оболочки зерновки пшеницы: 1 – без обработки; 2 – обработанной комплексоном и семени гороха; 3 – без обработки; 4 – обработанного комплексоном
Изменения, происходящие в микроструктуре семян растений, визуально определяются на поверхности матрикса клеточных стенок в виде светящихся кристаллидных отложений величиной от 2 до 5 мкм, содержащих Pb2+, Ni2+, Со2+, определяемые с помощью рентгеноспектрального ЭДС детектора miniCup в системе электронного сканирующего микроскопа.
Выполненные исследования позволяют продемонстрировать локализацию Pb2+, Cd2+ и Ni2+ в периферических частях зерновки, что является одним из путей изучения проявления механизмов толерантности растений к металлическим загрязнениям. Выявленные свойства и закономерности позволят идентифицировать загрязнения тяжелыми металлами растительного сырья в процессе его переработки, обоснованно разрабатывать методы очистки растительной продукции от загрязнения тяжелыми металлами в пищевых технологиях, а также обнаружить недостаточное количество биогенных элементов в растительной продукции с целью корректировки обогащения ими рационов питания и кормления сельскохозяйственных животных.
Работа выполнена при поддержке РФФИ (грант 12-04-97586 р_центр_а).
Рецензенты:
Иванова Т.Н., д.т.н., профессор, зав. кафедрой «Технология и товароведение продуктов питания», Госуниверситет УНПК, г. Орел;
Осипова Г.А., д.т.н., доцент кафедры «Технология хлебопекарного, кондитерского и макаронного производства», Госуниверситет-УНПК, г. Орел.
Работа поступила в редакцию 23.09.2013.
Библиографическая ссылка
Кузнецова Е.А. ИСПОЛЬЗОВАНИЕ КОМПЛЕКСОНОВ ХИНАЗОЛИЛ-ФОРМАЗАНОВОГО РЯДА ДЛЯ ИДЕНТИФИКАЦИИ ИОНОВ Ni2+, Pb2+, Co2+ В СЕМЕНАХ РАСТЕНИЙ // Фундаментальные исследования. 2013. № 10-6. С. 1266-1270;URL: https://fundamental-research.ru/ru/article/view?id=32528 (дата обращения: 12.03.2026).



