Химическое загрязнение окружающей среды достигло невиданных за последние годы масштабов. Известно около 1000 поллютантов, оказывающих токсический эффект на репродуктивную систему [4]. Именно к таким относятся соли свинца, обладающие как прямым, так и опосредованным цитотоксическим действием [1]. Однако экспериментальных данных о влиянии солей свинца на семенные железы крайне мало, а имеющиеся данные носят противоречивый характер [2, 3, 6].
Целью нашего исследования явилось изучение морфофункциональных изменений и продуктивности семенных желез белых крыс-самцов при воздействии ацетата свинца.
Материалы и методы исследования
В качестве биологического тест-объекта в работе использовали белых беспородных половозрелых крыс-самцов массой 200–250 г. Всего использовано 50 животных.
В соответствии с поставленными задачами животные разбивались на две группы. Контрольную группу составили 20 самцов, содержащихся на общем режиме вивария. Опытную группу составили 30 самцов, получавших в течение 7 дней перорально ацетат свинца Pb(CH3COO)2∙3H2O в дозе 45 мг/кг/сутки.
Животные забивались путем декапитации под наркозом эфира с хлороформом (1:1) с соблюдением принципов гуманности, изложенных в директивах Европейского сообщества (86/609/ЕЕС) и Хельсинкской декларации, и в соответствии с требованиями правил проведения работ с использованием экспериментальных животных.
Материалом исследования служили семенники крыс-самцов. Для гистологического исследования образцы тканей семенных желез фиксировали в 10 %-м растворе нейтрального формалина. Зафиксированные образцы после промывки в проточной воде подвергали обезвоживанию путем помещения исследуемого материала в спирты возрастающей концентрации и заливали в парафин по общепринятой методике. Готовили гистологические поперечные срезы семенных желез толщиной 10–15 мкм, окрашивали их гематоксилин-эозином и исследовали с помощью цифрового микроскопа Axio Imager.M2 (ZEISS, Япония) с программным обеспечением для анализа изображений AxioVision SE64 Rel. 4.8.3 и ZEN 2011.
При обзорной микроскопии изучали морфологические особенности строения семенных желез, после чего определяли следующие морфометрические параметры:
1) толщину белочной оболочки семенника;
2) количество извитых семенных канальцев в одном поле зрения, площадь поперечного сечения извитого семенного канальца и его просвета, площадь сперматогенного эпителия и его толщину;
3) количество участков интерстиция между извитыми семенными канальцами в одном поле зрения, а также их площадь;
4) количество миоидных клеток в стенке извитого семенного канальца, площадь миоидных клеток и их ядер;
5) количество клеток Сертоли в сперматогенном эпителии извитого семенного канальца, ширину базальной и длину апикальной частей клеток Сертоли, площадь клеток и их ядер;
6) количество сперматогенных клеток (сперматогоний, сперматоцит и сперматид) в сперматогенном эпителии извитого семенного канальца, площадь сперматогенных клеток и их ядер, длину и толщину жгутика поздних сперматид;
7) количество сперматозоидов в просвете извитого семенного канальца, площадь головки и ядра, ширину шейки и длину хвостовой части;
8) количество клеток Лейдига в участке интерстиция; площадь клеток Лейдига и их ядер.
Морфометрические измерения производили при увеличении 10×10, 40×10 и 100×10. Фотосъемку препаратов производили при помощи цифровой камеры AxioCam MRc5 (ZEISS, Япония). Разрешение полученных изображений – 1300×1030 пикселей.
Индекс сперматогенеза рассчитывали по формуле: Is = Σa/N, где а – количество слоев, выделенных в каждом канальце (первый слой – сперматогонии, второй – сперматоциты, третий – сперматиды, четвертый – сперматозоиды); N – количество просчитанных канальцев.
Индекс релаксации (напряженность сперматогенеза) рассчитывали по отношению суммы всех сосчитанных половых клеток к сумме клеток Сертоли [5].
Влияние ацетата свинца на продуктивность семенных желез самцов белых крыс оценивали по следующим показателям:
1) общая концентрация сперматозоидов в эякуляте;
2) концентрация живых сперматозоидов в эякуляте;
3) концентрация мертвых сперматозоидов в эякуляте;
4) жизнеспособность сперматозоидов (% живых клеток от их общего количества).
Для определения вышеперечисленных показателей смесь суспензии сперматозоидов и физраствора (1:4) окрашивали трипановым синим на предметном стекле и исследовали с помощью автоматического счетчика клеток Countess™ (Invitrogen, США).
Живые клетки трипановый синий окрашивает по краям, мертвые – однородно по всей клетке.
Суспензию сперматозоидов получали из хвостовой части продольно вскрытого и освобожденного от жира придатка семенника.
Статистическая обработка цифровых данных проводилась с помощью программ FStat и Excel. Проверка статистических гипотез осуществлялась по t-критерию Стьюдента. При оценке статистических гипотез принимался уровень значимости p≤0,05. Математическая обработка результатов морфометрических исследований проводилась с использованием метода корреляционного анализа.
Результаты исследования и их обсуждение
Наружный осмотр семенников крыс-самцов показал, что они розовато-белого цвета, мягко-эластической консистенции, эллиптической формы.
При малом увеличении микроскопа заметна розовая полоса, идущая по краю препарата – это белочная оболочка, состоящая из плотной неоформленной соединительной ткани. Основную массу семенника образуют семенные извитые канальцы, разрезанные поперек или косо (тангенциально), округлой или эллипсовидной формы. Семенные канальцы отделены друг от друга тонкой оболочкой интерстициальной соединительной ткани, под которой находится толстая стенка сперматогенного эпителия на разных стадиях развития. Участки интерстиция между извитыми семенными канальцами расположены равномерно. Они преимущественно треугольной формы. В центре извитого канальца имеется просвет, куда выходят образованные спермии. Даже при слабом увеличении заметно, что в разных канальцах идут разные стадии сперматогенеза (рис. 1).
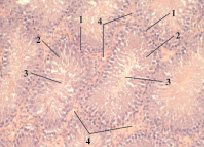
Рис. 1. Поперечный срез семенных желез (контроль). Окраска гематоксилин-эозин. Ув. 10×10: 1 – извитой семенной каналец; 2 – сперматогенный эпителий;3 – просвет канальца; 4 – интерстициальная ткань
При большом увеличении видно, что собственная оболочка канальца построена из волокон соединительной ткани. Внутри собственной оболочки, отделенной базальной мембраной, располагается сперматогенный эпителий, снаружи от базальной мембраны расположен футляр из рыхлой соединительной ткани, в которой находится слой миоидных клеток, имеющих чешуйчатую, полулунную и удлиненную форму. Миоидные клетки располагаются равномерно по всему контуру извитого семенного канальца.
Первый наружный слой сперматогенного эпителия составляют лежащие на базальной мембране сперматогонии с темным оптически плотным ядром и узким ободком цитоплазмы. Между сперматогониями видны клетки Сертоли, имеющие крупные бледно-розовые ядра. Основания клеток Сертоли лежат на базальной мембране между сперматогониями. Апикальная часть клетки обращена к просвету семенного канальца и имеет треугольную или пирамидальную форму.
Ближе к центру канальца располагаются сперматоциты. Это крупные клетки с большим ядром и широким ободком цитоплазмы. Они имеют округлую или овальную форму.
Самый внутренний слой извитого канальца составляют сперматиды, мелкие со светлым ядром клетки, лежащие в несколько рядов. Ранние сперматиды округлой формы со сферическим ядром, находятся в средних слоях сперматогенного эпителия. Поздние сперматиды лежат в слое, прилегающем к просвету канальца, имеют вытянутую форму. У некоторых поздних сперматид обнаруживается жгутик.
В некоторых канальцах видны сформированные сперматозоиды. Их темные вытянутые головки направлены на периферию канальца в сторону клеток Сертоли, а хвосты свисают в просвет канальца (рис. 2). Сперматозоиды располагаются группами в количестве 6–8 по всему контуру просвета. Головка сперматозоидов имеет форму крючка (рис. 3).
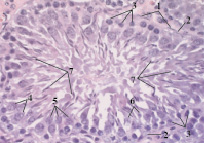
Рис. 2. Извитой семенной каналец (контроль). Окраска гематоксилин-эозин. Ув. 40×10: 1 – миоидные клетки; 2 – клетки Сертоли; 3 – сперматогонии; 4 – сперматоциты; 5 – ранние сперматиды; 6 – поздние сперматиды; 7 – сперматозоиды
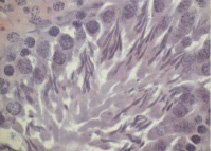
Рис. 3. Сперматозоиды в просвете извитого семенного канальца (контроль). Окраска гематоксилин-эозин. Ув. 100×10
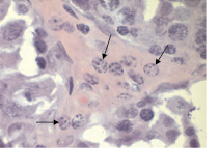
Рис. 4. Интерстициальная ткань семенных желез (контроль). Стрелкой показаны клетки Лейдига. Окраска гематоксилин-эозин. в. 100×10
В интерстициальной ткани семенных желез проходят кровеносные сосуды, вокруг которых залегают большим сферическим ядром одиночные или чаще группами по 5–7 клеток крупные овальной или многоугольной формы клетки Лейдига (рис. 4).
После 7 дней воздействия ацетата свинца выявлено, что белочная оболочка, окружающая семенники, имеет неоднородную толщину. Извитые семенные канальцы неправильной многогранной формы. Они располагаются свободно, не прилегают плотно друг к другу. Лишь изредка встречаются извитые семенные канальцы эллипсовидной формы. Между канальцами находятся прослойки интерстициальной соединительной ткани толщиной 12–17 мкм. Участки интерстиция между извитыми семенными канальцами располагаются неравномерно. Они треугольной и многогранной формы. В собственной оболочке канальцев отмечено разволокнение и дезорганизация базальных мембран. Граница между сперматогенным эпителием и просветом канальца плохо просматривается и имеет нечеткие контуры (рис. 5).
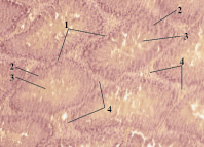
Рис. 5. Поперечный срез семенных желез (опыт). Окраска гематоксилин-эозин. Ув. 10×10: 1 – извитой семенной каналец; 2 – сперматогенный эпителий; 3 – просвет канальца; 4 – интерстициальная ткань
По сравнению с контролем происходит изменение формы миоидных клеток до полукруглой или овальной. Они располагаются по контуру извитого семенного канальца неравномерно, залегая группами или одиночно. Базальная часть клеток Сертоли значительно уменьшается в размерах и имеет более округлую форму. Апикальная часть клетки имеет более вытянутую форму. Сперматогонии по сравнению с контролем, имеют меньший размер. Сперматоциты приобретают овальную, реже сферическую форму. Ранние и поздние сперматиды практически не различаются между собой. Они преимущественно овальной формы. Их ядра смещаются в центр клетки (рис. 6).
После 7 дней воздействия ацетата свинца по сравнению с контролем отмечено беспорядочное расположение сперматозоидов в просвете канальца. Уменьшаются размеры и форма головки сперматозоида. На гистопрепаратах наблюдаются обрывы хвостов и агглютинация сперматозоидов (рис. 7). Обнаружены извитые семенные канальцы, в просвете которых отсутствовали сперматозоиды.
После 7 дней воздействия ацетата свинца клетки Лейдига в участке интерстиция располагаются преимущественно одиночно, лишь изредка встречаются небольшие группы по 2–3 клетки (рис. 8).
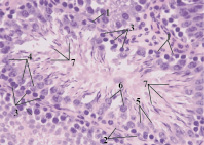
Рис. 6. Извитой семенной каналец (опыт). Окраска гематоксилин-эозин. Ув. 40×10: 1 – миоидные клетки; 2 – клетки Сертоли; 3 – сперматогонии; 4 – сперматоциты; 5 – ранние сперматиды; 6 – поздние сперматиды; 7 – сперматозоиды
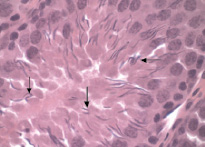
Рис. 7. Сперматозоиды в просвете извитого семенного канальца (опыт). Стрелкой показаны обрывы хвостов и агглютинация сперматозоидов. Окраска гематоксилин-эозин. Ув. 100×10
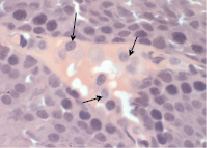
Рис. 8. Интерстициальная ткань семенных желез (опыт). Стрелкой показаны клетки Лейдига. Окраска гематоксилин-эозин. Ув. 100×10
Морфометрические исследования показали, что в опытной группе животных по сравнению с контролем происходит:
1) уменьшение толщины белочной оболочки семенника на 42,24 % (P ≤ 0,05);
2) уменьшение количества извитых семенных канальцев и участков интерстиция в одном поле зрения соответственно на 25,14 % (P ≤ 0,05) и 10,34 % (P ≤ 0,05);
3) увеличение площади поперечного сечения извитых семенных канальцев и их просвета соответственно на 13,72 % (P ≤ 0,001) и 58,01 % (P ≤ 0,001);
4) уменьшение площади сперматогенного эпителия и его толщины соответственно на 13,76 % (P ≤ 0,001) и 21,19 % (P ≤ 0,05);
5) уменьшение количества миоидных клеток в стенке извитого семенного канальца на 35,80 % (P ≤ 0,001), при этом площадь миоидных клеток и их ядер увеличивается соответственно на 44,26 % (P ≤ 0,001) и 22,45 % (P ≤ 0,001);
6) уменьшение количества клеток Сертоли в сперматогенном эпителии извитого семенного канальца на 22,48 % (P ≤ 0,001);
7) уменьшение площади и ширины базальной части клеток Сертоли соответственно на 19,81 % (P ≤ 0,001) и 7,39 % (P ≤ 0,05), увеличение высоты их апикальной части на 10,54 % (P ≤ 0,05);
8) уменьшение площади ядер клеток Сертоли на 36,35 % (P ≤ 0,001).
9) уменьшение количества сперматогониев в сперматогенном эпителии извитого семенного канальца, их площади и площади их ядер соответственно на 6,31 % (P ≤ 0,001), 29,77 % (P ≤ 0,001) и 33,33 % (P ≤ 0,001);
10) уменьшение количества сперматоцитов, их площади и площади их ядер соответственно на 8,43 % (P ≤ 0,001), 19,83 % (P ≤ 0,001) и 12,24 % (P ≤ 0,001);
11) уменьшение количества сперматид в сперматогенном эпителии извитого семенного канальца, их площади и площади их ядер соответственно на 17,36 % (P ≤ 0,001), 12,27 % (P ≤ 0,001) и 28,67 % (P ≤ 0,001);
12) увеличение длины жгутика поздних сперматид на 20,06 % (P ≤ 0,05) при одновременном уменьшении его толщины на 12,30 % (P ≤ 0,05);
13) уменьшение количества сперматозоидов в просвете извитого семенного канальца, площади головки сперматозоида и его ядра, а также ширины шейки соответственно на 26,70 % (P ≤ 0,001), 12,41 % (P ≤ 0,001), 25,97 % (P ≤ 0,001), 10,11 % (P ≤ 0,05). В то же время обнаружено увеличение длины его хвостовой части на 8,05 % (P ≤ 0,05);
14) увеличение площади интерстициальной ткани между извитыми семенными канальцами на 23,01 % (P ≤ 0,001);
15) уменьшение площади клеток Лейдига и их ядер соответственно на 61,13 % (P ≤ 0,001) и 69,68 % (P ≤ 0,001), а также их количества в участке интерстиция на 32,61 % (P ≤ 0,001) (табл. 1).
Таблица 1
Морфометрические показатели семенных желез белых крыс
|
№ п/п |
Показатель |
Контроль |
Опыт |
|
1 |
Толщина белочной оболочки семенника, мкм |
35,23 ± 3,42 |
20,35 ± 4,73* |
|
2 |
Количество извитых семенных канальцев в одном поле зрения |
34,68 ± 0,94 |
25,96 ± 0,69* |
|
3 |
Количество участков интерстиция между извитыми семенными канальцами в одном поле зрения |
42,56 ± 2,26 |
38,16 ± 1,77* |
|
4 |
Площадь поперечного сечения извитого семенного канальца, мкм2 |
45469,74 ± 1746,76 |
52701,15 ± 2703,18** |
|
5 |
Площадь просвета канальца, мкм2 |
8878,17 ± 832,41 |
21146,15 ± 1091,75** |
|
6 |
Площадь сперматогенного эпителия, мкм2 |
36591,57 ± 1243,36 |
31554,72 ± 2526,31** |
|
7 |
Толщина сперматогенного эпителия, мкм |
36,62 ± 2,34 |
28,86 ± 1,77* |
|
8 |
Количество миоидных клеток в стенке извитого семенного канальца |
19,44 ± 1,42 |
12,48 ± 1,49** |
|
9 |
Площадь миоидной клетки, мкм2 |
10,63 ± 2,55 |
19,07 ± 4,49** |
|
10 |
Площадь ядра миоидной клетки, мкм2 |
1,14 ± 0,30 |
1,47 ± 0,29* |
|
11 |
Количество клеток Сертоли в сперматогенном эпителии извитого семенного канальца |
23,84 ± 3,16 |
18,48 ± 2,52** |
|
12 |
Площадь клетки Сертоли, мкм2 |
189,73 ± 18,59 |
152,15 ± 13,96** |
|
13 |
Ширина базальной части клетки Сертоли, мкм |
13,39 ± 1,04 |
12,40 ± 1,38* |
|
14 |
Высота апикальной части клетки Сертоли, мкм |
15,78 ± 4,14 |
17,64 ± 2,96* |
|
15 |
Площадь ядра клетки Сертоли, мкм2 |
15,82 ± 0,73 |
10,07 ± 1,72** |
|
16 |
Количество сперматогониев в сперматогенном эпителии извитого семенного канальца |
52,44 ± 1,46 |
49,44 ± 1,30** |
|
17 |
Площадь сперматогония, мкм2 |
27,58 ± 2,07 |
19,37 ± 2,68** |
|
18 |
Площадь ядра сперматогония, мкм2 |
5,55 ± 1,52 |
3,70 ± 0,74** |
|
19 |
Количество сперматоцитов в сперматогенном эпителии извитого семенного канальца |
40,80 ± 1,97 |
37,36 ± 1,71** |
|
20 |
Площадь сперматоцита, мкм2 |
41,19 ± 5,86 |
33,02 ± 2,07** |
|
21 |
Площадь ядра сперматоцита, мкм2 |
3,35 ± 0,43 |
2,94 ± 0,34** |
|
22 |
Количество сперматид в сперматогенном эпителии извитого семенного канальца |
34,80 ± 1,52 |
28,76 ± 1,31** |
|
23 |
Площадь сперматиды, мкм2 |
32,69 ± 4,36 |
28,68 ± 4,26** |
|
24 |
Площадь ядра сперматиды, мкм2 |
2,93 ± 0,52 |
2,09 ± 0,43** |
|
25 |
Длина жгутика поздних сперматид, мкм |
10,08 ± 2,15 |
12,61 ± 3,02* |
|
26 |
Толщина жгутика поздних сперматид, мкм |
3,17 ± 0,75 |
2,78 ± 0,56* |
|
27 |
Количество сперматозоидов в просвете извитого семенного канальца |
304,52 ± 13,14 |
223,20 ± 31,02** |
|
28 |
Площадь головки сперматозоида, мкм2 |
17,48 ± 2,12 |
15,31 ± 0,82** |
|
29 |
Ширина шейки сперматозоида, мкм |
2,97 ± 0,23 |
2,67 ± 1,46* |
|
30 |
Длина хвостовой части сперматозоида, мкм |
20,11 ± 0,96 |
21,87 ± 1,05* |
|
31 |
Площадь ядра сперматозоида, мкм2 |
1,81 ± 0,56 |
1,34 ± 0,81** |
|
32 |
Площадь интерстициальной ткани, мкм2 |
1226,14 ± 103,75 |
1592,66 ± 138,96** |
|
33 |
Количество клеток Лейдига в участке интерстиция |
9,20 ± 1,20 |
6,20 ± 1,80** |
|
34 |
Площадь клетки Лейдига, мкм2 |
40,44 ± 1,30 |
15,72 ± 2,07** |
|
35 |
Площадь ядра клетки Лейдига, мкм2 |
10,82 ± 1,06 |
3,28 ± 1,33** |
Примечание: * – P ≤ 0,05 по сравнению с контрольными животными;
** – P ≤ 0,001 по сравнению с контрольными животными.
Отмечено снижение индекса сперматогенеза с 3,32 ± 0,15 до 2,98 ± 0,12, т.е. на 10,24 % (P ≤ 0,001), индекса релаксации (напряженности сперматогенеза) с 18,14 ± 1,72 до 17,33 ± 1,02, т.е. на 4,46 % (P ≤ 0,001), что свидетельствует о понижении функциональной активности семенных желез.
После проведенных исследований выявлено, что эякулят контрольной группы животных имеет густую консистенцию, мутного или молочно-белого цвета. После 7 дней воздействия ацетата свинца эякулят приобретает более прозрачный цвет и меньшую вязкость.
Проведенные исследования показали, что в опытной группе животных по сравнению с контролем происходит уменьшение общей концентрации сперматозоидов в эякуляте, концентрации живых сперматозоидов, а также их жизнеспособности соответственно на 50,63 % (P ≤ 0,001), 81,68 % (P ≤ 0,001) и 53,05 % (P ≤ 0,001). Одновременно с этим происходит увеличение концентрации мертвых сперматозоидов в эякуляте на 60,68 % (P ≤ 0,001) (табл. 2).
Таблица 2
Количественные и качественные показатели продуктивности семенных желез самцов белых крыс
|
№ п/п |
Показатель |
Контроль |
Опыт |
|
1 |
Общая концентрация сперматозоидов в эякуляте, ∙107/мл |
7,96 ± 0,45 |
3,93 ± 0,11** |
|
2 |
Концентрация живых сперматозоидов в эякуляте, ∙107/мл |
7,04 ± 0,12 |
1,29 ± 0,09** |
|
3 |
Концентрация мертвых сперматозоидов в эякуляте, ∙107/мл |
0,92 ± 0,07 |
2,34 ± 0,14** |
|
4 |
Жизнеспособность сперматозоидов, % |
88,62 ± 3,48 |
35,57 ± 2,75** |
Примечание: ** – P ≤ 0,001 по сравнению с контрольными животными.
Выводы
1. Ацетат свинца приводит к следующим морфологическим и морфометрическим изменениям семенных желез белых беспородных крыс-самцов:
а) уменьшению толщины белочной оболочки семенных желез;
б) увеличению площади поперечного сечения извитых семенных канальцев и площади интерстиция;
в уменьшению площади сперматогенного эпителия и его толщины;
г) уменьшению количества миоидных клеток в стенке извитого семенного канальца, увеличению площади клеток и их ядер;
д) снижению продукции всех популяций клеток сперматогенного эпителия, особенно его зрелых форм – сперматид;
е) уменьшению количества клеток Лейдига и клеток Сертоли, изменению их формы, уменьшению площади клеток и их ядер.
2. Под воздействием ацетата свинца происходит изменение формы головки сперматозоидов, уменьшается ее площадь и диаметр шейки, увеличивается длина хвостовой части.
3. При воздействии ацетата свинца отмечается снижение индекса сперматогенеза и индекса релаксации (напряженности сперматогенеза), что свидетельствует о понижении функциональной активности семенных желез.
4. Ацетат свинца приводит к уменьшению продуктивности семенных желез, что проявляется в уменьшении концентрации сперматозоидов в эякуляте, а также их жизнеспособности.
Работа проводилась при поддержке Минобрнауки РФ в рамках Программы стратегического развития «Педагогические кадры для инновационной России» (госзадание № 2 от 16.03. 2013 г.).
Рецензенты:
Кузьмичева Л.В., д.б.н., профессор кафедры биохимии, ФГБОУ ВПО «Мордовский государственный университет имени Н.П. Огарева», г. Саранск;
Федотова Г.Г., д.б.н., профессор кафедры теории и методики физической культуры и спорта, ФГБОУ ВПО «Мордовский государственный педагогический институт имени М.Е. Евсевьева», г. Саранск.
Работа поступила в редакцию 20.09.2013.
Библиографическая ссылка
Дуденкова Н.А., Шубина О.С. ИЗМЕНЕНИЯ МОРФОФУНКЦИОНАЛЬНОГО СОСТОЯНИЯ И ПРОДУКТИВНОСТИ СЕМЕННЫХ ЖЕЛЕЗ БЕЛЫХ КРЫС ПРИ ВОЗДЕЙСТВИИ АЦЕТАТА СВИНЦА // Фундаментальные исследования. 2013. № 10-6. С. 1253-1259;URL: https://fundamental-research.ru/ru/article/view?id=32526 (дата обращения: 12.03.2026).



