Несмотря на давнее признание ВОЗ, что гипертензия не является обязательной при глаукоме, поиск решения проблемы повышенного внутриглазного давления продолжается [1, 5, 9]. Потеря зрения вследствие глаукомы затрагивает примерно 3,4 миллиона человек только в США [15], и, по данным Минздрава, в 2011 году в Российской Федерации было диагностировано более 1,1 миллионов случаев глаукомы. Это на 40 % больше, чем всего два десятилетия назад. При этом есть основания полагать, что это лишь половина от реально имеющегося числа больных, которое, как ожидается, возрастет в предстоящие годы. Поиски методов генной терапии и способов трансплантации для лечения стволовыми клетками проблем глазной патологии стали основными терапевтическими инструментами для лечения слепоты, обусловленной глаукомой и дегенеративными заболеваниями сетчатки [6]. Несколько форм аутологичной трансплантации для лечения возрастной макулярной дегенерации (AMD), например, RPE65 заместительная генная терапия у больных с Лебер синдромом пигментных эпителиальных клеток радужки, дали обнадеживающие результаты, как и некоторые другие методы генной терапии с использованием человеческих эмбриональных стволовых клеток (ES) в лечении Stargardt’s болезни [13]. Но полученные данные на животных вряд ли возможно экстраполировать на человека. Установленные нами факты убеждают в том, что имеющиеся на сегодняшний день представления по онтогенезу глаза являются не только недостаточными, но иногда абсолютно неправильными, и заменой только одних генов в геноме клеток структур глаза проблемы не решить [6, 10, 14]. Очень важно знать, в каких условиях и при воздействии каких тонких механизмов, кроме уже известных, происходит экспрессия и репрессия генов, как и какая взаимная индукция заставляет клетки мигрировать для образования новых структур глаза. Установленный ранее факт миграции глии в направлении всех прозрачных сред глаза доказывает, что одной из причин врождённой глаукомы (например, при синдроме Петерса) является отсутствие перемещения нейроглиального дифферона клеток, который является важной составляющей роговицы, хрусталика, стекловидного тела, дифференцируется в беспигментный эпителий цилиарного тела и задний эпителий роговицы [14]. При синдроме Петерса следствием нарушения миграции нейроглиоцитов являются не только бельмо роговицы, катаракта хрусталика, но и отсутствие полноценного расщепления оболочек глаза, ведущее к врождённой глаукоме. Физиологическая и репаративная регенерация в своей основе имеют те же самые механизмы, что и репаративная. Установленный нами ранее факт участия эффекторных клеток иммунофагоцитарного звена в процессах обособления оболочек глаза позволяет предпринять попытку изучить, какие фенотипы иммуноцитов присутствуют на этапе формирования цилиарного тела глаза человека и влияют на механизмы взаимной индукции представителей клеточных дифферонов различных структур глаза, геном которых изменяется под влиянием контактных взаимодействий [6, 14].
В настоящее время одной из малоизученных структур глаза человека является цилиарное тело [2, 3]. В доступной литературе имеются противоречивые данные по поводу функций цилиарного тела глаза человека [5]. Одни авторы утверждают о наличии у беспигментного цилиарного эпителия только секреторной функции, другие указывают на морфологические данные, подтверждающие, что для гистофизиологии цилиарного тела характерна функция всасывательная [11, 12]. Решение этого вопроса особенно важно в связи с тем, что один из важнейших факторов, влияющих на становление ВГД у новорождённого ребёнка – состояние цилиарного тела [4]. Особенности реакции и разрушения эпителия в условиях глаукоматозного процесса свидетельствуют об актуальности исследований, ведущихся в направлении изучения структуры и особенностей развития цилиарного тела глаза человека [8]. Имеются данные, которые указывают на то, что начальным звеном в развитии глаукомы является нарастающая дезорганизация, деструкция соединительной ткани как переднего, так и заднего отрезков глаза. О вероятности аутоиммунного характера этих изменений свидетельствуют результаты многочисленных исследований, выявивших в сыворотке крови и в жидкостях глаза больных глаукомой высокий уровень аутоантител к гликозаминогликанам, к структурам угла передней камеры, к денатурированной форме ДНК [11, 15]. В осуществлении иммунного надзора и поддержании гомеостаза в передней камере глаза могут принимать участие стромальные меланоциты хориоидеи, радужки и цилиарного тела [1]. Например, для всех стадий глаукомы была характерна депигментация и атрофия стромы радужки, наблюдалось накопление свободных гранул меланина в дренажной зоне угла передней камеры. С другой стороны, установлено, что эффективное лечение глаукомы аналогами простагландина сопровождается гиперпигментацией радужной оболочки [7].
Многочисленные концепции порождают множество нерешённых вопросов. Одним из них является вопрос участия в процессах расщепления и обособления структур глаза человека эффекторных клеток иммунофагоцитарного звена. Решение этой проблемы является важнейшим на пути решения механизмов развития врождённой глаукомы у человека.
Целью нашей работы послужило установление закономерностей развития цилиарного тела глаза в онтогенезе человека и выявление CD68 и CD163 – позитивных иммуноцитов в динамике процесса развития органа зрения.
В работе использован материал глаза человек в возрасте от 5 недель эмбрионального периода развития до 87 лет постнатального онтогенеза, полученный при медицинских абортах, судебно-медицинских вскрытиях людей, погибших от травм; а также материал, полученный при оперативных вмешательствах по поводу посттравматической энуклеации глаз. Распределение материала проводили согласно возрастной периодизации, принятой на Конгрессе по геронтологии в 1965 г. в г. Москве, представлено в таблице.
Распределение материала по возрастным группам
|
№ |
|||||||||||
|
Количество |
I |
II |
III |
IV |
V |
VI |
VII |
VIII |
X |
XII |
XIII |
|
53 |
59 |
3 |
5 |
7 |
3 |
5 |
3 |
3 |
3 |
4 |
|
|
Итого |
148 |
Для выявления клеток по дифферону СКК, участвующих в обособлении цилиарного тела глаза человека и формировании передней и задней камер глаза человека, использованы гистологические (окрашивание гематоксилином-эозином по классической прописи) и иммуногистохимические методы исследования с использованием маркёров на выявление CD68 и CD163 [14]. Идентификация иммунокомпетентных клеток проводилась по одинаковой схеме, несмотря на различную локализацию антигена в клеточных структурах: мембраны, лизосомы, комплекс Гольджи. С целью определения фенотипа иммунокомпетентных клеток методом иммунной гистохимиибиоптаты фиксировали в 10 %-м формалине на фосфатном буфере с рН 6,8–7,2 в течение 24-х часов, затем промывали в воде в течение 2-х часов и обезвоживали в спиртах возрастающей концентрации в течение 1 часа в каждой порции. В спирте 96° выдерживали в течение 1, 2, 4-х часов, а затем помещали в абсолютный спирт 5 раз по 30 минут, потом оставляли в последней порции на всю ночь. После этого материал помещали в смесь абсолютного спирта и ксилола в соотношении 1:1 на 30 минут, а затем в сменах ксилола в термостате при 37 °С по 30 минут в каждой. После этого использовали смесь ксилола с парафином (1:1) при 56 °С по 20 минут в 2-х порциях, а затем в двух порциях парафина при 56 °С (по 1 часу в каждой порции), после чего проводили заливку. Парафиновые блоки выдерживали в течение суток в термостате при 37 °С, после чего производили срезы. Срезы и вся дальнейшая обработка материала (депарафинирование и обезвоживание) выполнялась на автоматизированной аппаратуре лаборатории патоморфологии Медицинского университета Ниигата (Япония). С помощью моноклональных антител (клон КР1, код № М 0814, лот 119) выявляли макрофаги по маркёру CD68 (высокогликозилированный трансмембранный гликопротеин, который локализуется в лизосомах). Молекулярный клон CD68 показал, что семейство лизосомальных гликопротеинов с плазматическими мембранными белками играют роль в лизосомальном трафике и эндоцитозе, включая лизосомальные ассоциации мембранных протеинов 1 и 2 (LAMP-1 и LAMP-2). Для маркировки CD163 использовали клон 10 D6, класс иммуноглобулинов G1; CD204 -мышиные моноклональные антитела, клон SRA-E5, класс иммуноглобулинов G1. Демаскировка антигенных детерминант проводилась в стеклянном контейнере, заполненном восстанавливающим раствором, с созданием водяной бани в течение одного часа. Часть препаратов была обработана в течение 30 минут с помощью микроволнового излучения, которое даёт лучший демаскировочный эффект. Для демаскировки антигенов использовали 10 ммоль/л цитратный буфер с рН 6,0 или DAKO TRS (Targetretrievalsolution, code № S1700). Остывшие препараты промывали в дистиллированной воде. Антитела применяли в разведении 1:50 и 1:100. Анализ материала проведён с помощью микроскопа Olympus – Bx82 и цифровой камеры CDх82.
Нами установлено, что отростки цилиарного тела появляются на 4-м месяце развития. Они небольшие, короткие, располагаются на границе с задней поверхностью радужки (рис. 1, а). У плодов в возрасте пяти месяцев внутриутробной жизни в цилиарном теле появляются первые единичные пучки меридиональных мышечных волокон(рис. 1, б). У семимесячного плода цилиарные отростки находятся всё ещё на задней поверхности радужной оболочки, но их размер и количество увеличивается (рис. 1, в, г).
К 8 месяцу плодного периода ресничное тело выражено хорошо, видны меридиональные и круговые мышцы, имеются кровеносные сосуды. На препаратах можно идентифицировать зрелые, хотя малочисленные и широкие, цилиарные отростки с хорошо развитой капиллярной сетью, двумя слоями клеток эпителия. Таким образом, можно предположить, что структуры, ответственные за секрецию и избирательную фильтрацию внутриглазной жидкости, к этому сроку уже начинают функционировать. Нами установлено, что в обособлении цилиарного тела от других структур глаза участвуют иммуноциты СD68 и СD163 (рис. 2, а, б). Это может быть свидетельством того, что нарушение в системе эффекторных иммуноцитов может привести к дисгенезу в зоне формирования не только переднего отрезка глаза, но и в структурах системы оттока внутриглазной жидкости, что приведёт к развитию врождённой глаукомы. Установленный ранее факт миграции нейроглиальных клеток из внутреннего листка глазного бокала в структуры переднего отрезка глаза также согласуется с полученными данными о сроках обособления структур цилиарного тела от хрусталика только после завершения миграции [14].
а 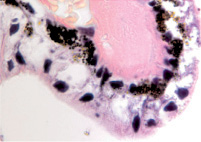 б
б 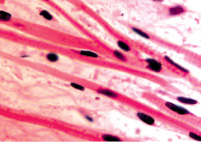
в 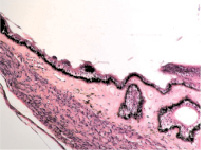 г
г 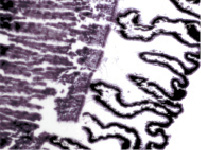
Рис. 1. Глаз плода человека. Развивающееся цилиарное тело: а – 4 месяц плодного периода; б – 5 месяц; в, г – цилиарное тело глаза плода человека 7 месяцев. Окраска гематоксилин-эозином. Микрофото. Ув.х а, б – х800; в, г – х400
а  б
б 
Рис. 2. Цилиарное тело глаза плода человека 14 недель. Иммунная гистохимия на выявление CD68 (a) CD163 (б).Микрофото. Ув. а х400; б х600
В результате активности макрофагов происходит постепенное обособление цилиарного тела от капсулы хрусталика (рис. 3, а-д).
а 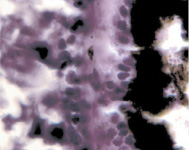 б
б 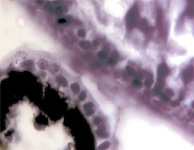 в
в 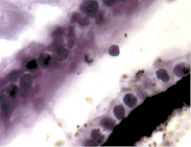
г  д
д 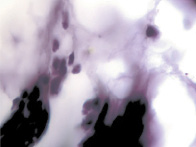
Рис. 3. Цилиарное тело глаза плода человека: а – 10 недель; б – 12 недель; в – 14 недель; г, д – 15 недель. Окраска гматоксилином-эозином. Микрофото. Ув. а, б, в – х800; г, д – х400
В пренатальный период установлены следующие этапы формирования цилиарного тела: закладка стромы цилиарного тела, обособление от тела, функциональное созревание сосудов, созревание склеры, ангиогенез в цилиарном теле мышечного аппарата. По нашим данным, беспигментные эпителиальные клетки обладают как секреторной, так и всасывательной активностью, поэтому играют одну из ключевых ролей в патогенезе глаукомы. Нами отмечено, что в структурах цилиарного тела глаза человека беспигментный эпителий разрушен, угол передней камеры глаза, выстланный в глазах человека без глаукомной патологии плоским эндотелием, в глазах больных глаукомой метаплазирован и частично слущен (рис. 4, а). На препаратах стромы отростков цилиарного тела идентифицируются в основном СD163 эффекторные иммуноциты (рис. 4, б, в). Это свидетельствует о роли эффекторных иммуноцитов в патогенезе глаукомы и дисгенезе структур переднего полюса глаза, включая эпителий цилиарных отростков.
Гибель пигментного эпителия следует за повреждением беспигментного эпителия, который подвергается метаплазии (рис. 4, г) и слущивается на поверхность эпителиальной пластинки (рис. 4, д). Наличие пула макрофагов свидетельствует об их участии в патологическом процессе в структурах глаза.
а 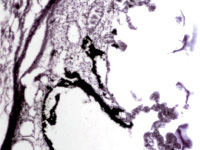 б
б 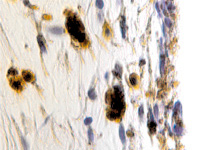 в
в 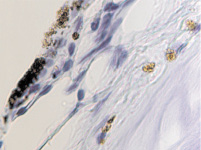
г 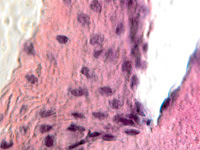 д
д 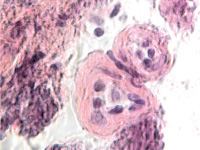
Рис. 4. Разрушение беспигментного эпителия в структуре цилиарных отростков больного глаукомой 56 лет: а – окраска гематоксилин-эозином; б, в – иммунная гистохимия на идентификацию CD163. Микрофото. Ув. а – х100; б, в, д – х400; г – х 600
Заключение
При процессе расщепления оболочек развивающегося глаза плода человека, при формировании отростков цилиарного тела, а также на границе обособления цилиарного эпителия от капсулы хрусталика идентифицируются эффекторные иммуноцитыCD68 и CD163, отвечающие за антигенпрезентацию и фагоцитоз отмирающих или дефективных клеток. Учитывая особенности сроков идентификации иммуноцитов, соответствующих времени образования цилиарных отростков, мы предполагаем, что миграция нейроглии, участвующей в формировании структур сосудистой оболочки глаза, индуцируется эффекторными иммуноцитами, как и последующее после их миграции расщепление оболочек глаза в самостоятельные структуры. Мы предполагаем, что нарушение в системе контроля эффекторными иммуноцитами за развитием структур глаза лежит в основе как врождённой глаукомы, так и приобретённой. Гипотетически дисплазии структур глаза, а также врождённая глаукома, связанная с дисгенезом и нарушением развития передней камеры глаза, возможно, включая патологию дренажной зоны при аномалии Петерса, могут быть причиной нарушения взаимодействия в системе взаимодействия эффекторных иммуноцитов.
Выводы
Иммуноциты индуцируют не только процессы миграции нейроглиоцитов из внутренней стенки глазного бокала в формирующиеся прозрачные среды глаза, но и осуществляют контроль за расщеплением и обособлением оболочек глаза. Этот процесс начинается только после выселения нейроглиоцитов в соответствующие структуры.
Рецензенты:
Храмова И.А., д.м.н., профессор, врач акушер-гинеколог, Приморский краевой диагностический центр, г. Владивосток;
Шульгина Л.В., д.б.н., профессор, заведующая лабораторией микробиологии, ФГУП «ТИНРО-Центр», г. Владивосток.
Работа поступила в редакцию 16.09.2013.
Библиографическая ссылка
Новиков А.С., Рева И.В., Рева Г.В., Ямамото Т., Абдуллин Е.А., Альбрандт К.Ф., Рева И.В., Ямамото Т., Абдуллин Е.А., Альбрандт К.Ф. РОЛЬ ИММУНОЦИТОВ В ФИЗИОЛОГИЧЕСКОЙ РЕГЕНЕРАЦИИ ЦИЛИАРНОГО ТЕЛА ГЛАЗА ЧЕЛОВЕКА // Фундаментальные исследования. 2013. № 9-4. С. 708-714;URL: https://fundamental-research.ru/ru/article/view?id=32501 (дата обращения: 15.02.2026).



