Острое повреждение почек (ОПП) является частым осложнением у больных с острым коронарным синдромом (ОКС). Развитие ОПП у больных ОКС связывают с изменением системной и почечной гемодинамики, воздействием рентген-контрастных препаратов и другими факторами [12]. ОПП увеличивает риск развития осложнений, продолжительность госпитализации и повышает внутригоспитальную летальность [6].
Современные рекомендации по диагностике ОПП основаны на оценке динамики уровня креатинина сыворотки крови и диуреза [8]. Недостатком метода является невозможность раннего выявления ОПП. В последние годы широко обсуждается роль биомаркеров повреждения почек. Концентрация липокалина, ассоциированного с желатиназой нейтрофилов (NGAL), повышается в моче при ОПП раньше, чем других биомаркеров. Единого мнения о роли NGAL в диагностике ОПП нет, противоречивость результатов, возможно, связана с использованием различных критериев диагностики ОПП [14], неоднородностью групп пациентов, разным временем забора материала, типом контрастного вещества при рентген-контрастных исследованиях. Важность ранней диагностики ОПП не вызывает сомнения, поскольку открывает возможности для своевременного лечения [8].
Цель исследования – оценка возможностей NGAL в прогнозировании острого повреждения почек у больных с ОКС.
Материалы и методы исследования
Обследовано 122 больных ОКС. Характеристика больных представлена в таблице. В исследование были включены только те пациенты, которым не выполнялась коронарография, что позволяло исключить развитие контраст-индуцированного ОПП.
Диагностику ОКС осуществляли согласно Рекомендациями ВНОК [1]. ОПП диагностировали и классифицировали согласно Рекомендациями KDIGO (2012) [8]. Мы не располагали информацией о креатинине сыворотки до заболевания, поэтому диагностику ОПП по креатинину проводили двумя способами: в первом случае за исходный принимали расчетный креатинин (базальный), соответствующий скорости клубочковой фильтрации (СКФ) 75 мл/мин/1,73 м2 [8], с последующей оценкой относительно креатинина сыворотки при поступлении, во втором – исходным считали уровень креатинина сыворотки в момент госпитализации, с последующей оценкой в динамике через 48 ч.
Характеристика больных острым коронарным синдромом
|
Показатель |
Значение |
|
Мужчины, чел. (%) Женщины, чел. (%) |
69 (57 %) 53 (43 %) |
|
Возраст, лет |
64 ± 11 |
|
Диагноз: ОИМпST, чел. (%) ОИМбпST, чел. (%) Нестабильная стенокардия, чел. (%) |
18 (15 %) 31 (25 %) 73 (60 %) |
|
Длительность анамнеза ИБС, лет |
7,9 ± 3,77 |
|
Инфаркт миокарда в анамнезе, чел. (%) |
43 (35 %) |
|
Артериальная гипертензия в анамнезе, чел. (%) |
109 (89 %) |
|
Длительность артериальной гипертензии, лет |
15 (ИКР: 5–15) |
|
Тяжесть ОСН по Killip T. I стадия, чел. (%) II стадия, чел. (%) III стадия, чел. (%) IV стадия, чел. (%) |
46 (38 %) 68 (56 %) 8 (6 %) - |
|
Индекс Grace: риск смерти в период госпитализации, % риск смерти в течение 6 месяцев, % |
2 (ИКР: 1–5) 5 (ИКР: 3–13) |
|
Креатинин сыворотки в момент госпитализации, мкмоль/л Скорость клубочковой фильтрации, мл/мин/1,73 м2 |
92,1 (ИКР: 79,0–106,3) 58,4 ± 20,22 |
|
Липокалин, ассоциированный с желатиназой нейтрофилов (NGAL), нг/мл |
4,3 (ИКР: 2,0–18,2) |
У всех больных при поступлении в стационар определяли концентрацию NGAL в моче иммуноферментным методом (Human Lipocalin-2/NGAL ELISA BioVendor Laboratory Medicine, Inc).
Статистическая обработка данных проводилась Statistica 6.0. Достоверность различий несвязанных переменных определяли по t-критерию Стьюдента, при нормальном распределении параметров, если распределение отличалось от нормального, использовали Mann‒Whitney U test. Для сравнения зависимых групп использовали критерий Вилкоксона. Проводился однофакторный корреляционный анализ (в зависимости от вида распределения – Pearson или Kendall tau). Для сравнения двух групп по качественному признаку использовали c2 Пирсона. Для прогнозирования вероятности развития события использовали ROC-анализ. В случае приближенно нормального распределения данные представлены в виде M ± SD, где M – среднее арифметическое, SD – стандартное отклонение. В противном случае данные представлены в виде Me (ИКР), где Me – медиана, ИКР – интерквартильный размах: 25 процентиль – 75 процентиль. Различие считали достоверным при р < 0,05.
Результаты исследования и их обсуждение
Время от появления клинической картины заболевания до момента госпитализации составило 4,5 (ИКР: 2,3–9,3) часа. Только у 8 (7 %) пациентов тяжесть ОСН соответствовала III стадии по Killip. Концентрация креатинина в сыворотке крови при поступлении составила 92,1 (ИКР: 79,0–106,3) мкмоль/л, на 3 сутки – 97,0 (ИКР: 87,0–116,0) мкмоль/л (p = 0,0001). Частота ОПП у больных ОКС представлена на рис. 1.
Из 28 пациентов с ОПП по расчетному креатинину только у 12 (43 %) в последующем диагностировано ОПП по динамике креатинина. Вероятно, остальные 16 (57 %) больных во время госпитализации имели не ОПП, а хроническую болезнь почек (ХБП), но для верификации ХБП требуется наблюдение не менее 3 месяцев. На рис. 2 показана тяжесть ОПП у больных ОКС. Группы больных с ОПП и без ОПП не различались по возрасту при диагностике по динамике креатинина (67,6 ± 11,84 и 63,3 ± 10,00 лет, соотв., p = 0,09). В то же время больные с ОПП по расчетному креатинину были старше (69,8 ± 8,99 и 61,9 ± 10,21 лет, соотв., p = 0,0006).
Концентрация NGAL в моче составила 4,3 (ИКР: 2,0–18,2) нг/мл. Если ОПП диагностировали по динамике креатинина, то достоверных различий в уровне NGAL в моче у больных с ОПП и без ОПП не отмечалось (14,4 (ИКР: 2,3–43,0) нг/мл и 4,4 (ИКР: 2,0–14,0) нг/мл, p = 0,095). У больных с ОПП, диагностированным по базальному креатинину, уровень NGAL был достоверно выше, чем у пациентов без ОПП (13,8 (ИКР: 4,5–44,6) нг/мл и 3,2 (ИКР: 1,9–13,9) нг/мл, p = 0,0004).
Все больные, у которых NGAL мочи при поступлении в стационар превышал 134 нг/мл, а их было 4 (3 %), на 3 сутки имели ОПП по динамике креатинина. Установлено, что уровень NGAL мочи более 82 нг/мл прогнозировал развитие ОПП у больных ОКС с чувствительностью 20 % и специфичностью 99 % (AUC = 0,61).
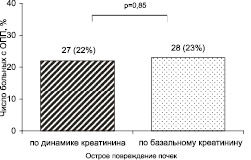
Рис. 1. Частота острого повреждения почек у больных с острым коронарным синдромом
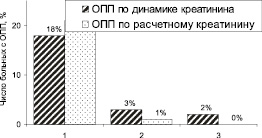
Рис. 2. Тяжесть острого повреждения почек
В 2012 году опубликованы Рекомендации KDIGO по диагностике и лечению ОПП (KDIGO Clinical Practice Guidelines for Acute Kidney Injury), предложено понятие «острая болезнь почек», в рамках которой рассматривается ОПП [8]. Рекомендации предполагают оценку функции почек по креатинину сыворотки, и (или) по диурезу [8].
Мы не использовали почасовой диурез как показатель функции почек, так как не было показаний для катетеризации мочевого пузыря, при самостоятельном мочеиспускании больного оценить почасовой диурез затруднительно, а у многих больных и невозможно.
В большинстве исследований по изучению ОПП у пациентов с ОКС диагностика по диурезу также не осуществлялась. Это связано с необходимостью катетеризации мочевого пузыря для почасового учета объема мочи. Между тем данная процедура является инвазивной и в связи с высокой частотой мочевой инфекции [4] имеет строгие показания, которые у большинства больных ОКС отсутствуют. До 70 % пациентов с острым коронарным синдромом требуется введение диуретиков, при этом мочегонные препараты, увеличивая объем мочи, не улучшают прогноз ОПП [11], но могут искажать результат диагностики по диурезу. Точность измерения количества выделяемой мочи может страдать в случае нарушения проходимости мочевых катетеров [4]. Более того, при учете почасового диуреза минимальное время для диагностики ОПП составляет 6 часов [8].
Диагностика ОПП по креатинину основывается на сравнении его уровня с исходным, т.е. уровнем, известным на протяжении последних 7 дней до события [8]. У значительного числа больных с ОКС данные о креатинине за предшествующий период отсутствуют. В этом случае за исходный может приниматься расчетный креатинин, который определяется исходя из СКФ, равной 75 мл/мин/1,73 м2 [8]. К сожалению, в этом случае не представляется возможным исключить наличие у больного ХБП. Так, по нашим данным, при использовании в качестве исходного расчетного креатинина ОПП диагностировано у 28 (23 %) пациентов, однако только у 12 (43 %) из них ОПП верифицировано по динамике креатинина.
Для диагностики ОПП обычно в качестве исходного используется креатинин сыворотки крови при поступлении больного, с последующей оценкой его динамики. Недостатком такого подхода является невозможность ранней диагностики ОПП, т.к. необходимо не менее 1–2 суток, чтобы проследить изменение уровня креатинина [8]. Таким образом, основные проблемы диагностики ОПП у больных ОКС связаны с трудностями в разграничении ОПП и ХБП и невозможностью постановки диагноза в ранние сроки [15].
В последние годы идет поиск биологических маркеров, которые бы позволили раньше и надежней, чем традиционные показатели, предсказывать развитие и выявлять ОПП. Среди них: NGAL, цистатин С, интерлейкин-18, молекула повреждения почек-1 [15].
Сейчас предпринимаются попытки использовать биомаркеры не только с целью прогнозирования развития ОПП, но и для разграничения ОПП от ХБП, а также уточнения вероятности неблагоприятного исхода [15]. Результаты исследований биомаркеров ОПП у больных ОКС продемонстрировали их возможности в решении указанных задач, при этом большинство работ выполнено на пациентах, подвергнутых коронарографии.
Преимуществом NGAL перед другими маркерами ранней диагностики ОПП является повышение его уровня в моче и крови уже через 2 часа после события, с достижением пика через 4 часа и сохранением этого уровня в течение 48 часов [10]. IL-18 мочи повышается через 4–6 часов после события и достигает пика после 12 часов. Цистатин С повышается через 2 часа, пика достигает только через 24 часа [10]. Все вышесказанное позволяет предположить, что NGAL является чувствительным ранним маркером ОПП [10].
Возможности NGAL в прогнозировании ОПП у больных ОКС по результатам исследований неоднозначны. По данным I. Torregrosa, NGAL мочи лучше предсказывал развитие ОПП, чем цистатин С сыворотки и IL-18 мочи [13], в других работах прогностическая ценность NGAL не подтвердилась [3]. Данный маркер оказался тесно связан со степенью системного воспалительного процесса и отражал тяжесть клинической картины у больных с ОКС [7]. В небольшом количестве исследований NGAL предсказывал развитие смерти от всех причин и кардиоваскулярные события [9]. Есть данные, что пожилой возраст, наличие ХБП, ХСН, хронической инфекции мочеполового тракта сопровождаются повышением уровня данного маркера, что затрудняет интерпретацию результатов исследований [2].
По результатам нашего исследования, NGAL мочи продемонстрировал низкую чувствительность и высокую специфичность в раннем прогнозировании ОПП. Снижение порогового уровня NGAL в моче будет повышать чувствительность диагностики, при одновременном снижении специфичности. При уровне NGAL мочи более 82 нг/мл специфичность составляет 99 %, а чувствительность ‒ только 20 %. Мы считаем, что высокая специфичность метода прогнозирования более важна, чем чувствительность, поскольку позволяет с большой долей вероятности утверждать развитие ОПП при концентрации NGAL в моче более 82 нг/мл и начать профилактические и лечебные мероприятия.
В настоящее время проводятся исследования, цель которых ‒ установить предельные значения NGAL для ОПП и ХБП. Решение проблемы повышения диагностической ценности биомаркеров, по мнению ряда авторов, лежит в плоскости повторного их определения, а также комбинированном использовании в виде панелей [10]. Возможно, наиболее перспективным представляется сочетанное использование NGAL, цистатина С и KIM-1 [5].
Заключение
NGAL является умеренным предиктором развития острого повреждения почек у больных острым коронарным синдромом, которым не проводилась коронарография. Уровень NGAL мочи более 82 нг/мл с высокой специфичностью (99 %) прогнозировал развитие ОПП у пациентов с ОКС, при этом чувствительность метода составляла только 20 %.
Работа выполнена при поддержке ФЦП «Научные и научно-педагогические кадры инновационной России» на 2009–2013 годы (Соглашение № 14.B37.21.1119 от 14.09.12).
Рецензенты:
Искендеров Б.Г., д.м.н., профессор кафедры терапии, кардиологии и функциональной диагностики, ГБОУ ДПО «Пензенский институт усовершенствования врачей» Минздравсоцразвития РФ, г. Пенза;
Рузов В.И., д.м.н., профессор, заведующий кафедрой факультетской терапии медицинского факультета, ФГБОУ ВПО «Ульяновский государственный университет», г. Ульяновск.
Работа поступила в редакцию 08.10.2013.
Библиографическая ссылка
Мензоров М.В., Шутов А.М., Макеева Е.Р., Михайлова Е.В., Парфенова Е.А. РОЛЬ ЛИПОКАЛИНА, АССОЦИИРОВАННОГО С ЖЕЛАТИНАЗОЙ НЕЙТРОФИЛОВ В РАННЕМ ПРОГНОЗИРОВАНИИ ОСТРОГО ПОВРЕЖДЕНИЯ ПОЧЕК У БОЛЬНЫХ ОСТРЫМ КОРОНАРНЫМ СИНДРОМОМ // Фундаментальные исследования. 2013. № 9-4. С. 698-702;URL: https://fundamental-research.ru/ru/article/view?id=32499 (дата обращения: 15.02.2026).



