Многие исследователи считают, что такие пептидные гормоны, как грелин, лептин и нейропептид Y, секретируемые на периферии и играющие важную роль в регуляции энергетического баланса и углеводного обмена, могут влиять на процессы обучения и памяти [8]. Аналогичными свойствами обладают гормоны надпочечников, щитовидной и половых желез [11]. Используя батарею простых поведенческих тестов (открытое поле, приподнятый крестообразный лабиринт, Т-лабиринт, лабиринт Морриса) на крысах и мышах показано, что грелин, нейропептид Y и лептин способствуют улучшению обучения, модулированию специфических молекулярных механизмов памяти приобретение/консолидации [6, 14].
Цель работы – исследовать морфофункциональное состояние коркового вещества надпочечников и уровень гормонов в крови мышей линии BALB/c, получавших пищу ad libitum, при пищевой депривации и при когнитивном напряжении в условиях сложной поведенческой модели.
Материалы и методы исследования
Эксперименты выполнены на 30 мышах-самцах линии BALB/c, масса тела 20–22 г (питомник «Столбовая»), которых содержали по 10 особей в отдельных клетках. Были сформированы 3 группы: 1 – интактные животные (получение пищи ad libitum); 2 – мыши, подвергаемые пищевой депривации (24 ч, через сут, референтная группа); 3 – животные, испытывающие когнитивное напряжение (обучение) на фоне пищевой депривации. Длительность эксперимента 30 сут. Мышей выводили из эксперимента передозировкой диэтилового эфира сразу после окончания обучения. Все экспериментальные процедуры проводили в соответствии с регламентом использования лабораторных животных в ФГБУ «НИИ морфологии человека» РАМН, принятым и утвержденным комиссией по биоэтике.
Когнитивное напряжение создавалось при информационной нагрузке, возникающей при предъявлении животным сложной пищедобывательной задачи в многоальтернативном лабиринте (обучение), алгоритм решения которой представлял собой 4-звенную последовательность оперантных действий. При индивидуальном помещении в свободное поле животное должно было самопроизвольно войти в лабиринт → посетить одну или две подкрепляемые кормушки из четырех имеющихся (2 ложные) → самопроизвольно выйти в свободное поле через один из двух выходов для того, чтобы вновь, войдя в лабиринт, иметь возможность получить подкрепление в тех же кормушках. Подробное описание поведенческой модели имеется в ряде публикаций [2, 4]. Когнитивное напряжение осуществлялась на фоне пищевой депривации в течение 24 ч – в те же дни, что и у животных референтной группы, длительность опыта составляла 13 мин.
Надпочечники фиксировали в жидкости Буэна, левые надпочечники проводили по спиртам восходящей концентрации, заливали в парафин. Гистологические срезы толщиной 4–5 мк окрашивали гематоксилином и эозином. При помощи морфометрической программы «AxioVision», на микрофотографиях экваториальных срезов надпочечников, полученных с помощью микроскопа «Axioscope 2», производили на каждом срезе не менее 65 измерений сетчатой, пучковой и клубочковой зон коркового вещества.
Используя микропланшетный иммуноферментный анализатор «ANTHOS 2010» (Австрия), определяли уровень грелина, лептина, нейропептида Y «Cusabio biotech. co., LTD» (Китай), кортикостерона «IBL» (Германия), тестостерона «DBC» (Канада), общего трийодтиронина (Т3) и общего тироксина (Т4) «Monobind Inc.» (США) в крови.
Статистическую обработку данных проводили с помощью пакета программного обеспечения Statistica 6.0. (StatSoft Inc., США). Проверка распределения вариационного ряда полученных данных на нормальность (Shapiro-Wilk’S test) позволила применить параметрический метод статистического анализа. Сравнение экспериментальных групп производили при помощи t-критерия Стьюдента для независимых выборок. Различия считались достоверными при p < 0,05.
Результаты исследования и их обсуждение
На качественном уровне общий план строения коркового вещества надпочечников всех групп мышей BALB/c был сходным. По данным морфометрического исследования, у мышей, подвергавшихся пищевой депривации (референтная группа), наблюдалось увеличение ширины клубочковой и сетчатой зон коркового вещества на 6,5 и 9,5 % соответственно (р < 0,05) по сравнению с интактными животными (рис. 1, 2).



Рис. 1. Показатели ширины клубочковой, пучковой и сетчатой зоны надпочечников интактных мышей («сытый фон», К) BALB/с, при пищевой депривации («голодный фон», ПД) и когнитивном напряжении (КН) в мкм
Реакция на когнитивное напряжение выражалась у мышей в достоверно значимом уменьшении ширины коркового вещества надпочечников на 22,7 %, проявлявшемся в снижении ширины всех функциональных зон: клубочковой зоны – на 11,9 %, пучковой зоны – на 10,7 %, сетчатой зоны – на 21,6 % по сравнению с референтной группой (рис. 1, 2). На качественном уровне отличие от референтной группы наблюдалось на границе сетчатой зоны и мозгового вещества, где отмечалось разрыхление соединительнотканных тяжей.
Животные всех 3-х групп не имели статистически значимых различий по массе тела.
Исследование уровня гормонов, характеризующих энергетическое состояние организма мышей BALB/c, позволило выявить ряд особенностей, характерных для каждой группы. По уровню грелина в крови животных, испытавших пищевую депривацию и получавших пищу ad libitum, не выявлено статистически значимых отличий (рис. 3). В то же время в крови мышей, подвергавшихся когнитивному напряжению, отмечено повышение уровня грелина в 1,5 раза (р < 0,001) по сравнению с животными референтной группы (рис. 3).
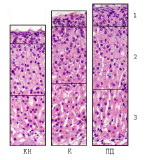
Рис. 2. Корковое вещество надпочечника интактных («сытый фон», К) мышей BALB/с, при пищевой депривации («голодный фон», ПД) и когнитивном напряжении (КН), Ув.х100: 1 – клубочковая зона, 2 – пучковая зона, 3 – сетчатая зона
Достоверно значимое по сравнению с интактными мышами снижение уровня лептина в 1,3 раза и нейропептида Y – в 1,5 раза определено в крови животных после пищевой депривации (рис. 3). По сравнению с референтной группой животных в крови мышей, обучавшихся в многоальтернативном лабиринте, наблюдалось достоверно значимое снижение уровня лептина в 1,5 раза. Между последними двумя группами не наблюдалось статистически значимых различий по уровню нейропептида Y (рис. 3).
Уровень кортикостерона в крови мышей, испытавших пищевую депривацию, статистически значимо не отличался от такового группы, получавшей пищу ad libitum (рис. 3). Тогда как уровень этого гормона в крови мышей, подвергавшихся когнитивному напряжению, был в 1,3 раза выше (р < 0,05) по сравнению с животными референтной группы (рис. 3).
По сравнению с интактными мышами после пищевой депривации у животных наблюдалось достоверно значимое снижение уровня тестостерона, в то же время значения этого показателя не отличались от таковых группы мышей, подвергавшихся когнитивному напряжению (рис. 3).
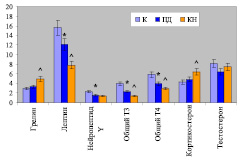
Рис. 3. Зависимость реакции гормонов от функционального состояния организма: «сытый фон»(интактные мыши, К), «голодный фон» (пищевая депривация, ПД) и когнитивное напряжение (КН) у мышей линии ВА1В/с в нмоль/л. Значения грелина, лептина, общего тироксина (Т4) и кортикостерона приведены с коэффициентом 10-2, нейропептида Y – с коэффициентом 10; вертикальная черта – доверительный интервал в соответствие с коэффициентом Стьюдента 0,05; * – ПД в сравнении с К («сытый фон»), ^ – КН в сравнении с ПД («голодный фон»)
Каждая зона коркового вещества адреналовых желез имеет специфическую структуру и секретирует присущие ей гормоны, что достигается благодаря дифференциальной генной активности [3]. На основании полученных нами данных можно заключить, что воздействие пищевой депривации и когнитивного напряжения отразилось противоположным образом на функциональном состоянии практически всех зон коркового вещества надпочечников: клубочковой зоны, в эндокриноцитах которой вырабатываются минералокортикоиды (преимущественно альдостерон и 11-дезоксикортикостерон); пучковой зоны, где образуются глюкокортикоидные гормоны (кортикостерон, кортизон и гидрокортизон); сетчатой зоны, эндокриноциты которой синтезируют половые гормоны, преимущественно адреналовые андрогены – дигидроэпиандростерон и его сульфат [3].
После 30-суточного периодического воздействия пищевой депривации отмечено увеличение ширины клубочковой и, в большей мере, сетчатой зоны. В наших экспериментах мы не определяли уровень основных минералокортикоидов альдостерона и 11-дезоксикортикостерона, секретируемые адренокортикоцитами клубочковой зоны. Дегидроэпиандростерон и его сульфат, секретируемые адренокортикоцитами сетчатой зоны, являются предшественниками тестостерона, андростендиона, эстрадиола и эстрона [3]. В наших экспериментах наблюдалось снижение уровня тестостерона у мышей, подвергавшихся пищевой депривации.
При когнитивном напряжении происходило уменьшение ширины всех функциональных зон коркового вещества надпочечников, что свидетельствует об интенсификации выделения указанных выше гормонов [12], из которых в наших экспериментах было определено лишь повышение уровня кортикостерона (на 33,4 %) в крови мышей, испытавших информационную нагрузку. Глюкокортикоиды, к которым относится кортикостерон, являются универсальными регуляторами метаболизма, производящими переключение пластических процессов на энергетические. Ускорение глюконеогенеза под влиянием глюкокортикоидов обусловливает значительно меньшую потерю гликогена [3].
Следует отметить, что в работах других авторов при моделировании холодового и иммобилизационного стресса у мышей BALB/c и других видов животных зарегистрировано гораздо более значительное повышение уровня кортикостерона – на 100 и 180 % соответственно, сопровождавшееся стресс-индуцированным снижением уровня тестостерона [1, 5]. В наших экспериментах уровень тестостерона снижался у группы мышей, подвергавшихся пищевой депривации, однако не столь значительно, как при стрессе.
По данным литературы известно, что кроме указанных выше изменений, при стрессе отмечается повышение в крови уровня нейропептида Y и тиреоидных гормонов (Т3 и Т4) [9, 15]. Однако в наших экспериментах в крови мышей, подвергавшихся пищевой депривации и когнитивному напряжению, зарегистрировано снижение уровня нейропептида Y и тиреоидных гормонов (Т3 и Т4). Известно, что при ограничении пищи снижение уровня тиреоидных гормонов в крови способствует замедлению потери массы тела [13].
Грелин, лептин и нейропептид Y как у грызунов, так и у человека имеют решающее значение в регуляции уровня глюкозы, служат связующим звеном между периферией и ЦНС. По данным литературы, при насыщении пищей уровень грелина обычно снижается, тогда как уровень лептина возрастает [7]. В наших экспериментах когнитивное напряжение, осуществляющееся на фоне пищевой депривации, усилило энергетические затраты, что привело к снижению уровня лептина и реципрокному возрастанию уровня грелина. Следует отметить, что уровень грелина у этой группы мышей оказался выше, а лептина – ниже, чем у животных после одной только пищевой депривации, несмотря на то, что в лабиринтной среде животные получали немного пищи, что может служить косвенным доказательством причастности этих гормонов к когнитивному процессу. Наши данные совпадают с гипотезой, выдвинутой D.I. Briggs и Z.B. Andrews, считающих, что в поддержании гомеостаза в условиях дефицита энергии наиважнейшую роль играет грелин [10].
Таким образом, установлено, что при пищевой депривации и при когнитивном напряжении, у мышей BALB/c происходит изменение морфофункционального состояния коркового вещества надпочечников и уровня гормонов участвующих в регуляции энергетического баланса. Эффекты когнитивного напряжения, происходящего на фоне пищевой депривации, отличаются от действия только лишь пищевой депривации, а также от стрессорных воздействий. При пищевой депривации наблюдается расширение функциональных зон коркового вещества, энергетический баланс поддерживается путем снижения в крови уровня тиреоидных и половых гормонов, а также лептина и нейропептида Y при реципрокном повышении уровня грелина. Когнитивное напряжение характеризуется уменьшением ширины функциональных зон коркового вещества, еще более значительным снижением уровня лептина и повышением уровня грелина, кроме того, в отличие от пищевой депривации нормализуется уровень тестостерона и повышается уровень кортикостерона.
Рецензенты:
Яглов В.В., д.м.н., профессор, главный научный сотрудник лаборатории развития эндокринной системы, ФГБУ «Научно-исследовательский институт морфологии человека» РАМН, г. Москва;
Гореликов П.Л., д.м.н., заведующий лабораторией нейроморфологии, ФГБУ «Научно-исследовательский институт морфологии человека» РАМН, г. Москва.
Работа поступила в редакцию 05.09.2013.
Библиографическая ссылка
Кондашевская М.В., Мхитаров В.А., Никольская К.А., Серкова В.В., Диатроптов М.Е. ХАРАКТЕРИСТИКА УРОВНЯ ГОРМОНОВ И МОРФОФУНКЦИОНАЛЬНОГО СОСТОЯНИЯ КОРКОВОГО ВЕЩЕСТВА НАДПОЧЕЧНИКОВ ПРИ ПИЩЕВОЙ ДЕПРИВАЦИИ И КОГНИТИВНОМ НАПРЯЖЕНИИ У МЫШЕЙ BALB/c // Фундаментальные исследования. 2013. № 10-4. С. 776-780;URL: https://fundamental-research.ru/ru/article/view?id=32400 (дата обращения: 05.01.2026).



