Одним из инструментов регенераторной хирургии может выступать трансплантация биологических материалов (клеточной взвеси, ткани, части органа, целого органа и т.д.) в качестве биологического метода репаративной регенерации [6]. Однако при применении макроскопических или крупноизмельченных взвесей биологических материалов репаративная регенерация, как правило, наступает только в зоне имплантации, на границе двух объектов: ткань реципиента – биологический материал, без вовлечения в репаративный процесс глубжележащих тканей реципиента [7]. В офтальмологической практике в исходе имплантации биологических материалов на склеру реципиента формирование новой соединительной ткани происходит только на поверхности склеры, а глубокие слои остаются интактными вследствие ее низкой регенераторной активности [2, 7].
Последние исследования, посвященные изучению регенерации пересаженного биологического материала, показали, что при уменьшении дисперсности имплантата (в микрометровом диапазоне) увеличивалась эффективность его взаимодействия с тканями реципиента [7]. Использование нанодисперсных имплантатов из биологических материалов, способных глубоко проникать, интрамурально вызывая репарацию и ангиогенез в подлежащих тканях реципиента, может значительно расширить возможности медицины в комплексном лечении дегенеративно-дистрофических заболеваний.
Одним из методов увеличения дисперсности материалов и повышения его биологической доступности является обработка в высокоэнергетических измельчительных устройствах (механоактивация) [10], что позволяет получить более эффективные медицинские препараты. При этом возможны два пути модификации материалов. Первый – повышение дисперсности материалов с образованием новых соединений, требующих дополнительных серьезных исследований своего биологического действия. И второй – изменение структурного состояния материалов при условии сохранения химического состава, при этом могут формироваться метастабильные полиморфные модификации, не приводящие к изменению фармакологического действия материала. Однако биологическая активность таких материалов значительно выше [1, 3, 11]. Хотя механоактивация используется в медицинских технологиях давно [9], в частности, при модификации лекарственных препаратов, например, глюконата кальция [4, 8], повышение дисперсности и перевод в аморфное состояние которого привело к повышению лекарственной эффективности препарата. Однако до сих пор никто не занимался получением механоактивированных нанодисперсных биологических имплантатов и оценкой их биологической активности.
Цель исследования – создание метода получения нанодисперсного биологического материала и изучение взаимодействия его с тканями реципиента в эксперименте.
Материал и методы исследования
Биологический материал, представленный плацентой человека, полученной в ходе кесарева сечения и родов доношенным плодом, отделенной от пуповины и амниотической оболочки, промытый в стерильном изотоническом растворе натрия хлорида, был высушен методом лиофильной сушки, а затем механически измельчен до крупнодисперсного порошка с размерами зерен от 45 мкм.
Крупнодисперсный материал плаценты и порошок после механоактивации помещался в биологический контейнер (БК), изготовленный из отрезка сосуда пуповины длиной до 10 мм и шириной до 2 мм.
Экспериментальные исследования выполнялись на половозрелых кроликах породы Шиншилла в возрасте от 1 года до 2 лет с массой тела от 3 до 3,5 кг согласно «Правилам проведения работ с использованием экспериментальных животных». Имплантацию БК производили под местной анестезией в верхне-наружном квадранте под слизистую оболочку на склеру глазного яблока кролика. В качестве контроля производилась имплантация БК, содержащего макродисперсную взвесь плаценты с размерами частиц от 50 мкм и более [5]. Динамику структурно-функциональных изменений глаза животных проводили через 3 дня, 7 дней, 1, 2 и 3 месяца после пересадки. Для контроля микроанатомических изменений энуклеированные глаза фиксировали в 10 % растворе нейтрального формалина, заливали в парафин. Полученные срезы зоны оперативного вмешательства помещались на поверхность предметного стекла с последующей химической очисткой от парафина. Cрезы окрашивали гемотоксилин-эозином и по Ван-Гизону.
Структурно-фазовый анализ порошков исходной крупнодисперсной и механоактивированной плаценты проводился методом рентгеновской дифракции (РД) на дифрактометре ДРОН-3 в монохроматизированном Cu Kα-излучении.
Контроль плаценты до и после механоактивации проводили методом Фурье-ИК-спектроскопии на спектрометре Excalibur 3100 фирмы Varian.
Анализ на возможное привнесение примесей в образцы плаценты при механоактивации проводился методом атомной эмиссионной спектроскопии с индуктивно связанной плазмой на приборе Spectoflame Modula (Spectro Analytical Instruments, Германия).
Исследование макромолекулярной организации и распределения внедренного нанодисперсного механоактивированого биологического материала проводились на сканирующей зондовой лаборатории Ntegra (NT-MDT) в прерывисто-контактной методике на воздухе. Все исследования осуществлялись на участках, отмеченных на рисунке стрелками (рис. 1).
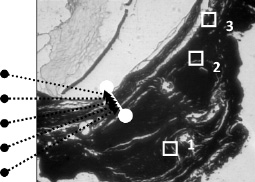
Рис. 1. Схема исследовании. Участки АСМ и конфокального оптического и спектрального исследований: 1 – плацента в биоконтейнере; 2 – стенка биоконтейнера; 3 – склера. Стрелками показаны участки (400 нм) проведения спектрального анализа
Спектроскопический флуоресцентный анализ гистологических срезов по точкам был выполнен на сканирующей зондовой лаборатории Ntegra Spectra (NT-MDT). Выбор области на образце осуществлялся с помощью оптического микроскопа с возможностью динамического увеличения и системой цифрового мониторинга. Далее спектральные характеристики для каждой из выбранных областей анализировались путем лазерной накачки и спектрального анализа. Все спектры получены на воздухе при комнатной температуре из области фокуса лазера с участков около 400 нм. Распределение химического состава по образцу проводилось выбором отдельных участков спектральной картины полученной на ПЗС (прибор с зарядовой связью) детекторе и анализировалось путем дальнейшего двумерного сканирования в выбранной области образца.
Результаты исследования и их обсуждение
Для получения НБМ был использован метод механоактивации высушенного мелкоизмельченного биологического материала в шаровой планетарной мельнице Pulverisette-7. При этом время измельчения составляло 30, 60 и 120 минут. Проведенные АСМ-исследования полученных порошков показали, что уже при времени измельчения 60 минут размер частиц в механоактивированном биологическом материале достигает 40–100 нм. При дальнейшем измельчении дисперсность частиц материала практически не изменяется.
Рентгеновские дифрактограммы исходного и измельченного порошков плаценты человека представлены на рис. 2. Как в исходном, так и МА состоянии аллоплацента находится в рентгеноаморфном состоянии. Отсутствие структурных рефлексов α-Fe свидетельствует о том, что при механическом измельчении в пределах чувствительности метода рентгеновской дифракции не произошло загрязнения образцов материалом используемых измельчающих тел. При этом содержание Si в образцах как до, так и после механической активации, по данным эмиссионной спектроскопии, не превышает 0,005 – мас. %, остальных элементов – 0,0002 мас. %, что также свидетельствует об отсутствии загрязнения образцов.
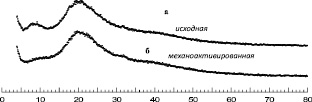
Рис. 2. Рентгеновские дифрактограммы аллоплаценты: а – до; б – после механоактивации
ИК-спектры исходной и МА плаценты представлены на рис. 3. Хорошо видно, что они практически идентичны за исключением небольшого перераспределения интенсивностей полосы в области больших волновых чисел. Изменение соотношения интенсивностей сигнала механоактивированного образца в области 2400–2800 см–1, а также 3200–3500 см–1 свидетельствует о деструкции как внутримолекулярных, так и межмолекулярных водородных связей в процессе механообработки. Поскольку мы имеем дело с чрезвычайно сложным органическим объектом, который содержит большое количество всевозможных органических структур об остальных изменениях без дополнительных исследований (масс-спектрометрии, ЭПР, ЯМР-исследований и т.д.) по результатам одной только ИК-спектроскопии говорить трудно. Можно отметить, что спектры по виду походят на отдельные белковые структуры, а также соединения с гетерогенной циклической связью.
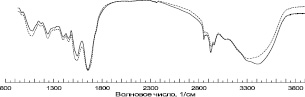
Рис. 3. ИК-спектры исходного порошка плаценты и порошка плаценты человека после механоактивации
В целом из приведенных выше результатов исследований следует, что механическое измельчение не загрязняет измельчаемую плаценту, в ней не происходит каких-либо существенных механоиндуцированных химических превращений и, соответственно, изменения ее химического состава.
При микроскопическом изучении среза биоконтейнера внутри пуповинного сосуда наблюдаются мелкие пылевидные частицы синевато-сиреневого цвета – агломераты нанодисперсного порошка аллоплаценты, которые не превышают 1–2 мкм в диаметре и совпадают по размеру с агрегатами порошка МА плаценты до имплантации. При анализе контрольного биологического материала плаценты обнаруживается, что размер не подвергавшегося механоактивации материала значимо превышает 50 мкм, приближаясь по размерам к надклеточным тканевым структурам. Эти данные подтверждаются всеми использованными методами (свеотооптические гистологические методы, лазерная конфокальная и атомно-силовая микроскопия (рис. 4).
а  б
б  с
с
Рис. 4. Плацента в биоконтейнере: а – конфокальное лазерное изображение МА биоматериала; б – профиль вдоль линии; с – АСМ изображении макродисперсного биоматериала в контроле
В ходе проведенных экспериментальных исследований выявлено, что послеоперационный период у кроликов протекал без видимых осложнений. Также не наблюдалось явной картины отторжения и вторичной инфекции.
В ранние сроки после имплантации БК на 3–7-е сутки во всех рассмотренных случаях имплантат сосуда пуповины сохранялся. Отмечалась умеренная воспалительная инфильтрация как стенки сосуда, так и окружающей конъюнктивы и субконъюнктивальной основы. Это проявлялось в лимфоцитарно-моноцитарных клеточных ответах, умеренной инфильтрации мононуклолеарами тканей прилежащей склеры и конъюнктивы, появлении отдельных лейкоцитов в стенке и в содержимом биоконтейнера. При этом в контроле проявления клеточных реакций были менее выражены. Прилегающий участок склеры реципиента в опыте характеризовался разрыхлением стромы, между коллагеновыми волокнами которой видны нейтрофилы и лимфоциты, а также мелкие полихромно окрашенные пылевидные частицы, аналогичные наблюдаемым при исследовании гистологического среза биоконтейнера. При этом отмечено сохранение наноразмерной структуры измельченной плаценты 40–100 нм. Разволокнение поверхностных слоев склеры в контроле, их инфильтрация под биоконтейнером не отмечались.
Для исследования скорости проникновения нанодисперсной плаценты в толщу склеры были проведены спектроскопические исследования поперечного среза склеры по точкам и биологического контейнера на 7-е сутки после имплантации БК. В качестве контрольных точек исследовалась МА плацента человека и интактная склера. Представленные на рис. 5 спектры дают представление о распределении интенсивностей для различных участков склеры. Сопоставление этих кривых показывает следующее: для спектров, соответствующих точкам 1 и 2, максимум интенсивности отвечает длинам волн, лежащим в интервале 540–550 нм, и соответствует максимуму, наблюдаемому в спектре интактной склеры с небольшим смещением в сторону длинных волн (не более 5 нм). На кривых для точек 3–5 наблюдаются два максимума: первый максимум отвечает длинам волн 545–555 нм; второй максимум смещен в сторону длинных волн и лежит в интервале от 554 до 570 нм. Эти данные приводят к выводу, что на участках 3–5 содержится вещество, максимум которого совпадает с максимумом для МА плаценты и соответственно на этих участках произошло взаимодействие ткани склера с НБМ. Таким образом, на 7-е сутки имплантации в опыте наблюдается проникновение МА частиц плаценты в толщу склеры на 2/3 ее толщины, что можно объяснить облегченной диффузионной миграцией наноразмерных частиц через поры в толще склеры.
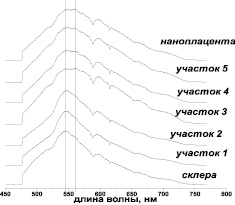
Рис. 5. Флуоресцентные спектры в опыте (на 7-е сутки после имплантации)
В отдаленные сроки наблюдения (2–3 мес.) происходит полное рассасывание БК в зоне имплантации, при этом в зоне введения наблюдалась выраженная грануляционная ткань, представленная соединительнотканной капсулой на поверхности склеры. В опыте в наружных слоях склеры наблюдалось увеличение числа активных фибробластов, окруженных новообразованными коллагеновыми волокнами, что хорошо было видно при окраске пикрофуксином по Ван-Гизону. Однако при использовании БК с крупнодисперсной плацентой новообразование коллагеновых волокон в самой склере не отмечено.
Заключение
Таким образом, механоактивация биологического материала плацентарного происхождения, приводит к увеличению дисперсности материала, не изменяя его химического состава. В результате проведенной механообработки плацента становится нанодисперсным рентгеноаморфным порошком, что облегчает диффузионную миграцию частиц имплантата через поры (размером до 100 нм) в толщу склеры. Полученный наноразмерный материал, обладая высокой степенью диспергированности, вероятно, одновременно приобретает новые специфичные для него свойства. Так, в результате интенсивного механического измельчения происходит значительное разрушение макромолекулярных комплексов с изменением их стереометрических параметров, изменением антигенных свойств материала. При анализе на уровне ИК-спектра выявляется повышенная гидрофильность полученного материала. Все это с учетом повышенной диффузионной способности может быть основой для повышения биологической активности исследованного нанодисперсного материала. Это позволяет шире варьировать объем введения донорских тканей, уменьшить травматические последствия хирургического вмешательства.
Рецензенты:
Селякин С.П., д.м.н., профессор кафедры анатомии человека, ГБОУ ВПО «Ижевская государственная медицинская академия» Минздравсоцразвития России, г. Ижевск;
Васильев Ю.Г., д.м.н., профессор кафедры гистологии, эмбриологии и цитологии, ГБОУ ВПО «Ижевская государственная медицинская академия» Минздравсоцразвития России, г. Ижевск.
Работа поступила в редакцию 15.08.2013.
Библиографическая ссылка
Перевозчиков П.А., Карбань О.В., Самарцев В.С. МЕХАНОАКТИВАЦИЯ КАК МЕТОД ПОЛУЧЕНИЯ НАНОМОДИФИЦИРОВАННЫХ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ // Фундаментальные исследования. 2013. № 9-3. С. 429-434;URL: https://fundamental-research.ru/ru/article/view?id=32368 (дата обращения: 28.02.2026).



