В настоящее время к наименее изученным структурам глаза человека относится мембрана Бруха, в то время как многие учёные-фундаменталисты и клиницисты подчёркивают её важную неоспоримую роль в развитии возрастной ретинальной макулодистрофии (АМД) [5, 8, 24]. Более глубоко эта структура изучена на примере животных [6, 19]. Мембрана Бруха выполняет разнообразные и важные функции, в первую очередь по избирательному транспорту питательных веществ и воды в направлении сетчатки [1, 16]. Именно мембрана Бруха вместе с хориокапиллярным слоем сосудистой оболочки и клетками пигментного эпителия образует своеобразную структурно-функциональную единицу, обеспечивающую барьерные функции [4]. Нарушение строения мембраны является причиной различных дегенеративных заболеваний пигментного эпителия (отслойка эпителия) и сенсорной части сетчатки (тапеторетинальная дегенерация, дегенерация макулярной области и др. [21]. Способствуют этому ее возрастные изменения и формирование друз [10, 11, 15, 20].
Изучение молекулярно-генетических аспектов проблемы заболевания АМД, биохимических сдвигов в структуре стекловидной пластинки является важным, но оно не опирается, к сожалению, на исчерпывающие морфологические данные по онтогенезу и специализации мембраны Бруха [8]. Изучение участия определённых генов в синтезе белков стекловидной пластинки в основном на экспериментальных животных не отменяет необходимость знания источников её развития у человека. Нами в доступной литературе отмечены единичные отрывочные указания на нейро-мезенхимное происхождение мембраны Бруха, которые свидетельствуют о том, что её физиологическая регенерация в плодном периоде и постнатальном онтогенезе происходит за счёт секреции пигментного эпителия сетчатки и эндотелия капилляров хориокапиллярного слоя. В то же время не изучен вопрос о том, что именно является источником развития стекловидной пластинки, расположенной на границе сетчатой и сосудистой оболочки.
Целью нашей работы послужило проведение морфологического мониторинга развивающейся стекловидной пластинки – мембраны Бруха (МБ) и установление источников её развития.
Материал и методы исследования
В работе использован материал глаза человека в возрасте от 5 недель эмбрионального периода развития до 87 лет постнатального онтогенеза. Для выявления структуры сосудистой оболочки в целом и стекловидной пластинки в частности использованы гистологические (по классической прописи окрашивание гематоксилином-эозином), а также окрашивание Victoria blue на выявление колагенового и эластического матрикса мембраны Бруха, а также иммуногистохимические методы исследования с использованием маркёров на выявление CD68 и CD163 [14]. Анализ материала проведён с помощью микроскопа Olympus – Bx51 и цифровой камеры PDх25 с фирменным программным обеспечением.
Результаты исследования и их обсуждение
В наших исследованиях базальная мембрана пигментного эпителия сетчатки идентифицируется с 5 недели эмбриогенеза. На 11 неделе выявляется зачаток компонентов мембраны Бруха, представленный клетками веретеновидной формы, в отличие от данных Fu J., Li F.M. (1989), Takei Y., Ozanics V. (1975), идентифицировавших все 5 компонентов мембраны Бруха в эти сроки [7, 21]. По нашим данным, как и данным Sellheyer K., Spitznas M. [18], примитивная мембрана Бруха идентифицируется не ранее 8 недели в виде клеток, прилежащих к базальной мембране пигментного эпителия. С помощью морфологического мониторинга развития хориоидеи установлено, что в пренатальном онтогенезе мембрана Бруха получает развитие за счёт нейроглии, мигрирующей из внутреннего нейрального листка глазного бокала через пигментный листок в строму формирующейся сосудистой оболочки, образуя клеточную глиальную пластинку между пигментным эпителием и сосудистой оболочкой на всём её протяжении. Морфологически под пигментным эпителием и его базальной мембраной идентифицируются два типа клеток: светлые и тёмные, с крупным гипохромным ядром и высокими ядерно-цитоплазматическими отношениями и с базофильным ядром и низкими ядерно-цитоплазматическими отношениями. Светлые клетки идентифицируются на более ранних этапах развития и морфологически идентичны глиальным клеткам по свойству окрашивания – их цитоплазма хромофобна (рисунок, а, б, в). Эти клетки имеют вытянутую веретеновидную форму и контактируют между собой (рисунок, г, д). При окрашивании по методу Victoria blue нами отмечено, что эластический каркас стекловидной пластинки в период накопления пигментными эпителиоцитами меланина имеет толщину до 25 мкм (рисунок, б). Мы считаем, что на ранних этапах онтогенеза они отвечают за выработку коллагена и гиалуроновой кислоты, препятствующих прорастанию формирующихся сосудов в хориоидее в направлении пигментного эпителия и фоторецепторов сетчатки, преобладающее трофическое обеспечение которых является ликворным на всём протяжении онтогенеза. Имеются данные, что синтез гиалуроновой кислоты наблюдается, начиная с 10 недели пренатального онтогенеза человека, и продолжается до преклонного возраста, значительно снижаясь после 50 лет [22]. Кроме этого, мы предполагаем, что нейроглия, формирующая стекловидную пластинку, осуществляет морфогенетический контроль за вектором роста сосудов в радиальном направлении.
Мы считаем, что процесс миграции нейроглиальных клеток через контактные взаимодействия и изменяющуюся информацию положения индуцирует изменения в геноме пигментного эпителия и эндотелиальных клеток на экспрессию генов, отвечающих за выработку коллагена IV типа, присущего мембране Бруха [2]. По мнению Byström B., Virtanen I., Rousselle P., Gullberg D., Pedrosa-Domellöf F. (2006), именно коллаген мембраны Бруха играет важную роль в ходе морфогенеза, влияя на распространение, миграцию и дифференцировку клеток [3]. Эта функция стекловидной пластинки сохраняется и в постнатальном онтогенезе. Нарушения физиологической регенерации стекловидной пластинки приводят к развитию возрастной макулодистрофии и прорастанию сосудов в направлении сетчатки с образованием друз и даже прободанием пластинки пигментного эпителия. Loeffler K.U., McMenamin P.G. наблюдали в прилежащем к мембране Бруха пространстве макрофагоподобные клетки, что согласуется с нашими данными о роли эффекторных иммуноцитов в развитии структур глаза человека [9]. Процесс миграции нейроглиоцитов и их локальная дифференцировка и специализация в структурах глаза является иммноиндуцированным процессом. Правильные представления об источниках развития и физиологической регенерации стекловидной пластинки позволяют правильно трактовать механизмы патогенеза АМД и разработать патогенетически обоснованные профилактику и лечение этой патологии, ведущей к слепоте.
а 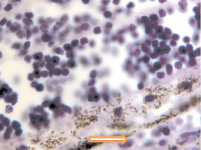 б
б 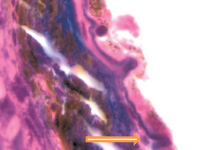 в
в 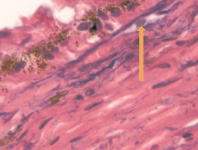
г 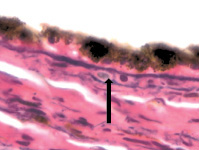 д
д 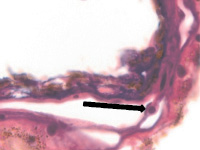
Глаз плода человека: а – 8 недель; б – 10 недель; в – 14 недель; г, д – 16 недель. Окраска а, в, г, д – гематоксилин-эозином; б – Victoria blue. Микрофото. Ув. х400
На современном этапе признана точка зрения, что мембрана Бруха – это тонкая пластинка, состоящая из двух слоев, служащая для фильтрации диффундирующих в сетчатку из хориокапиллярного слоя веществ. В действительности можно считать, что мембрана Бруха состоит только из трех внутренних слоев, поскольку наружные слои относятся к другим образованиям. Ряд исследователей мембрану Бруха рассматривают одновременно с сосудистой оболочкой. Гистогенетически мембрана Бруха одновременно относится как к сосудистой оболочке, так и сетчатой оболочке. При световой микроскопии ткань, лежащая между пигментным эпителием и хориокапиллярным слоем сосудистой оболочки, в постнатальном онтогенезе гомогенного строения, поэтому была названа Брухом стекловидной пластинкой (lamina vitrea), в последующем она получила название мембрана Бруха (compexus (lamina) basalis (Bruch)). При использовании более точных методов световой микроскопии в мембране Бруха выделены следующие части: наружная кутикулярная часть и более волокнистая – внутренняя часть. Поскольку внутренняя часть мембраны Бруха интенсивно окрашивается при применении методов, выявляющих эластическую ткань, ее назвали «lamina elastica». Особенности строения мембраны Бруха и ее толщина зависят как от локализации исследуемого участка, так и от возраста индивидуума. У взрослых толщина мембраны в перипапиллярной области равна 2–4 мкм, а в периферических – 1–2 мкм. У детей толщина ее в центральных участках равна 2 мкм. Ультраструктурные исследования позволили выделить в мембране Бруха пять слоев (зон): базальную мембрану пигментного эпителия, внутренний слой волокон (эластический), наружный коллагеновый слой, базальную мембрану клеток эндотелия хориокапилляров. Наиболее внутренний слой мембраны, представленный базальной мембраной пигментного эпителия сетчатки, имеет толщину приблизительно 0,3 мкм. Внутренняя коллагеновая зона (толщиной 1,5 мкм) состоит из плотно упакованных и строго ориентированных фибрилл коллагена (диаметр волокон – 60 нм, а периодичность исчерченности – 64 нм). Коллаген относится в основном к коллагену IV типа. Волокна погружены в основное вещество, состоящее преимущественно из протеогликанов. Средняя зона (эластический слой) имеет толщину 7 порядка 0,8 мкм, и в ней эластические волокна располагаются беспорядочно. Именно в этой зоне при старении и различных патологических состояниях отмечается накопление солей кальция и липидов. Наружная коллагеновая зона схожа по структуре с внутренней зоной. Единственным отличием является то, что она толще (0,7 мкм). Наиболее наружный слой мембраны Бруха, представленный базальной мембраной эндотелиальных клеток капилляров сосудистой оболочки, самый тонкий (0,14 мкм).
Собственные гены кодируют каждую из шести изоформ, alpha1(IV) через alpha6(IV), собирающиеся в одну из трех характерных heterotrimers. Болезнетворные мутации в каждом из шести генов у человека часто сопровождают разнообразную глазную патологию, которая охватывает общие врожденные и прогрессивно ведущие к слепоте заболевания, такие как гипоплазия зрительного нерва, глаукома и дегенерация сетчатки. Но до сих пор неизвестно, какие структуры в зоне контакта пигментного эпителия и хориокапиллярного слоя отвечают за выработку молекул коллагена IV типа, что необходимо для понимания топографии и сроков развития первичного патогенеза. Хотя известна примерная локализация изоформ коллагена IV в развитых человеческих глазах, пространственное и временное распределение IV типа коллагена на раннем этапе развития глаза человека до сих пор не установлено. Использование моноклональных антител помогло раскрыть системную локализацию всех шести изоформ коллагена IV типа в развивающихся глазах мыши. Было установлено, что alpha1(IV) и alpha2(IV) всегда coлокализованы на протяжении всего пренатального онтогенеза. Аlpha3 (IV) и alpha4(IV) также всегда солокализованы, но гораздо более пространственно, чем alpha1(IV) и alpha2(IV). Аlpha5(IV) присутствует во всех сосудистых мембранах, но alpha6(IV) не был обнаружен ни в базальной мембране эндотелия, ни в меммбране Бруха, что свидетельствует о том, что alpha5(IV) в мембране Бруха является частью alpha3alpha4alpha5 гетеротримера и относится к коллагенам, образующим сетеподобные структуры.
Понимание эффекторных клеточных источников секреции изоформ коллагена IV типа в развивающихся глазах будет способствовать более глубоким представлениям и пониманию механизмов, лежащих в основе глазных болезней, которые приводят к слепоте миллионы людей во всем мире.
В действительности можно считать, что мембрана Бруха состоит только из трех внутренних слоев, поскольку наружные слои относятся к другим образованиям.
Она очень плотно соединена с хориокапиллярным слоем хориоидеи, участвует в регулировании поступления кислорода в сетчатку и продуктов обмена обратно в кровоток. С возрастом и при наличии предрасположенности может возникнуть нарушение функции комплекса структур: хориокапиллярный слой, мембрана Бруха и пигментный эпителий с развитием возрастной макулярной дегенерации. Некоторые авторы придерживаются точки зрения, что нарушение функции мембраны Бруха связано с накоплением в ней липидов и липопротеинов.
Наличие прогениторных клеток в раннем онтогенезе человека, отвечающих за морфогенез мембраны Бруха, может служить показателем перспективности применения нейроглиальных мигрантов из внутренней стенки глазного бокала для лечения возрастной макулодистрофии и диабетической ретинопатии.
Рецензенты:
Храмова И.А., д.м.н., профессор, Краевой клинический центр специализированных видов медицинской помощи, г. Владивосток;
Шульгина Л.В., д.б.н., профессор, зав. лабораторией микробиологии, ФГУП ТИНРО-Центр, г. Владивосток.
Работа поступила в редакцию 15.08.2013.Библиографическая ссылка
Новиков А.С., Рева И.В., Рева И.В., Рева Г.В., Ямамото Т., Ямамото Т., Абдуллин Е.А., Абдуллин Е.А., Альбрандт К.Ф., Альбрандт К.Ф. ОНТОГЕНЕЗ МЕМБРАНЫ БРУХА ГЛАЗА ЧЕЛОВЕКА // Фундаментальные исследования. 2013. № 9-3. С. 424-428;URL: https://fundamental-research.ru/ru/article/view?id=32367 (дата обращения: 28.02.2026).



