Магнитные наночастицы (НЧ), в частности, оксидов железа, широко используются для биомедицинских целей in vivo, например, для усиления контрастирования и повышения диагностической чувствительности в МРТ [6, 7], целевой доставки и специфического связывания терапевтических агентов в биоткани [8], гипертермии с помощью переменного магнитного поля, тканевой инженерии [2, 10]. В настоящее время недостаточно освещены вопросы изучения накопления и морфологических изменений во внутренних органах при однократном и многократном введении НЧ, хотя есть работы, посвященные пероральному, внутримышечному введению нестабилизированных НЧ, показавшие, что данные методы неэффективны для диагностики и последующего лечения опухолей и оказывают умеренно выраженный токсический эффект на внутренние органы [1, 3–5, 9]. Целью представленной работы стало изучение морфометрических и морфологических изменений тканей, органов, опухоли лабораторных крыс с перевитым раком печени РС-1 при однократном и многократном внутрибрюшинном введении НЧ железа, стабилизированных цитратом.
Материалы и методы исследования
В эксперименте использованы 24 белые беспородные крысы самцы весом 180–200 г с перевитой опухолью – рак печени РС-1. Крысам вводили внутрибрюшинно стабилизированные цитратом НЧ магнетита со средним размером 23 ± 6 нм [2]. Работа с лабораторными животными осуществлялась согласно протоколу исследований в соответствии с Женевской конвенцией 1985 г. о «Международных принципах биомедицинских исследований с использованием животных» и Хельсинкской декларацией 2000 г. о гуманном отношении к животным.
В первой серии эксперимента каждая из 6 крыс получала по одной внутрибрюшинной инъекции НЧ магнетита в дозировке 700 мг/кг. Во второй серии 6 крысам вводили внутрибрюшинно один раз в сутки в течение 7 дней водный коллоид НЧ магнетита в дозе 250 мг/кг. Дозы были рассчитаны на основании предварительно проведенных экспериментов и литературных данных [2–6]. Используемые дозировки не влияли на общее состояние животных и не приводили к их гибели. Были введены две контрольные группы сравнения, состоявшие из 6 крыс, которые в каждой получали внутрибрюшинно инъекцию 1 мл физиологического раствора однократно и в течение 7 дней. соответственно. Для контроля накопления НЧ в опухоле и органах животных проводили МРТ через 24 часа после последнего введения НЧ в соответствии с описанным дизайном эксперимента на высокопольном томографе PhilipsAchieva 1.5T с использованием фазированной катушки. Иммобилизацию животных проводили в положении на спине с фиксацией конечностей, в каждом случае длительность ее составляла 60 мин. Для наркоза вводили внутримышечно золетил в концентрации 40 мг/кг веса животного. После проведения МРТ все животные выводились из эксперимента путем декапитации, после чего проводили забор тканей внутренних органов для гистологического исследования. Парафиновые срезы окрашивали гематоксилином и эозином и по Перлсу (для выявления железа). Морфометрию проводили с помощью микровизора µVizo-101 (ЛОМО).
Нормальность распределений полученных данных была подтверждена с помощью критерия Колмогорова‒Смирнова, после чего отличия между средними в контрольной группе сравнения и опытными оценивали с использованием t-критерия для независимых выборок, различия признавали статистически значимыми при р < 0,05.
Результаты исследований и их обсуждение
При макроскопическом исследовании на аутопсии обращало на себя внимание увеличение органов. При однократном введении – печени, почки, сердца, легких, селезенки; при многократном введении – почек, сердца, легких, селезенки.
При многократном введении накопление частиц было настолько значимым в мезентериальных лимфатических узлах, что на 7-е сутки, в последний день эксперимента, при проведении МРТ они были резко контрастны по сравнению с другими органами. На аутопсии лимфоузлы брюшной полости за счет большого скопления НЧ имели темно-коричневый цвет.
При гистологическом исследовании лимфатические узлы имели разную структуру, часть лимфоузлов была сохранена и в них обнаруживались массивные отложения НЧ железа, другая их часть была представлена скоплением зерен черного и коричневого цветов (что возможно обусловлено валентностью железа, входящего в состав НЧ Fe2+ или Fe3+), которые при окраски по Перлсу давали реакцию Берлинской лазури. Также отмечали скопление НЧ в виде тяжей по ходу лимфатических сосудов в жировой клетчатке. Скопления НЧ были подтверждены при проведении микроскопии в темном поле в режиме флуоресценции (рисунок).
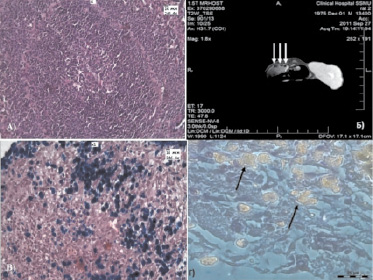
А – строение селезенки при многократном введение НЧ. Окраска гематоксилином и эозином. Ув. х246; Б – МРТ снимок крысы с раком печени РС-1, справа ‒ опухоль, слева ‒ 3 лимфоузла брюшной полости, накопившие НЧ; В – скопление НЧ железа в лимфатическом узле. Окраска гематоксилином и эозином, с реакцией по Перлсу. Ув. х246; Г – темнопольная микроскопия в режиме фазового контраста. Скопление НЧ светится желтым цветом. Ув. х 600
В печени при однократном и многократном введении НЧ отмечали схожие изменения: в гепатоцитах – зернистую и очаговую гидропическую дистрофию; в просвете сосудов – выраженное полнокровие, феномен сепарации крови, нити фибрина. При многократном введении НЧ, имеющие вид гранул коричневого цвета, обнаруживали в клетках Купфера. При проведении анализа морфометрических данных было выявлено достоверное изменение среднего числа в поле зрения следующих клеточных элементов: при однократном внутрибрюшинном введении увеличение лейкоцитов на 169 %, гепатацитов ‒ на 17 %, суммы всех клеточных элементов в поле зрения ‒ на 22 %. Увеличивалось также число гепатоцитов в состояние некробиоза и некроза на 53,6 % по сравнению с группой сравнения. При многократном внутрибрюшинном введении увеличение непаренхиматозных элементов было на 39 %, гепатацитов – на 19 %, суммы всех клеточных элементов в поле зрения – на 23 % и уменьшение в поле зрения среднего числа гепатоцитов в состояние некробиоза, некроза на 41 % по сравнению с группой сравнения (таблица).
Морфометрические изменения в органах при внутрибрюшинном введении НЧ железа
|
Орган |
Показатель |
Контрольная группа сравнения |
Однократное в/бр. введение |
Многократное в/бр. введение |
|
Печень |
Не паренхиматозные элементы 1 |
6,17 ± 0,43 |
7 ± 0,43 |
8,6 ± 0,95** |
|
Лейкоциты |
1,52 ± 0,18 |
4,09 ± 0,53** |
1,5 ± 0,39 |
|
|
Гепатоциты |
35,41 ± 1,54 |
41,63 ± 1,99* |
42,1 ± 1,19* |
|
|
Сумма клеток в поле зрения |
43,11 ± 1,81 |
52,72 ± 2,05** |
53 ± 2,007** |
|
|
Кол-во дегенеративных гепатоцитов 2 |
10,17 ± 0,68 |
15,63 ± 0,908** |
6,1 ± 1,01** |
|
|
Легкие |
S инфильтратов (мм2) |
0,084 ± 0,0005 |
0,188 ± 0,0,033* |
0,048 ± 0,0034*** |
|
P инфильтратов, мм |
1,36 ± 0,008 |
1,84 ± 0,251 |
0,89 ± 0,0307*** |
|
|
Толщина межальвеолярных перегородок, мм |
0,012 ± 0,0009 |
0,011 ± 0,0011 |
0,0096 ± 0,0006* |
|
|
Почки |
S клубочков (мм2) |
0,0039 ± 0,00018 |
0,0033 ± 0,0002** |
0,0034 ± 0,0001 |
|
P клубочков |
0,232 ± 0,0054 |
0,208 ± 0,009* |
0,22 ± 0,00507* |
|
|
Высота эпителиоцита |
0,012 ± 0,0003 |
0,014 ± 0,0002*** |
0,011 ± 0,0002 |
|
|
Селезенка |
S фолликулов (мм2) |
0,14 ± 0,01 |
0,15 ± 0,009 |
0,12 ± 0,014 |
|
P фолликулов (мм) |
1,40 ± 0,048 |
1,44 ± 0,055 |
1,21 ± 0,081 |
|
|
S светлого центра (мм2) |
0,013 ± 0,002 |
0,024 ± 0,0006*** |
0,044 ± 0,002*** |
|
|
Толщина маргинальной зоны (мм) |
0,015 ± 0,0011 |
0,014 ± 0,0009 |
0,009 ± 0,0006*** |
Примечания: – различия достоверно отличаются при сравнении значений опытной и контрольной групп при * – Р < 0,05, **Р < 0,005, *** – Р < 0,001;
1 – к непаренхиматозным элементам относили и обобщили в одну группу клетки Купфера, Ито, Pit-клетки; 2 – к дегенеративным гепатоцитам относили безъядерные клетки с разорванной плазмолеммой, а также клетки с ядрами в состоянии кариопикноза, кариорексиса и кариолизиса.
В сердце при однократном и многократном введениях НЧ железа обнаруживали сходные изменения: зональный отек стромы, феномен сепарации крови в сосудах, предсердиях. В просвете сосудов наряду с эритроцитами наблюдали скопления НЧ; очаговые и диапедезные периваскулярные кровоизлияния, которые были более выражены при однократном введении (рисунок).
В легких при однократном введении НЧ железа наблюдали статистически достоверное увеличение площади перибронхиальных инфильтратов более чем в 2 раза по сравнению с контролем; увеличение выраженности эмфиземы, при этом значимого изменения средней толщины межальвеолярной перегородки не зафиксировали, в сосудах отмечали феномен сепарации крови. При многократном введении НЧ железа наблюдали значимое истончение межальвеолярных перегородок на 20 % по сравнению с контролем и увеличение выраженности эмфиземы. Обращало на себя внимание уменьшение площади перибронхиальных инфильтратов в 2 раза по сравнению с контрольной группой. Между эритроцитами обнаруживали гранулы пигмента гемосидерина. Наблюдали отек и утолщение стенок артерий, полнокровие сосудов с развитием в них феномена сепарации крови (таблица).
В головной мозге при однократном внутрибрюшном введении НЧ железа развивался умеренный отек вещества головного мозга, кровоизлияния в мягкие мозговые оболочки головного мозга и мозжечка. Обнаруживались очаговые участки деструкции вещества головного мозга с развитием субэпиндимальной пролиферации глиальных клеток. При длительном внутрибрюшном введении отмечали более выраженное полнокровие сосудов и отек вещества головного мозга; в мозжечке ишемические изменения клеток Пуркинье в виде лизиса ядер и образованием «клеток-теней» (таблица).
В почках при однократном и многократном введении НЧ наблюдали полнокровие сосудов коркового и мозгового вещества и интерстициальной зоны, феномен сепарации крови в крупных сосудах, зернистую дистрофию эпителия извитых и прямых канальцев. Кровенаполнение клубочков было снижено по сравнению с контролем. При анализе морфометрических показателей в почках отмечали при однократном внутрибрюшинном введении статистически значимое уменьшение размеров площади клубочков на 15,5 %, периметра – на 11 % и увеличение средней высоты эпителиоцитов извитых канальцев на 16 % по сравнению с контрольной группой. При многократном внутрибрюшинном введение НЧ статистически значимое увеличение размеров клубочков по периметру на 5 % (таблица).
В селезенке при однократном введении НЧ железа отмечали, что соотношение красной и белой пульп составляет 2/1. В фолликулах обнаруживались светлые герминативные центры, площадь которых составляла 0,024 ± 0,0006 мм2, что было на 84 % больше, чем контрольной группе с перевитой опухолью РС-1. При многократном введении наблюдали преобладание красной пульпы над белой (4/1), при этом границы между красной и белой пульпой были нечеткие, в красной пульпе развивалось выраженное полнокровие. Обращали на себя внимание фолликулы с четкой мантийной зоной, толщиной 0,009 ± 0,0006 мм, которая была на 40 % меньше, чем в контрольной группе. Было установлено статистически значимое увеличение площади светлых центров (0,044 ± 0,002 мм2) на 238 % по сравнению с контрольной группой, что свидетельствовало об их гиперплазии. При однократном и многократном введении визуализировали включения черного цвета в клетках красной пульпы, дающие положительную окраску по Перлсу, что может говорить как об увеличении отложения гемоседерина, так и о накоплении НЧ (таблица, рисунок).
Морфологических изменений в ткани опухоли по сравнению с контрольной группой не наблюдалось. Скоплений НЧ не обнаружено ни морфологически, ни методом МРТ.
Заключение
При введении НЧ железа, покрытых цитратом натрия, их скопления отмечаются по ходу введения, а также в лимфатических узлах брюшной полости. При длительном введении скопления НЧ настолько значимы, что лимфатические узлы являются контрастными на МРТ, что также подтверждается данными аутопсии и последующими гистологическими исследованиями. Макроскопически при однократном введении происходит увеличение печени, почек, сердца, легких, селезенки, а при многократном менее значительное увеличение почек и сердца и более значительное ‒ легких и селезенки. Единичные скопления частиц обнаруживались в сосудах миокарда и клетках Купфера печени, в то время как в опухоли накопление НЧ не подтвердилось ни морфологическими методами, ни данными МРТ. Данные результаты позволяет сделать вывод о нецелесообразности внутрибрюшного метода введения НЧ железа для усиления контрастности опухоли при МРТ.
Установлено, что НЧ железа имеют низкий цитотоксический эффект, так как повреждения паренхиматозных клеток имели обратимый характер, однако вызывают различные виды нарушения кровообращения в виде полнокровия сосудов, феномена сепарации крови, отека, развитии диапедезных и очаговых кровоизлияний и появления нитей фибрина в сосудах печени. Анализ морфометрических данных (количество клеток в печени, перибронхиальные инфильтраты в легких, уменьшение площади клубочков в почках, увеличение площади светлых центров в селезенке) свидетельствует о развитии реактивной реакции на острое повреждение.
Таким образом, полученные данные свидетельствуют о том, что однократное введение большой дозировки вызывает более выраженные изменения в органах детоксикации (печень, почки), в то время как длительное введение меньшей дозировки не вызывает цитотоксического эффекта, а приводит к структурным изменениям органов иммуногенеза (лимфоузлы, селезенка).
Рецензенты:
Пучиньян Д.М., д.м.н., профессор, заместитель директора по науке, ФГБУ «Саратовский научно-исследовательский институт травматологии и ортопедии» Минздрава РФ, г. Саратов;
Горин Д.А., д.х.н, профессор, научный руководитель департамента нанотехнологий Образовательно-научного института наноструктур и биосистем, ФГБОУ ВПО «Саратовский государственный университет им. Н.Г. Чернышевского», г. Саратов.
Работа поступила в редакцию 23.08.2013.Библиографическая ссылка
Кун Сян Мяо МОРФОЛОГИЧЕСКИЕ ИЗМЕНЕНИЯ В ТКАНЯХ И ОРГАНАХ ЛАБОРАТОРНЫХ КРЫС С ПЕРЕВИВАЕМЫМ РАКОМ ПЕЧЕНИ РС-1 ПРИ ВНУТРИБРЮШИННОМ ВВЕДЕНИИ ЦИТРАТ-СТАБИЛИЗИРОВАННЫХ НАНОЧАСТИЦ ЖЕЛЕЗА // Фундаментальные исследования. 2013. № 9-3. С. 380-384;URL: https://fundamental-research.ru/ru/article/view?id=32358 (дата обращения: 28.02.2026).



