Тяжесть течения острого панкреатита определяется объёмом некроза ткани поджелудочной железы, величиной и длительностью действия повреждающих факторов, состоянием иммунной системы. Не меньшее значение имеют сопутствующие состояния: угнетение кроветворения, заболевания печени, диабет, онкологическая патология [3]. Функциональная недостаточность эндотелия – это критический момент в развитии системной воспалительной реакции (СВР). По глубине нарушения функций эндотелия можно судить о раннем развитии СВР при острой хирургической патологии в частности [1].
Для оценки тяжести острого панкреатита тяжелого течения (ОП) и прогнозирования исхода мы использовали васкулоэндотелиальный фактор роста (ВЭФР) и количество десквамированных эндотелиоцитов (ДЭЦ) как маркеров эндотелиальной дисфункции и показателей активности регенераторного компонента воспалительной реакции. ВЭФР вырабатывается макрофагами, эндотелиальными клетками и их окружением. Экспрессия ВЭФР регулируется гипоксией поврежденной ткани, он индуцирует пролиферацию, миграцию эндотелиоцитов, формирование просветов сосудистых трубок и связанной сосудистой сети. ВЭФР способствует выживанию формирующихся капилляров грануляционной ткани и влияет на их проницаемость. Снижение уровня ВЭФР приводит к апоптозу эндотелия, обструкции просветов сосудов и их регрессии [7]. Это приводит к выраженному торможению репарации с распространением гнойно-некротического процесса. При этом формируется неполноценная грануляционная ткань, бедная фибробластами и волокнами, с резким отеком межуточного пространства [4].
Значительная роль в патогенезе септических осложнений при остром панкреатите принадлежит метаболиту L-аргинина – оксиду азота (NO). Он вызывает вазодилятацию, нарушает транспорт кислорода и приводит к ухудшению кислородного статуса организма, NO также стимулирует секвестрацию тромбоцитов, увеличивает проницаемость различных мембран, вызывает метаболические и структурные повреждения клеток эндотелия, обладает цитотоксическим эффектом [6]. Изоформа NO-синтазы сосудистого эндотелия (NOS3) непосредственно участвует в синтезе NO в ответ на механическое воздействие (напряжение сдвига) и на ряд агонистов: ацетилхолин, брадикинин, эндотелиальный сосудистый фактор роста [2]. Ген NOS3 локализуется в хромосоме 7q35-36, содержит 26 экзонов. Существуют несколько аллельных вариаций этого гена, но только часть из них имеет функциональное значение. Интерес представляет структурная замена гуанина (G) на тимидин (T) в 894 позиции, в 7 экзоне. Это ведет к замене глутаминовой кислоты на аспарагиновую в 298 позиции молекулы фермента [8]. Точечные мутации в молекуле NOS3 приводят к нарушению регуляции активности этого фермента, к избыточной продукции либо недостаточному синтезу NO [2, 5]. Генетически обусловленная дисрегуляция синтеза NO может способствовать развитию септических осложнений при острых воспалительных процессах, в частности, при остром панкреатите. Значение эндотелиальной дисфункции, роль ВЭФР и полиморфизма гена NOS3 в патогенезе ОП практически не изучена.
Цели исследования ‒ определение возможности маркеров повреждения эндотелия: ВЭФР и количества ДЭЦ для оценки эффективности лечения и прогнозирования осложнений при ОП; изучение полиморфизма NOS3 у пациентов с ОП.
Материал и методы исследования
Обследовано 42 пациента с острым панкреатитом тяжелого течения (ОП) находившихся на лечении в ГУЗ «Пермская краевой клиническая больница» в 2011–2012 годах, из них 26 – мужчины (66,6 %), 13 – женщины (33,3 %). Возраст больных был от 19 до 82 лет, 48,05 ± 15,84 лет. В динамике обследовано 33 пациента с ОП, из них 23 (69,7 %) мужчин и 10 (30,3 %) женщин, возраст 46,45( ± 15,45) лет. В контрольную группу включены 13 практически здоровых человек. Контрольная группа сопоставима с исследуемой по возрасту (Mann‒Whitney тест, р > 0.5).
Отбор пациентов для исследования проводился в соответствии с классификацией острого панкреатита (Атланта 1992 г.), в сроки не позднее 10 суток с момента начала заболевания. Диагноз острого панкреатита тяжелого течения ставили на основании инфильтрации парапанкреатической клетчатки, забрюшинных клетчаточных пространств, жидкостных скоплений по результатам компьютерной томографии и интраоперационных признаков (некротические изменения в самой железе или парапанкреатической клетчатке, наличие отека забрюшинной клетчатки, ферментативного или геморрагического экссудата).
В исследование включены пациенты с токсической, билиогенной и травматической этиологией острого панкреатита. У всех получено информированное письменное согласие на участие в исследовании.
Больные были разделены на 2 группы: в первую вошли пациенты без септических осложнений (СО) (n = 18), во вторую – с СО (n = 24), при исследовании в динамике эти группы включали 13 и 20 больных соответственно.
Уровень ВЭФР в сыворотке крови определяли с использованием наборов «VEGF-ИФА-Бест» ЗАО «Вектор-Бест» (Россия). Для определения повреждения эндотелия проводили подсчет десквамированных эндотелиоцитов (ДЭЦ) по методу Hladovec, 1978г. Всем больным проводили стандартные клинические и биохимические исследования, исследовали уровень прокальцитонина (ПКТ) в крови (полуколичественный иммунохроматографический экспресс-тест BRAHMS PCT-Q), исследовали концентрацию С-рективного протеина (СРП).
Тяжесть состояния оценивали по шкале прогноза SAPS II. Выраженность клинических синдромов абдоминального сепсиса оценивали в баллах на основании характеристик, предложенных Е.Б. Гельфандом в 1999 г.: наличие 2 и менее критериев СВР – 1 балл, наличие 3 критериев СВР – 2 балла, наличие 4 критериев ‒ 3 балла, тяжелый сепсис – 4 балла, септический шок – 5 баллов [3]. Исследования выполняли в первые 10 дней от начала заболевания и далее с интервалом в 5–7 дней.
Исследование полиморфизма гена NOS3 выполнено у 39 пациентов с ОП. В качестве группы сравнения выбраны 80 практически здоровых лиц, проходивших ежегодный профилактический осмотр на базе НУЗ «ОКБ на ст. Пермь II ОАО «РЖД». Из них 42 – мужчины (52,5 %) и 38 – женщины (47,5 %). Группа сравнения сопоставима с исследуемой по полу (точный критерий Фишера двусторонний, р = 0,16). Полиморфизм NOS3 исследовали на приборе «ДТ96» с помощью набора «ДНК-технология» (Москва).
Результаты обработаны при помощи пакета программ Statistica 6.0 Microsoft. Для описания полученных количественных признаков использовались среднее арифметическое (М) и среднее квадратичное отклонение (σ). Для проверки значимости различий применялись непараметрические критерии Mann‒Whitney, Wilcoxon, Фишера, метод Пирсона (х)2. Связь признаков оценивалась при помощи регрессионного анализа с определением коэффициента ранговой корреляции Спирмена (r). Различия между выборками считались статистически достоверными при значении для р < 0,05.
Результаты исследования и их обсуждение
Пациенты группы без СО (n = 18) находились в стационаре 11,5 ± 6,7 суток, поступали через 3,83 ± 2,85 суток от начала заболевания. Пациенты группы с СО (n = 24) находились в стационаре 33,0 ± 28,8 суток. Они были госпитализированы через 4,95 ± 4,65 суток от начала заболевания. Тяжесть состояния пациентов с ОП в двух группах оценивали с применением традиционных клинических и лабораторных методов (табл. 1).
Таблица 1
Лабораторные и клинические показатели тяжести состояния больных ОП
|
Показатели |
Группа ОП (n = 42) |
Группа без ОС (n = 18) |
Группа с СО (n = 24) |
р |
|
SAPS II (баллы) |
23,43 ± 12,41 |
15,94 ± 7,36 |
29,25 ± 13,36 |
р < 0,001 |
|
Тяжесть СВР (баллы) |
2,38 ± 1,88 |
0,55 ± 0,70 |
3,87 ± 1,11 |
р < 0,0001 |
|
Полуколичественный ПКТ-тест (нг/мл) |
4,26 ± 4,24 |
0,20 ± 0,27 |
4,53 ± 4,26 |
р = 0,002 |
|
CРП, (мг/л) |
227,41 ± 167,01 |
195,4 ± 123,9 |
255,9 ± 183,6 |
p = 0,33 |
Примечание: р – значимость различий между группой без СО и группой с СО.
Достоверные отличия между группами больных ОП выявлены по шкале SAPS II, по тяжести СВР, по ПКТ-тесту. Концентрация СРП в подгруппах значимо не отличалась.
При поступлении у всех 42 пациентов с ОП провели исследование ВЭФР и ДЭЦ сыворотке крови (табл. 2). Выявлено достоверное увеличение в крови маркеров поражения эндотелия как при наличии, так и в отсутствие септических осложнений.
Выявлена прямая корреляционная связь между двумя маркерами повреждения эндотелия ВЭФР и ДЭЦ: r = 0,342 (95 % ДИ 0,330 и 0,348, р = 0,026). Уровень ВЭФР и количество ДЭЦ у больных ОП в обеих группах достоверно выше, чем в группе здоровых. Достоверной разницы между группами больных в показателях ВЭФР и ДЭЦ в первые 10 суток от начала заболевания не выявлено.
Таблица 2
Уровни ВЭФР и ДЭЦ плазмы крови больных ОП при поступлении
|
Показатели |
Группа здоровых (n = 13) |
Группа ОП (n = 42) |
Группа без СО (n = 18) |
Группа с СО (n = 24) |
р4 |
|||
|
М ± σ |
М ± σ |
р1 |
М ± σ |
р2 |
М ± σ |
р3 |
||
|
ВЭФР (пг/мл) |
144,7 ± 97,7 |
517,2 ± 619,3 |
0,0002 |
668,7 ± 852,8 |
0,046 |
498,0 ± 364,9 |
0,0001 |
0,442 |
|
ДЭЦ (104/л) |
3,02 ± 1,2 |
17,4 ± 11,8 |
0,0001 |
16,9 ± 8,9 |
0,0001 |
17,7 ± 13,7 |
0,0005 |
0,898 |
Примечание: р1 – значимость отличий в группах здоровых и больных ОП; р2 – значимость отличий в группах здоровых и больных ОП без СО; р3 – значимость отличий в группах здоровых и больных ОП с СО; р4 – значимость отличий в группах больных ОП с СО и без СО.
У 5 пациентов с ОП наступил летальный исход (11,9 %), уровень ВЭФР при поступлении у них был 420,36 ± 197,87 пг/мл, достоверной разницы с группой без СО не выявлено (Mann‒Whitney тест р = 0,63) и с выжившими в группе с СО не выявлено (Mann‒Whitney тест, р = 0,64) (рис. 1).
Полученные результаты уровня ВЭФР сыворотки крови в группах больных ОП сходны с полученными у аналогичных групп больных острой пневмонией, представленными в статье Yao Yang и др. (2011) (http://creativecommon.org/licenses/by/2.0). Нами не выявлено взаимосвязей между маркерами повреждения эндотелия и тяжестью СВР, SAPS II, полуколичественным ПКТ-тестом в первые в первые 10 суток заболевания, отмечена корреляция средней силы между ВЭФР и С-реактивным белком в группе с СО: r = –0,47 (95 % ДИ –0,45 и –0,48, р = 0,02).
Исследование маркеров эндотелиальной дисфункции проведено в динамике у 33 больных. Пациенты группы без СО (n = 13) находились в стационаре 11,23 ± 4,47 суток, поступали через 4,38 ± 2,98 суток от начала заболевания. Тяжесть общего состояния при первом исследовании у пациентов первой группы по шкале SAPS II составила 16,23 ± 8,09 баллов, через 7 дней 13 ± 5,68 баллов, (Wilcoxon тест p = 0,012).Уровень ВЭФР при первом исследовании составил 815,8 ± 895,4 пг/мл, через 7 суток повысился до 938,9 ± 984,1 пг/мл.
По результатам исследования ВЭФР в динамике в группе без СО выделено две подгруппы. В 1 подгруппу включены 9 больных, у которых за наблюдаемый период времени (7 суток) уровень ВЭФР в сыворотке крови повысился с 331,43 ± 305,91 пг/мл до 796,72 ± 366,74 пг/мл, (Wilcoxon тест, p = 0,007). Во 2 подгруппу вошли четверо больных, у которых при первом исследовании выявлен высокий уровень ВЭФР – 1905,85 ± 818,08 пг/мл, через 7 дней у всех он снизился до 1319,4 ± 564,9 пг/мл, но был выше, чем в 1 подгруппе при втором исследовании (рис. 2).
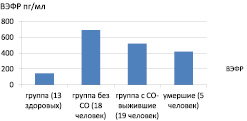
Рис. 1. Уровень ВЭФР в группе сравнения и в группах больных ОП
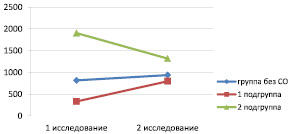
Рис. 2. Динамика изменений уровня ВЭФР (пг/мл) у пациентов группы без СО
Отличие в динамике изменений уровня сывороточного ВЭФР в подгруппах можно объяснить временем взятия проб от начала заболевания. В 1 подгруппе 1 исследование проведено в основном в первые 5 суток от начала заболевания за исключением 2 случаев на 8 и 9 сутки. Во 2 подгруппе 1 исследование выполнено с 7 по 10 сутки от начала заболевания. В этот период времени наблюдался разгар клинических проявлений панкреатита, и уровень ВЭФР в 3 случаях из 4 превышал 2000 пг/мл. К моменту взятия последующей пробы у этих пациентов наступил регресс клинической симптоматики, и уровень ВЭФР сыворотки снизился по сравнению с 1 исследованием, но в целом остался выше, чем в 1 подгруппе. Выявлена корреляция между уровнем ВЭФР сыворотки крови и временем от начала заболевания у больных группы без СО: r = 0,47 (95 % ДИ 0,454 и 0,485, р < 0,02). Количество ДЭЦ при 1 исследовании было 18,7 ± 9,4∙104/л, во 2 исследовании показатель составил 14,3 ± 7,7∙104/л, достоверной разницы между ними не выявлено. Корреляционной связи между уровнем ВЭФР, количеством ДЭЦ, тяжестью СВР и состоянием по шкале SAPS II в соответствующие периоды исследований в группе без СО не установлено.
При исследовании динамики изменений уровней ВЭФР сыворотки крови у пациентов группы без СО выявлено, что максимальный подъём этого фактора развивается к 7–14 дням заболевания. В дальнейшем он снижается на фоне отсутствия у пациентов прогрессирования деструкции поджелудочной железы и гнойно-септических осложнений. Всем больным в этой группе проводилась консервативная терапия ОП. Исходами заболевания были: остаточная инфильтрация железы и парапанкреатической клетчатки в 8 случаях и формирование псевдокисты в 5 случаях. Из полученных результатов можно заключить, что прогрессивное нарастание уровня ВЭФР в сыворотке крови больных ОП к концу 2-й недели заболевания свидетельствует об адекватной, достаточной регенерации и имеет благоприятное прогностическое значение.
Пациенты группы с СО (n = 20) находились в стационаре 36,8 ± 29,9 суток. Они были госпитализированы через 4,13 ± 3,52 суток от начала заболевания. Тяжесть общего состояния у пациентов второй группы по шкале SAPS II составила 23,1 ± 10,3 баллов при первом исследовании, достоверная разница с 1 группой (Mann‒Whitney тест, р < 0,05). Количество ДЭЦ в 1 исследовании в группе с СО было 18,4 ± 14,9∙104/л, во 2 исследовании показатель составил 16,3 ± 10,1∙104/л, достоверной разницы между исследованиями и группами не выявлено. Корреляционной связи между количеством ДЭЦ и тяжестью СВР и состоянием по шкале SAPS II в соответствующие периоды исследований в группе с СО не установлено.
При поступлении уровень ВЭФР сыворотки крови составил 535,47 ± 380,57 пг/мл, достоверной разницы с первой группой не выявлено. По результатам исследования уровня ВЭФР сыворотки крови в динамике в группе с СО выделено две подгруппы: в первую вошли пациенты, у которых уровень ВЭФР возрастал, во вторую у которых уровень ВЭФР снижался или оставался на прежнем уровне (рис. 3).
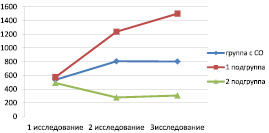
Рис. 3. Динамика изменений уровня ВЭФР (пг/мл) в группе с СО
В 1 подгруппу включены 11 больных, у которых после первого исследования уровень ВЭФР сыворотки крови поднялся с 574,02 ± 444,88 до 1237,43 ± 734,11 пг/мл, (Wilcoxon тест, p = 0,003). У 5 больных выполнено 3 исследование, при котором выявлено, что уровень ВЭФР еще более увеличился по сравнению с уровнем во 2 исследовании и составил 1501,44 ± 721,97 пг/мл, (Wilcoxon тест, p = 0,04). При 2 исследовании в первой подгруппе по шкале SAPS II состояние больных улучшилось с 23,54 ± 11,27 баллов до 18,18 ± 6,53 баллов. При 1 исследовании выраженность клинических проявлений СВР составляла 2,9 ± 0,9 баллов, при 2 исследовании 2,1 ± 1,07 баллов. Все пациенты в этой подгруппе были оперированы, и на фоне лечения наступил регресс деструктивных изменений с исходом в остаточную инфильтрацию поджелудочной железы и в инфильтрацию с формированием псевдокист. Достоверной разницы между группами с и без СО в уровнях ВЭФР плазмы крови у больных первых подгрупп не выявлено ни в первом (Mann‒Whitney тест, р = 0,08), ни во втором исследовании (Mann-Whitney тест, р = 0,13).
Во 2 подгруппу включены 9 больных, у которых отмечено снижение уровня ВЭФР плазмы крови с 488,34 ± 303,39 до 277,52 ± 171,76 пг/мл (Wilcoxon тест, p = 0,03). Уровень ВЭФР в плазме крови при 2 исследовании у этих пациентов достоверно отличался от уровня в группе без СО и от уровня в 1 подгруппе группы с СО (Mann‒Whitney тест, р < 0,002). Снижение уровня ВЭФР в сыворотке крови у больных во 2 подгруппе было отмечено на фоне утяжеления проявлений сепсиса. При первом исследовании выраженность клинических проявлений СВР составляла 2,8 ± 1,05 баллов, при 2 исследовании ‒ 3,7 ± 1,4 баллов. По шкале SAPS II состояние больных 2 подгруппы ухудшилось с 22,5 ± 12,3 баллов до 26,0 ± 12,3 баллов при 2 исследовании. У 7 больных в этой подгруппе выполнено 3 исследование, при котором уровень ВЭФР поднялся до 305,27 ± 284,17 пг/мл, тяжесть СВР уменьшилась до 2,85 ± 1,57 баллов, состояние по шкале SAPS II улучшилось до 23,4 ± 11,7 баллов.
Во второй подгруппе 3 из 9 пациентов погибли на фоне инфекционно-токсического шока и прогрессирующей полиорганной недостаточности. У всех выживших наблюдалось повышение уровня ВЭФР в сыворотке крови в следующие третьем или четвертом исследованиях. У 5 больных исходом панкреонекроза были остаточная инфильтрация поджелудочной железы и формирующиеся псевдокисты, у одного больного сформировался абсцесс сальниковой сумки. Выявлена обратная корреляция между тяжестью сепсиса и уровнем ВЭФР сыворотки крови у пациентов группы с СО: r = –0,38(95 % ДИ –0,372 и –0,387, р = 0,003). Высчитан коэффициент корреляции между тяжестью сепсиса и уровнем ВЭФР сыворотки крови у всех обследованных пациентов в обеих группах: r = -0,29 (95 % ДИ –0,275 и –0,295, р = 0,006). Сравнение коэффициентов корреляции r1 – второй группы и r2 – всех больных из обеих групп: r1 = –0,38, r2 = –0,29, N1–57, N2–102, p = 0,556.
Пациенты с нарастающим уровнем ВЭФР имеют благоприятный прогноз, так как при имеющемся объёме деструктивных поражений и уровне эндотоксикоза организм формирует ограничительный барьер вокруг очагов деструкции, эндотелий сохраняет регуляторную способность, поэтому оперативное лечение можно откладывать до появления визуализируемой секвестрации. Это позволит максимально сократить число оперативных вмешательств у больного или секвестрированный очаг деструкции удалить локальным доступом. Снижение ВЭФР сыворотки крови при ОП говорит о недостаточной функции эндотелия и может служить маркером развития СВР. Это также свидетельствует о том, что в сложившихся условиях организм больного не способен выстроить полноценный ограничительный барьер вокруг очагов деструкции. В дальнейшем это приводит к прорыву медиаторов и эндотоксинов из очага воспаления в системный кровоток и вызывает расширение зоны повреждения и утяжеление СВР.
Проведено исследование распределение генотипов и аллелей NOS3 в контрольной группе и у больных острым панкреатитом (табл. 3).
Таблица 3
Распределение аллелей и генотипов гена NOS3(T894G) в группах пациентов ОП
|
Группы |
Генотипы гена NOS3 |
аллели |
|||
|
GG |
GT |
TT |
G |
T |
|
|
Больные ОП (n = 39) |
21 (53,84 %) |
16 (41,02 %) |
2 (5,13 %) |
58 (74,4 %) |
20 (25,6 %) |
|
Группа ОП без СО (n = 17) |
11 (64,7 %) |
5 (29,4 %) |
1 (5,9 %) |
27 (79,5 %) |
7 (20,5 %) |
|
Группа ОП с СО (n = 22) |
10 (45,45 %) |
11 (50 %) |
1 (4,54 %) |
31 (70,4 %) |
13 (29,6 %) |
|
Группа здоровых (n = 80) |
41 (51,25 %) |
32 (40 %) |
7 (8,75 %) |
114 (71,3 %) |
46 (28,7 %) |
Распределение генотипов NOS3 в группе ОП (n = 39) совпало с распределением в группе здоровых: метод Пирсона (МП), х2 = 0,495, р = 0,78. Также не установлено достоверных отличий в распределении генотипов между здоровыми и группами без СО и с СО: МП х2 = 1,02, р = 0,59 и х2 = 0,914, р = 0,63 соответственно. В группе с СО преобладают гетерозиготы GT – 50 %, в группе без СО преобладают гомозиготы GG – 64,7 %, но статистически достоверной разницы между этими группами не выявлено из-за малого размера выборок: МП х2 = 1,68, р = 0,43. Распространенность патологического аллеля Т у больных ОП составила 25,6 %, что соответствует распространенности в группе здоровых 28,7 % (точный критерий Фишера двусторонний, р = 0,64). Тенденцию к увеличению гетерозигот NOS3 за счет патологического аллеля Т можно рассматривать как фактор, влияющий на развитие септических осложнений при ОП тяжелого течения.
Распределение генотипов NOS3 в группах рассмотрели также по гендерному признаку. Достоверных различий в распределении у мужчин и женщин у здоровых и больных ОП не выявлено, как и достоверных различий в распределении генотипов среди мужчин в обеих группах.
Выводы
1. Уровень ВЭФР сыворотки крови и количество ДЭЦ достоверно повышены у больных ОП по сравнению со здоровыми людьми, но различий между группами с наличием и отсутствием септических осложнения не выявлено.
2. Выявлена обратная корреляция между тяжестью сепсиса и уровнем ВЭФР сыворотки крови у пациентов группы с септическими осложнениями по результатам динамического исследования.
3. Маркер повреждения эндотелия – ВЭФР ‒ при динамическом исследовании применим для прогнозирования развития септических осложнений при ОП. Снижение уровня ВЭФР сыворотки крови или отсутствие его повышения свидетельствует об утяжелении СВР, неэффективности лечебных мероприятий и имеет неблагоприятное прогностическое значение.
4. Уровень ПКТ при наличии СО достоверно выше, чем у больных без СО, но он не обладает при ОП прогностическим значением, так как не коррелирует с ВЭФР.
5. Тенденцию к увеличению гетерозигот гена NOS3 в положении 849 G > T за счет патологического аллеля Т можно рассматривать как фактор, влияющий на развитие септических осложнений при остром панкреатите тяжелого течения.
Рецензенты:
Мухамадеев И.С., д.м.н., заместитель главного врача по хирургии, ГБУЗ ПК «Пермская краевая клиническая больница», г. Пермь;
Устинова О.Ю., д.м.н., профессор кафедры экологии человека и безопасности жизнедеятельности Пермского государственного национального исследовательского университета, г. Пермь.
Работа поступила в редакцию 23.08.2013.
Библиографическая ссылка
Загородских Е.Б., Черкасов В.А., Щёкотова А.П. МАРКЕРЫ ЭНДОТЕЛИАЛЬНОЙ ДИСФУНКЦИИ И ИХ ПРОГНОСТИЧЕСКОЕ ЗНАЧЕНИЕ ПРИ ОСТРОМ ПАНКРЕАТИТЕ ТЯЖЕЛОГО ТЕЧЕНИЯ // Фундаментальные исследования. 2013. № 9-3. С. 355-361;URL: https://fundamental-research.ru/ru/article/view?id=32353 (дата обращения: 28.02.2026).



