В настоящее время согласно статистическим данным сердечно-сосудистые заболевания занимают первое место по уровню и количеству летальных исходов [3]. Одной из категорий, связанной с нарушением работы деятельности сердца, являются аритмии, такие состояния, при которых нарушаются одна или обе главные характеристики нормального ритма сердца – регулярность и частота. Для лечения данного рода заболеваний используют следующие виды высокотехнологичных операций: имплантацию электрокардиостимулятора, радиочастотную аблацию и изоляцию устьев легочных вен [1].
Выполнение операций на сердце требует особых условий: специального оснащения медицинским оборудованием и инструментами, адекватной предоперационной подготовки, правильного послеоперационного лечения.
Имплантация электрокардиостимулятора представляет собой хирургическую процедуру, при которой выполняется небольшой разрез в подключичной области, и в области сердца устанавливается кардиостимулятор (данный вид операций используется для устранения брадиаритмий).
Метод радиочастотной аблации применяется при лечении тахиаритмий и представляет собой устранение дополнительных путей или аномальных водителей ритма путем радиочастотного воздействия на участок сердца, являющийся причиной возникновения аритмии.
Выбор данных методов лечения больных с нарушениями ритма сердца в настоящее время обусловлен их высокой эффективностью, относительной безопасностью, минимальной травматичностью [1, 5].
Следует тем не менее отметить, что при выполнении описанных процедур могут возникнуть послеоперационные осложнения, вероятность наступления которых в свою очередь оказывает непосредственное влияние на длительность послеоперационного лечения, для оценки которой могут быть использованы математические модели, ориентированные на решение этого класса задач.
В настоящем исследовании были использованы сведения об операциях по устранению аритмий, выполненных в хирургическом отделении Архангельской областной клинической больницы за период с 2011 по март 2012 г.
Для построения модели проведено одномоментное (поперечное) проспективное исследование, в ходе которого были проанализированы данные о 345 прооперированных пациентах в возрасте от 20 до 88 лет, из них мужчин 42 %, женщин 58 %. В структуре операций наибольшая доля приходится на имплантацию электрокардиостимулятора ‒ 52,2 %, на долю радиочастотной аблации 31 % и изоляции – 22 % соответственно.
Подчинение количественных данных закону нормального распределения оценивалось с помощью статистического критерия χ2-Пирсона. Сравнение двух разных групп по количественным признакам в условиях подчинения данных закону нормального распределения проводилось с использованием t-критерия Стьюдента для независимых выборок. Проверка нулевой гипотезы о равенстве всех средних в исследуемых группах осуществлялась с использованием однофакторного дисперсионного анализа. Информативность включенных в модель для выполнения дискриминантного анализа показателей оценивалась с использованием статистического F-критерия Фишера. Разработка автоматизированного программного модуля по прогнозированию длительности послеоперационного лечения осуществлялась с использованием среды визуального программирования «Borland Delphi 7».
Было установлено, что основную категорию пациентов, нуждающихся в оперативном лечении нарушений ритма сердца, составляют женщины в возрасте от 61 до 75 лет (в среднем 68 ± 7 лет). Среди сопутствующих фоновых заболеваний у пациентов наибольшую долю составляют артериальная гипертензия 52 %, а также ишемическая болезнь сердца 45 %. Операция по первичной имплантации электрокардиостимулятора была проведена у 78 % пациентов, в остальных 22 % случаев стимулятор подлежал замене.
С использованием однофакторного дисперсионного анализа на первом этапе были выявлены основные факторы, влияющие на длительность послеоперационного стационарного лечения. Результаты позволили установить, что чем больше у пациента сопутствующих (фоновых) заболеваний, тем длительнее его пребывание в стационаре. Так, при наличии 3 фоновых заболеваний длительность послеоперационного лечения оказалась достоверно большей и составляла в среднем 9 ± 3 дней, при наличии у пациента одного заболевания – 6 ± 2 дней (p < 0,05).
При выполнении процедуры радиочастотной аблации пациенты с пароксизмальной тахикардией и желудочковой экстрасистолией находились на лечении достоверно дольше (10 ± 3 дней), чем пациенты с трепетанием предсердий (5 ± 2 дней) – (p < 0,05).
Наличие осложнений в послеоперационном периоде после имплантации электрокардиостимулятора оказывает прямое влияние на длительность лечения, увеличивая данный показатель практически в 2 раза (в среднем 14 ± 5 дней). Отмечена зависимость длительности лечения от продолжительности операции радиочастотной аблации: при длительности операции более 90 минут данный показатель составил 9 ± 2 койко-дней, в пределах 1,5 часов – 7 ± 2 койко-дней, менее 1 часа – 5 ± 1 койко-дней. Кроме того, было выявлено, что значительное влияние на длительность послеоперационного лечения оказывает интраоперационный эффект и наличие послеоперационных осложнений. При успешном проведении операции радиочастотной аблации и отсутствии последующих осложнений длительность лечения составляет в среднем 6 ± 2 дней, в альтернативном варианте – длительность лечения увеличивается в 2 раза (в среднем 13 ± 4 дней) (p < 0,05).
Длительность лечения пациентов, у которых наблюдался рецидив аритмии после выполнения операции по изоляции устьев легочных вен, составила в среднем 17 ± 6 дней, что превышает показатели длительности пребывания пациентов в кардиологическом отделении практически в 2 раза (в среднем 9 ± 3 дней) (p < 0,05).
Результаты дискриминантного анализа показали, что при операции имплантации электрокардиостимулятора наиболее информативными для автоматического распознавания длительности послеоперационного лечения являются этиологические причины заболевания и возникшие в послеоперационном периоде осложнения.
При выполнении операции радиочастотной аблации информативными для прогноза длительности стационарного лечения оказались длительность рентгеноскопии, наличие интраоперационного эффекта и послеоперационнные осложнения; при операции изоляции устьев легочных вен: продолжительность операции и рентгеноскопии, а также возникшие осложнения.
Таким образом, нами были выявлены основные факторы риска, оказывающие существенное влияние на длительность послеоперационного лечения, каждому из которых был присвоен весовой коэффициент значимости, выражаемый в баллах (от 1 до 3). Далее было проведено ранжирование совокупности выделенных факторов, область допустимых значений которых была разделена на баллы по степени их выраженности. Все наблюдения в исходной базе данных были преобразованы в матрицы ранговых оценок.
На основании составленных матриц (с учетом весовых коэффициентов) для каждого пациента были рассчитаны значения целевых функций, которые количественно отражают степень влияния факторов риска на длительность стационарного послеоперационного лечения.
Значение целевой функции рассчитывали по формуле
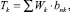
где Wk – весовой коэффициент значимости фактора риска (в баллах); bnk – элемент матрицы оценок параметров факторов риска.
Статистический анализ совокупности рассчитанных значений целевых функций позволил выделить 5 уровней, характеризующих длительность стационарного послеоперационного лечения пациента (таблица).
Диапазоны значений целевых функций, характеризующих длительность послеоперационного лечения пациента
|
Степень риска |
Вид операции |
Диапазон значений |
|
Низкая |
Имплантация электрокардиостимулятора |
≤ 16 |
|
Радиочастотная аблация |
≤ 9 |
|
|
Изоляция устьев легочных вен |
≤ 10 |
|
|
Пониженная |
Имплантация электрокардиостимулятора |
16–20 |
|
Радиочастотная аблация |
9–10 |
|
|
Изоляция устьев легочных вен |
10–13 |
|
|
Средняя (нормальная) |
Имплантация электрокардиостимулятора |
20–30 |
|
Радиочастотная аблация |
10–12 |
|
|
Изоляция устьев легочных вен |
13–21 |
|
|
Повышенная |
Имплантация электрокардиостимулятора |
30–35 |
|
Радиочастотная аблация |
12–14 |
|
|
Изоляция устьев легочных вен |
21–24 |
|
|
Высокая |
Имплантация электрокардиостимулятора |
≥ 35 |
|
Радиочастотная аблация |
≥ 14 |
|
|
Изоляция устьев легочных вен |
≥ 24 |
Рассчитанные диапазоны значений целевых функций использовали при создании автоматизированного программного модуля для прогнозирования длительности стационарного послеоперационного лечения.
Разработанный нами программный модуль позволит врачу-кардиологу вводить в программу показатели выполняемых операций на сердце и на их основании получать результат о принадлежности пациента к одной из степеней риска, предоставляя информацию о наиболее вероятном по длительности периоде послеоперационного лечения.
Полученные нами на первом этапе результаты позволили выявить наиболее значимые факторы риска, влияющие на длительность послеоперационного лечения, которые в последующем были положены в основу расчетов по прогнозированию итогового показателя с использованием дискриминантных уравнений и разработанной авторской модели [2, 3, 4].
Следует также отметить, что результаты моделирования подтверждаются расчётными значениями точности для прогнозируемых периодов длительности лечения. Так, для распознавания длительности послеоперационного лечения при имплантации электрокардиостимулятора показатель точности решающих правил составил 87 %, для операции радиочастотной аблации – 83 %, для операции изоляции устьев легочных вен 84 %. Средний показатель точности составил 84,7 %, что отражает удовлетворительное качество полученной модели, которая может служить дополнительным методом прогноза длительности лечения конкретного пациента.
Таким образом, созданный модуль для прогнозирования длительности стационарного послеоперационного лечения, основанный на статистическом исследовании имеющихся данных о пациентах, позволит врачу сформировать вывод о степени риска поступившего больного и в соответствии с полученной информацией скорректировать тактику дальнейшего лечения.
Разработанный автоматизированный программный модуль прогнозирования длительности стационарного послеоперационного лечения позволит выявить риски для пациентов на предмет вероятности возникновения осложнений после оперативных вмешательств, а также позволит определить в дальнейшем степень влияния этих рисков на использование коечного фонда и финансирования высокотехнологичных операций за счет средств обязательного медицинского страхования.
Рецензенты:
Калинин А.Г., д.м.н., профессор кафедры общественного здоровья и здравоохранения, ГБОУ ВПО СГМУ Минздрава России, г. Архангельск;
Болдуев В.А., д.м.н., доцент, доцент кафедры гистологии, цитологии и эмбриологии, ГБОУ ВПО СГМУ Минздрава России, г. Архангельск.
Работа поступила в редакцию 15.08.2013.
Библиографическая ссылка
Басова Л.А., Карякина О.Е., Кочорова Л.В., Мартынова Н.А. РОЛЬ ПРОГНОСТИЧЕСКИХ МОДЕЛЕЙ В ПОВЫШЕНИИ КАЧЕСТВА МЕДИЦИНСКИХ УСЛУГ // Фундаментальные исследования. 2013. № 9-3. С. 323-326;URL: https://fundamental-research.ru/ru/article/view?id=32346 (дата обращения: 28.02.2026).



