В настоящее время ингибиторы 3-гидрокси-3-метил-глутарил-СоА редуктазы (ГМГ-CоА), так называемые статины, наиболее эффективны в отношении снижения уровня холестерина в крови и смертности от атеросклероза и ишемической болезни сердца [12]. Однако у большинства статинов эффективная терапевтическая суточная доза, равная 20-80 мг, обусловливает возникновение нежелательных побочных эффектов – гепатотоксичности, миалгии, миопатии и рабдомиолиза [10]. Учитывая то, что применение статинов является пожизненным, риск развития нежелательных побочных осложнений существенно возрастает. Поэтому поиск новых статинов с более низкой суточной дозой, более безопасных и эффективных в отношении снижения уровня атерогенного холестерина остается актуальной проблемой медицинской химии и фармакологии.
Одним из современных подходов к созданию новых лекарственных соединений является использование известных фармакологических субстанций в виде комплексов с природными комплексонами, в частности, с глицирризиновой кислотой (ГК).
Помимо сообщений о собственной биологической активности ГК [2, 3, 6] к настоящему времени накоплено большое количество экспериментальных данных о способности ГК усиливать биодоступность других лекарственных препаратов при совместном применении [9, 13]. Наряду с увеличением растворимости многих гидрофобных лекарственных соединений в присутствии ГК наблюдается значительное усиление эффективности, а в некоторых случаях и изменение механизма терапевтического действия [11, 14]. Так, ранее было продемонстрировано усиление лекарственного эффекта бутадиона, индометацина, нифедипина и ряда других лекарств при использовании их в комплексах с ГК [4, 9, 13]. Что касается статинов, к настоящему времени получен и исследован только комплекс ГК с симвастатином [11, 14]. Создано новое комплексное соединение симвастатина с глицирризиновой кислотой – симваглизин, для которого характерно снижение терапевтической дозы в несколько раз, что указывает на большую безопасность симваглизина в сравнении с симвастатином.
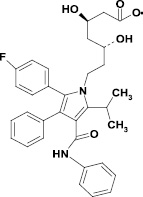
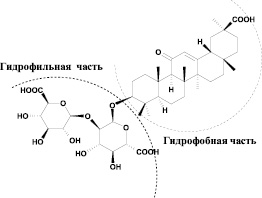
Рис. 1. Структурные формулы аторвастатина и глицирризиновой кислоты
Целью настоящей работы является исследование возможностей ассоциации другого холестеринснижающего препарата – аторвастатина (АТС) с глицирризиновой кислотой методом ЯМР-релаксации. Данный метод основан на высокой чувствительности времени спин-решеточной Т1 и спин-спиновой Т2 релаксации к межмолекулярному взаимодействию и к диффузионной подвижности молекул [5]. Образование ассоциатов (комплексов включения, мицелл и т.д.) приводит к существенному сокращению времен релаксации протонов из-за изменения времен вращательной корреляции молекул τс в ассоциате. В свою очередь, τс, в соответствии с известным соотношением Стокса–Эйнштейна–Дебая: τс = 4πa3η/3kT, зависит от радиуса молекулы (а) и вязкости среды (η). Включение молекулы в состав ассоциата (комплекс, мицелла) может приводить к изменению обоих параметров. Особенно перспективным применение метода ЯМР-релаксации считается в случае, когда, как в исследуемой системе, различие химических сдвигов ассоциированной и свободной молекул минимально [5].
Материалы и методы исследования
Глицирризиновая кислота получается экстракцией из корня солодки уральской, как описано в [7]. Комплексы готовились путем смешения метанольных растворов ГК и АТС с водой в объемном соотношении 1:4, а также в буферном растворе (5 мМ HEPES в D2O). Варьирование кислотности раствора производилось добавкой DCl или KOD в буферный раствор. Дейтерированные растворители для записи спектров ЯМР: метанол CD3OD (99,7 % D, Sigma-Aldrich), вода D2O (99,9 % D, Aldrich); и аторвастатин – (R(R*R*))-2-(4-фторфенил)-β-,Δ-дигидрокси-5-(1-метилэтил)-3-фенил-4-((фениламино)карбонил)-1Н-пиррол-1-гептановой кислоты кальциевая соль (USP) использовались без дополнительной очистки.
1Н ЯМР-спектры в растворах регистрировались на спектрометре фирмы «Брукер» DPX-200 на частоте 200 МГц. Измерение времен фазовой релаксации Т2 проводилось с использованием стандартной последовательности Карра–Парселла–Мейбума–Гилла (КПМГ) вида: Р1(90°) – (τ – Р2(180°) – τ)n – регистрация, где τ = 0,6 ms – фиксированная временная задержка, а n варьировалась от 0 до 2048.
Временные зависимости скоростей релаксации в системах, где в растворе имеются свободные молекулы, а также включенные в состав ассоциатов, как правило, описываются одной или двумя экспонентами [5].
В случае медленного обмена между молекулами, находящимися внутри ассоциата и вне его, в эксперименте наблюдается биэкспоненциальная кинетика спада сигнала эха,
A(t) = P1∙exp(–t/T21) + P2∙exp(–t/T22),
где Т21 и Т22 соответствуют временам релаксации молекул гостя в связанном и свободном состоянии. Быстрая компонента P1 соответствует доле молекул, находящихся в ассоциате, а медленная P2 – доле молекул в растворе. Такая картина обычно наблюдается для комплексов гидрофобных молекул. В ситуации, когда молекулы в ассоциате и в растворе находятся в состоянии быстрого обмена (по сравнению со временем релаксации), изменение сигнала ЯМР при варьировании задержки между импульсами описывается моноэкспоненциальным законом. В этих условиях наблюдаемая величина времени релаксации является суперпозицией величин Т21 и Т22.
1/Tobs = P1/T21 + (1 – P1)/T22.
Результаты исследования и их обсуждение
Добавление водно-спиртового раствора глицирризиновой кислоты к спиртовому раствору аторвастатина приводит к выпадению осадка и уменьшению интенсивности линий статина в ЯМР спектре (рис. 2).
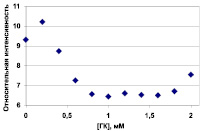
Рис. 2. Изменение растворимости АТС (в относительных единицах) в водном растворе (рН = 4,6), содержащем 20 % метанола, в зависимости от концентрации ГК. Относительная концентрация АТС в данном эксперименте определялась по интегральной интенсивности ароматических протонов аторвастатина. Исходная концентрация АТС составляла 0,5 мМ. Погрешность приведенных данных составляет 0,5 в относительных единицах
С другой стороны, обнаружено также уменьшение интенсивности линий протонов ГК в присутствии АТС. Объяснить уменьшение концентрации обоих реагентов, АТС и ГК, при их смешении можно, если предположить, что между АТС и ГК происходит реакция обмена. Продуктами реакции обмена между кальциевой солью АТС и кислотой (ГК) должны быть свободная кислота АТС и кальциевая соль ГК. При этом известно, что кислота АТС и кальциевая соль ГК имеют худшую растворимость, чем кальциевая соль АТС и свободная глицирризиновая кислота. Кроме того, согласно [8], анионная форма ГК не образует ассоциатов. Судя по уменьшению относительной интенсивности ароматических протонов АТС (рис. 2), его концентрация в растворе уменьшилась как минимум на 30 % (0,15 мМ). Таким образом, необходимо принимать во внимание, что из–за реакции обмена анионом кальция с АТС, реальные концентрации ГК также меньше исходных, которые приведены на рисунках, по крайней мере, на 0,15 мМ.
Для того чтобы проверить возможность ассоциации свободной кислоты АТС с ГК, нами были измерены времена спин-спиновой релаксации протонов АТС в водно-спиртовом растворе в отсутствии и в присутствии ГК в различных концентрациях (рис. 3).
На рис. 4 представлена зависимость скорости релаксации ароматических протонов АТС от концентрации ГК.
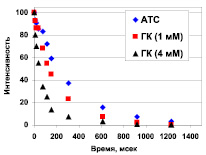
Рис. 3. Кинетика спада сигнала ЯМР в эксперименте КПМГ. Измерение времени релаксации проводилось для ароматических протонов АТС при исходной концентрации АТС 0,5 мМ и нескольких концентрациях ГК в 20 % водно-метанольном растворе (рН = 4,6)
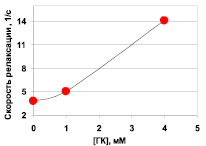
Рис. 4. Зависимость скорости релаксации ароматических протонов АТС от концентрации ГК в водно-метанольном растворе при рН 4,75. Погрешность расчета скорости релаксации составляет 10 %
Прогрессивное значительное увеличение скорости релаксации протонов АТС с ростом концентрации ГК в растворе указывает на ассоциацию статина с ГК. При этом временная зависимость сигнала ЯМР чистого АТС (Т2 = 325 ± 27 мс) и АТС в присутствии 1 мМ ГК, (Т2 = 201 ± 11 мс) описываются моноэкспонентой, тогда как кривая, записанная для 4 мМ ГК, демонстрирует биэкспоненциальную зависимость c Т21 = 7,4 ± 5,5 и Т22 = 84,3 ± 7,5 мс. Таким образом, судя по временам релаксации в присутствии 4 мМ ГК наблюдается медленный обмен между двумя типами ассоциатов. Необходимо отметить, что для водно-спиртовых растворов ГК с помощью двух независимых методов: динамического ЯМР и гельпроникающей хроматографии, обнаружено существование мицелл [1, 8]. Поскольку мицеллообразование ГК начинается уже с концентрации 0,5 мМ [8], резонно предположить, что наблюдаемые при 4 мМ ассоциаты АТС с ГК – это два типа мицелл. При этом время Т21 = 7,4 ± 5,5 близко ко времени релаксации самой ГК, находящейся в составе мицеллы (Т2(ГК) = 9,7 ± 4 мс [8]). Такая близость времен релаксации характерна для ассоциатов, в которых гость и хозяин вращают как одно целое. Что касается укорочения времени релаксации АТС примерно на 40 %, происходящего в присутствии 1 мМ ГК, то это, скорее всего, результат включения АТС в состав более мелких самоассоциатов ГК (димеры, тетрамеры), описанных в литературе [9].
Заключение
Таким образом, в настоящей работе исследована ассоциация аторвастатина – одного из лидеров мирового рынка среди антигиперлипидемических препаратов – с глицирризиновой кислотой. Обнаружено, что кальциевая соль аторвастатина вступает в реакцию обмена с глицирризиновой кислотой с образованием нерастворимой кальциевой соли ГК и кислотной формы аторвастатина. Кислотная форма АТС образует ассоциаты с ГК.
Рецензенты:
Душкин А.В.., д.х.н., руководитель группы механохимии органических соединений Института химии твердого тела и механохимии СО РАН, г. Новосибирск;
Верещагин Е.И., д.м.н., профессор, заведующий кафедрой анестезиологии и реаниматологии Новосибирского государственного медицинского университета, г. Новосибирск.
Работа поступила в редакцию 15.08.2013.
Библиографическая ссылка
Шлотгауэр А.А. ИССЛЕДОВАНИЕ ВЗАИМОДЕЙСТВИЯ АТОРВАСТАТИНА С ТРИТЕРПЕНОВЫМ ГЛИКОЗИДОМ ГЛИЦИРРИЗИНОВОЙ КИСЛОТОЙ МЕТОДОМ ЯМР РЕЛАКСАЦИИ В РАСТВОРАХ // Фундаментальные исследования. 2013. № 10-3. С. 553-556;URL: https://fundamental-research.ru/ru/article/view?id=32317 (дата обращения: 10.03.2026).



