Использование аллилового спирта (АС) и синтез-газа (СО + Н2) для получения 1,4-бутандиола (1,4-БД), который широко используется в производстве полиуретанов, полибутилентерефталата, полиэфирных материалов и специальных растворителей [1, 3], является одним из новых способов получения важного мономера, особенно в связи с использованием гомогенных катализаторов, позволяющих значительно легче управлять процессом оксосинтеза.
Ранее были изучены [4–5, 8] закономерности гидроформилирования аллилового спирта с учетом основных параметров процесса: давления, температуры, состава синтез-газа и концентрации катализатора в рабочих интервалах: Робщ = 0,6–1,2 МПа, t = 25–130 °С, СО + Н2 = 2:1 до 1:3 и СRh = 1,6–6,5 ммоль/л. Нами рассмотрено влияние условий проведения реакции на ее скорость и селективность. Кинетические исследования проводились с использованием гомогенного родиевого катализатора и третичного фосфина в качестве лигандной добавки.
На основании экспериментально полученных данных [5] была принята схема механизма и составлена кинетическая модель реакции гидроформилирования аллилового спирта. Из составленных кинетических выражений следовало, что все скорости имели первый порядок по катализатору и дробные – по концентрации аллилового спирта, водорода и окиси углерода, причем эти порядки изменялись в течение реакции в пределах 0–1, что подтверждалось полученными экспериментальными данными.
Из данных по определению констант скоростей элементарных стадий для различных температур реакции следовало, что лимитирующей стадией образования гидроксиальдегидов являлась стадия присоединения аллилового спирта к комплексу родия.
В связи с этим весьма интересным является исследование влияния структурных и других особенностей аллилового спирта на его координацию и возможность направленного присоединения к родиевому катализатору, естественно, с учетом влияния действия и устойчивости к окислению, применяемых лигандных добавок третичных фосфинов.
Цель работы – исследование возможности влияния строения и структурных конформаций аллилового спирта на скорость реакции и селективность образования основных и побочных продуктов его гидроформилирования.
Материалы и методы исследования
Материалы и методы исследования использовались аналогично описанным ранее в работе [5]. Гидроформилирование проводили на установке оксосинтеза. В металлический реактор объемом 30 мл помещали 20 мл толуольного раствора с 0,05 г (2,7 ммоль/л) HRh(CO)(PPh3)3 и 0,21 г (40,0 ммоль/л) PPh3, а также 1 мл (0,735 моль/л) АС и выдерживали при нагревании в заданных условиях и компенсации постоянного давления синтез-газа в течение 1,5 часов. Протекание реакции фиксировалось по поглощению синтез-газа, анализ продуктов и контроль за ходом реакции осуществлялся методом ГЖХ на приборе «Цвет-102» с пламенно-ионизационным детектором на составных колонках ПЭГ-20М на хроматоне N-AW и апиезон-L на хроматоне N-AW с диметиловым эфиром диэтиленгликоля (диглим) в качестве внутреннего стандарта.
Результаты исследования и их обсуждение
Аллиловый спирт является уникальным α-олефином, одним из наиболее реакционно-способных в реакции гидроформилирования с использованием родиевого катализатора, модифицированного фосфинами. Получение 4-гидроксибутиральдегида (ГБА), который переходит в 2-окситетрагидрофуран (2-ОТГФ), имеющий более устойчивую форму и являющийся целевым продуктом при взаимодействии АС с СО + Н2, обычно сопровождается уменьшением селективности в результате образования 2-метил-3-гидроксипропионового альдегида (ГМПА), а также пропионового альдегида (РrНО) и пропанола (РrОН), за счет изомеризации и гидрирования аллилового спирта.
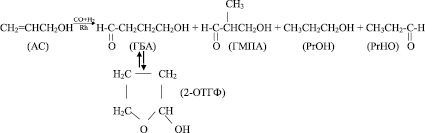
В чем же проявляются особенности аллилового спирта? В соответствии с электронным строением, атом кислорода гидроксильной группы аллилового спирта имеет sp3-гибридизацию. Средние длины связей 0,143 нм (С–О) и 0,091 нм (О–Н). Обе связи полярны. Однако принято считать их в значительной мере поляризованными электроотрицательным атомом кислорода [2].
Относительно высокие значения температуры кипения и диэлектрической проницаемости аллилового спирта объясняют полярностью ОН-группы и ее способностью образовывать водородные связи. Кислород является более электроотрицательным элементом по сравнению с углеродом, и поэтому электронная плотность смещена в сторону кислорода. Дипольный момент ОН-группы равен 5,5∙1028 Кл∙м. Функциональная группа спиртов содержит электроотрицательный атом кислорода с двумя неподеленными парами электронов. Его конфигурация близка к тетраэдрической и показана на рис. 1. Гидроксильная группа в молекуле аллилового спирта отдалена от двойной связи, поэтому в данном соединении не наблюдается сопряжения двойной π-связи с заместителем.
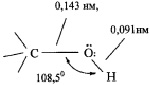
Рис. 1. Фрагмент конфигурации спирта
Квантово-химический расчет пяти наиболее вероятных конформаций молекулы аллилового спирта показал, что наиболее энергетически выгодной является цис, Н-гош форма [7], в которой атом кислорода находится в одной плоскости с углеродным скелетом в непосредственной близости к двойной связи, и, следовательно, молекула спирта находится в «скрученном» состоянии, как показано на рис. 2. При этом, как следует из расчетов, в условиях реакции (t = 70–90 °С) наибольший процент содержания аллилового спирта (79,6 %) приходится на эту цис, Н-гош конформацию.
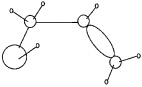
Рис. 2. Фрагмент цис, Н-гош конформации АС
Следует отметить, что при ИК-спектральном исследовании гидроформилирования аллилового спирта и гексена-1, с использованием кюветы-реактора в присутствии каталитической системы, состоящей из HRh(CO)(PPh3)3 и Ph3P под давлением СО и Н2 (Р = 2 МПа) при 70–80 °С в среде тетрахлорэтана, было показано появление для аллилового спирта смещенной частоты ацильной группы (νµСО = 1588 см–1) в низкочастотной области наряду с основной частотой колебания ацильной группы (νµСО = 1644 см–1). Эта частота характерна и для гексена-1, но у него при этом наблюдается смещенная частота в высокочастотной области (νµСО = 1664 см–1), при одинаковых колебаниях частот (νСО = 1980 и 1960 см–1) концевых карбонильных групп при Rh и для гексена-1 и для аллилового спирта [6].
Это свидетельствует о том, что при рассмотрении механизма протекания реакции гидроформилирования аллилового спирта, одновременно с образованием обычного промежуточного ацильного каталитического комплекса родия (А3), происходит частичное образование промежуточного шестичленного изоацильного каталитического комплекса (А’3) за счет водородной связи О–Н-группы с кислородом ацильной группы.
С учетом вышеизложенного для описания механизма реакции гидроформилирования АС на основании полученных нами экспериментальных и литературных данных [5] была принята схема механизма реакции гидроформилирования аллилового спирта (рис. 3).
Поскольку при гидроформилировании аллилового спирта в условиях протекания реакции (t = 70–90 °С) образуется ~ 80 % 4-гидроксибутиральдегида (ГБА), обычно через промежуточную стадию образования ацильного комплекса родия (А3), существует большая вероятность того, что присоединение аллилового спирта к каталитическому родиевому фрагменту в этом промежуточном комплексе (А2) должно проходить при координации его в виде наиболее энергетически выгодной: цис, Н-гош – форме, которая как указывалось выше, также составляет в условиях реакции ~ 80 %.
Тогда, следует, что при присоединении аллилового спирта к каталитическому родиевому фрагменту при формировании комплекса (А’2) с координацией АС в виде энергетически менее выгодной транс-конформации в дальнейшем происходит образование промежуточного шестичленного изоацильного каталитического комплекса родия (А’3), энергетически возможного при участии водородной связи О–Н-группы и последующее образование в условиях реакции гидроформилирования АС соответственно продукта изо-строения: метил-3-гидроксипропиональдегида (ГМПА), а также пропионового альдегида.
Следует отметить, что образование пропионового альдегида (РrНО) происходит в основном через ацильный комплекс (А’3), а образование пропанола (РrОН) может протекать через ацильные комплексы (А3) и (А’3). В результате дегидратации изомерного альдегида возможно образование еще одного побочного продукта реакции – метакролеина (МА).
Предполагается, что более детальное исследование влияния структурных конформаций аллилового спирта и условий перехода одной его формы в другую, в первую очередь, транс- в цис-конформацию, поможет поиску возможных путей увеличения селективности по линейному альдегиду: 4-гидроксибутиральдегиду (ГБА) и снижению образования побочных продуктов реакции гидроформилирования АС.
Важное значение при этом будет иметь предварительная подготовка аллилового спирта к использованию для гидроформилирования. Она должна будет включать не только проведение его очистки от микропримесей, дезактивирующих родиевый катализатор, но и создание условий получения и сохранения более выгодной конформационной структуры аллилового спирта, которая, вероятно, оказывает влияние на формирование промежуточного интермедиата определенной структуры при присоединении аллилового спирта к активному HRh(CO)(PR1R2R3)2 – каталитическому фрагменту. Естественно, что подбор оптимального лигандного окружения, его конфигурации и количественного соотношения компонентов в каталитической системе, а также влияние условий проведения реакции при этом важны и приоритетны.
Таким образом, повышению соотношения н/изо альдегидов, должно способствовать, с одной стороны, действие реагентов, препятствующих образованию и стабилизации изоацильного комплекса, т.е. активных по отношению ОН- группе субстрата или кислороду ацильной группы, с другой стороны, введение соединений, способных несколько ускорять разрушение изоциклической структуры.
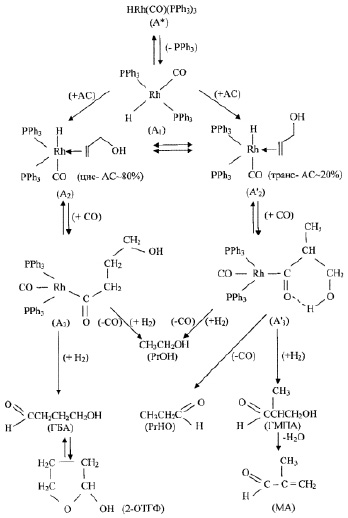
Рис. 3. Схема механизма реакции гидроформилирования аллилового спирта
Действительно, использование при гидроформилировании аллилового спирта в качестве растворителей соединений с полярными группами (например, кетоновых растворителей ацетофенона и 2-ундеканона, диметиацетамида и др.), которые не способствуют образованию изоацильных комплексов, приведенное в патенте фирмы Texaco Inc [9] повышает селективность до 96 % по альдегиду нормального строения, который переходит в 2-окситетрагидрофуран (2-ОТГФ), (катализатор: HRh(CO)(PPh3)3 с избытком Ph3P, 50–80 °С и Р = 49–63 МРа).
Также показано [7], что при добавлении к родиевому катализатору солей органических кислот (NaOR), катионы которых могут взаимодействовать с кислородом ацильной группы и препятствовать стабилизации изоацильного комплекса, повышается селективность гидроформилирования [HRh(CO)(PPh3)3 + Ph3P, растворитель толуол, Na/Rh(мол.) = 100, 70 °С, Р = 0,6 МПа]. Однако при этом алкоголяты способствуют ускорению изомеризации аллилового спирта в пропионовый альдегид.
Аналогично Al(acac)3 в присутствии Rh(acac)(СО)2 (растворитель толуол, 90 °С, Р = 6 МПа) также повышает селективность по целевому продукту (2-ОТГФ) в реакции гидроформилирования [7] в результате взаимодействия Rh c координированной ОН-группой субстрата, но при этом способствует гидрированию аллилового спирта в пропиловый спирт. В обоих случаях на протекание побочных процессов значительное влияние оказывают парциальные давления водорода окиси углерода.
Интересно отметить, что в патенте компании Lyondell Chemical Technology, L.P. [10], показана очень высокая селективность образования альдегида нормального строения (96–99 %, н/изо = 16,5–23,1) при гидроформилировании аллилового спирта в присутствии Rh(acac)(СО)2 в изопропаноле (90 °С, Р = 4 МПа) с использованием третичных фосфинов сложного строения с азотсодержащими радикалами типа: 6-бис(3,5-диалкилфенил) фосфино-N-пивалоил-2-аминопиридина или 3-бис(3,5-диалкилфенил)фосфино-2Н-изохинолин-1-она. Однако практическое применение затрудняется сложностью получения таких фосфинов, а использование в качестве растворителя спиртов может усложнять пути рециркуляции и регенерации каталитической системы.
Заключение и выводы
При рассмотрении механизма протекания реакции гидроформилирования аллилового спирта показано, что одновременно с обычным ацильным комплексом родия происходит частичное образование промежуточного шестичленного изоацильного комплекса за счет водородной связи О–Н-группы с кислородом ацильной группы.
Показана возможность влияния строения и структурных конформаций аллилового спирта, в частности, цис-, Н-гош конформации на координацию АС и образование разных конфигураций промежуточных изоацильных комплексов, которые могут соответственно по-разному влиять на скорость реакции и селективность образования основных и побочных продуктов гидроформилирования аллилового спирта.
Повышению соотношения н/изо альдегидов способствует введение реагентов, препятствующих образованию и стабилизации изоацильного комплекса, а также способных ускорять разрушение изоциклической структуры, однако при этом увеличивается образование побочных продуктов изомеризации и гидрирования аллилового спирта.
Рецензенты:
Аверьянов В.А., д.х.н., профессор, кафедра органической и биологической химии, ФГБОУ ВПО «Тульский государственный педагогический университет им. Л.Н. Толстого», г. Тула;
Шахкельдян И.В., д.х.н., профессор, декан факультета естественных наук, ФГБОУ ВПО «Тульский государственный педагогический университет им. Л.Н. Толстого», г. Тула.
Работа поступила в редакцию 15.08.2013.
Библиографическая ссылка
Каверин В.В. ОСОБЕННОСТИ ГИДРОФОРМИЛИРОВАНИЯ АЛЛИЛОВОГО СПИРТА // Фундаментальные исследования. 2013. № 10-3. С. 543-547;URL: https://fundamental-research.ru/ru/article/view?id=32315 (дата обращения: 10.03.2026).



