В настоящее время синтетические полиэлектролиты играют важную роль в науке, технике, медицине. При этом наблюдается постоянное расширение сфер применения и использования полимеров этого класса. Важное место в ряду синтетических полиэлектролитов занимают полимеры и сополимеры на основе диаллильных мономеров, которые могут быть использованы в качестве коагулянтов, флокулянтов, структураторов почв, при производстве бумаги, в текстильной промышленности и нефтедобыче, дубящими агентами при производстве кож, а также для очистки питьевых и сточных вод [4, 6]. Развитие различных отраслей народного хозяйства выдвигает перед наукой и промышленностью новые задачи по расширению ассортимента полиэлектролитов, которые обладали бы целым комплексом ценных свойств, в том числе и комплексообразующими. Актуальность проблемы состоит в исследовании возможности вступать в реакции комплексообразования водорастворимого полиэлектролита поли-N,N-диаллиламиноэтановой кислоты, содержащиго свободные карбоксильные группы с ионами переходных металлов. Связано это не только с технологиями концентрирования и выделения ионов металлов из растворов и водоочистки, но также и с проблемами создания биологических систем. Медь и кобальт называют «металлами жизни», комплексы которых с аминокислотами используют в составе металлоферментов, обеспечивающих нормальный ход огромного числа биохимических реакций, связанных с явлениями кроветворения.
В связи с этим целью работы являлось исследование комплексообразующих свойств поли-N,N-диаллиламиноэтановой кислоты на ионы меди и кобальта при низких концентрациях полимера и ионов металлов в растворе, установлению на ее основе закономерностей влияния химического строения полимера, состава комплекса, природы иона, рН среды, концентрации реагента, времени стояния растворов спектофотометрическим методом.
Экспериментальная часть
Поли-N,N-диаллиламиноэтановую кислоту получали алкилированием α-аминоэтановой кислоты хлористым (бромистым) аллилом в водно-спиртовом растворе [2, 5]. Исследования комплексообразующих свойств поли-N,N-диаллиламиноэтановой кислоты с ионами кобальта и меди при различных значениях рН среды, концентрации реагента и время стояния растворов проводили согласно методике [1].
Результаты исследования и их обсуждение
Комплексообразующие свойства гомополимера поли-N,N-диаллиламиноэтановой кислоты (пДААУК, с ММ = 14000) были исследованы спектрофотометрическим методом с использованием водных растворов солей низкомолекулярных электролитов CuSO4 и CoCl2 на катионы Cu2+ и Со2+.
Комплексообразующие свойства на катионы Сu2+ и Со2+ в водных растворах исследовали определением зависимости оптической плотности растворов от длин волны и зависимости оптической плотности от концентрации реагента (водный раствор полимера).
Исследование зависимости оптической плотности от длин волны проводили приготовлением серии растворов в интервале концентрации солей металлов 0,01–0,1 М, 0,1–1 %-го раствора полимера, раствора комплекса, рН растворов приближали к кислотности раствора комплекса с реагентом (R). В этих условиях были определены максимальные значения длин (λмах) оптической плотности (А) водных растворов и комплекса, где на зависимостях появлялся один пик поглощения, математическая обработка результатов производилась методом наименьших квадратов (рис. 1–4). Как видно из рис. 1, 2, максимальные значения λмах находятся в интервале λмах = 590–625 нм для ионов Сu2+ и λмах = 450–480 нм для ионов Со2+. Исследование зависимости оптической плотности от концентрации реагента проводили в выбранных оптимальных условиях λмах, pH = const увеличением концентрации реагента для полноты связывания ионов металлов в исследуемый комплекс. Для этого приготовили серию растворов и определили значения оптической плотности, затем построили график зависимости D = f(c).
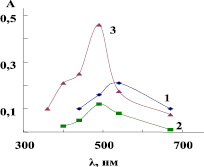
Рис. 1. Зависимость оптической плотности раствора от длины волны: 1 – 0,01 М раствор соли кобальта CoCl2; 2 – раствор полимера; 3 – раствор комплекса
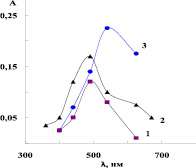
Рис. 2. Зависимость оптической плотности раствора от длины волны: 1 – 0,01 М раствор соли меди CuSO4; 2 – раствор полимера; 3 – раствор комплекса
Из рис. 3, 4 видно, что для комплексообразования раствора соли требуется такое количество реагента, равное значению на оси абсцисс соответствующее точке перегиба. Это минимальное количество реагента, необходимое для полного связывания определяемого иона металла в комплекс.
Зависимости оптической плотности от концентрации водных растворов солей, фиксированых значений рН среды (2 и 10), а также времени стояния раствора (48 часов) носили линейный характер, что свидетельствует о подчинении анализируемого вещества закону Бугера‒Ламберта‒Бера [3]. Увеличение концентрации полимера в раствор соли приводит к увеличению интенсивности полосы поглощения, при этом интенсивность растет с повышением концентрации полимера. Увеличение и некоторое смещение максимума поглощения существенно влияет на полноту связывания ионов металла в комплекс. Дальнейшие исследования зависимости оптической плотности от концентрации водорастворимого полимера проводили в выбранных оптимальных условиях(λмах = 490нм для ионов Co+2 и λмах = 625 нм для ионов Cu+2, при рН = 5–6) при увеличении концентрации полимера.
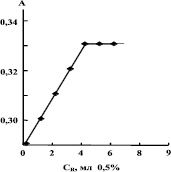
Рис. 3. Зависимость оптической плотности растворов комплекса от концентрации реагента для Co+2
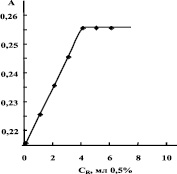
Рис. 4. Зависимость оптической плотности растворов комплекса от концентрации реагента для Cu+2
Как видно из рис. 3, 4, с увеличением концентрации реагента оптическая плотность растет во всех рассмотренных случаях до определенных значений и далее остается постоянной величиной, что свидетельствует об образовании устойчивого комплекса. Каждый двухвалентный ион металла взаимодействует с двумя свободными карбоксильными группами, образуя хелатные связи, что характерно для d-элементов (схема).
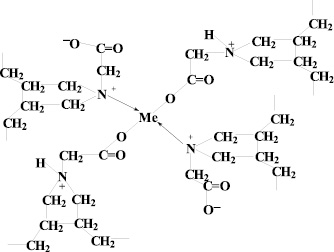
Схема
Для дальнейшего изучения комплекса пДААУК с Cu+2 и комплекса пДААУК с Cо+2 продукт взаимодействия был выделен в твердом виде осаждением его из водного раствора в десятикратный избыток ацетона. Высушенный осадок представляет собой твердое вещество серо-зеленого цвета в случае с Cu+2 и светло-сиреневого цвета в случае с Co+2.
Сравнение ИК-спектров продукта взаимодействия полимера с ионами металлов и полимера показывает, что пДААУК в основном строение полимера не претерпевает существенных изменений, однако наблюдается некоторое смещение полос поглощения. Спектр пДААУК (рис. 5) содержит все полосы, характерные для замещенного пирролидинового цикла, кроме того, интенсивная полоса 1578 см–1 принадлежит карбоксилат аниону, а слабые полосы в области 2830–2940 см–1 относятся к аммониевому катиону. Широкая интенсивная полоса в области 3440 см–1 указывает на присутствие в образце небольшого количества воды.
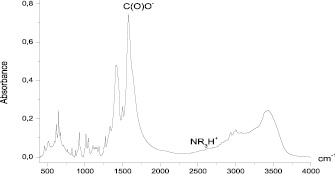
Рис. 5. ИК-спектр поли-N,N-диаллиламиноэтановой кислота (пДААУК) – т. KBr ф 9561
На ИК-спектре выделенного комплекса пДААУК с Cu+2 слабо проявляется ион SO4–2 в области 1100–1050 см–1, интенсивная полоса 1578 см–1, которая принадлежит карбоксилат аниону, смещена в область полосы 1630 см–1 и имеет достаточно высокую интенсивность и сложный контур, что свидетельствует о взаимодействии ионов Cu+2 с молекулами полимера (рис. 6).
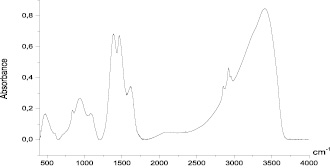
Рис. 6. ИК-спектр выделенного комплекса пДААУК с Cu+2 – т. KBr ф 9561
Спектр комплекса пДААУК с Cо+2 (рис. 9) почти идентичен спектру комплекса пДААУК с Cu+2 в области поглощения карбоксилат иона, однако наблюдается нарушение относительных интенсивностей полос в области 1700–1350 см–1. Кроме того, заметно изменение в области 1000–1100 см–1, что указывает на образование комплекса за счет взаимодействия карбоксильных групп с ионами кобальта.
Выводы
1. Анализ спектрометрических данных свидетельствует о том, что синтезированный водорастворимый полиэлектролит поли-N,N-диаллиламиноэтановая кислота обладает достаточно высокими комплексообразующими свойствами на двухвалентные катионы металлов Cu+2 и Cо+2.
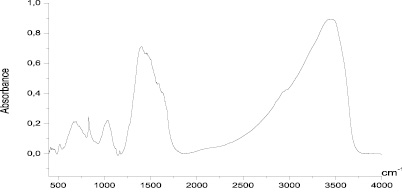
Рис. 7. ИК-спектр выделенного комплекса пДААУК с Cо+2 – т.KBr ф 9561
2. Установлена возможность регулирования процесса комплексообразования поли-N,N-диаллиламиноэтановой кислоты с катионами металла в широком интервале внешних условий.
Авторы благодарят сотрудников ЦКП «Рентгеновская диагностика материалов» и НОЦ «Полимеры и композиты» при КБГУ им. Х.М. Бербекова за оказанную помощь в проведении исследовании.
Рецензенты:
Беев А.А., д.х.н., профессор, зав. кафедрой химии Кабардино-Балкарской государственной сельскохозяйственной академии им. В.М. Кокова, г. Нальчик;
Утижев А.З., д.с.-х.н., профессор, Кабардино-Балкарская государственная сельскохозяйственная академия им. В.М. Кокова, г. Нальчик.
Работа поступила в редакцию 25.07.2013.
Библиографическая ссылка
Бегиева М.Б., Малкандуев Ю.А., Хараев А.М., Мамбетова Ф.А. ИССЛЕДОВАНИЕ КОМПЛЕКСООБРАЗУЮЩИХ СВОЙСТВ ПОЛИ-N,N-ДИАЛЛИЛАМИНОЭТАНОВОЙ КИСЛОТЫ НА ИОНЫ КОБАЛЬТА И МЕДИ В ВОДНОМ РАСТВОРЕ // Фундаментальные исследования. 2013. № 10-3. С. 534-538;URL: https://fundamental-research.ru/ru/article/view?id=32313 (дата обращения: 29.01.2026).



