Многочисленными исследованиями подтверждено, что гипоталамус относится к основным структурам, обеспечивающим последовательность нейроэндокринных изменений при стрессе и стресс-реактивность организма [2, 4, 9, 12]. К наиболее активным и в то же время наиболее уязвимым гипоталамическим структурам при стрессе были отнесены паравентрикулярное (PV) и супраоптическое (SO) ядра [6, 11].
Менее изученным остается вопрос о типологических особенностях строения гипоталамуса, в основе которых лежит генетически детерминированное своеобразие молекулярных механизмов трофики, сигнального управления и специфической функции нейронов и глиальных клеток. Именно они в совокупности определяют итоговый баланс нейромедиаторов и триггерных гормонов стресса (прежде всего – кортиколиберина и АКТГ), интенсивность местных процессов и системных нейро-иммуно-эндокринных взаимодействий, обеспечивая тем самым индивидуальную динамику ответа организма на стрессорное воздействия, обозначаемое как стресс-реактивность [6].
Цель исследования – выявить в эксперименте структурные основы различной стресс-реактивности на уровне фенотипических особенностей ядер переднего гипоталамуса.
Методы и материалы исследования
Эксперимент проводили на 32 нелинейных белых крысах породы Вистар массой от 220 до 240 г. При проведении работы руководствовались этическими нормами, изложенными в «Международном кодексе медицинской этики» (1994), Хельсинской декларации (2000) и Директивах Европейского сообщества 86/609EEC.
Уровень реактивности животных определяли как фенотипически устойчивое (конституциональное) свойство организма, используя два теста: по порогу болевой чувствительности [5] и по величине 30-минутного градиента температуры при действии малых доз (0,1 мг/кг внутрибрюшинно) липополисахарида S. Thyphimurium [7]. На основе совпадения результатов двух тестов было отобрано по 16 животных с высокой (ВР) и низкой реактивностью (НР). Хронический стресс моделировали путем 2-часовой иммобилизации через день в течение трех недель по 8 животных ВР и НР групп, остальные составили контрольные группы. Эвтаназию производили путем декапитации под легким эфирным наркозом, что обеспечивало минимальное повреждение тканей головного мозга [6]. Для оценки фазы и интенсивности стрессорной реакции определяли концентрации АКТГ и кортизола в сыворотке крови с помощью твердофазного иммуноферментного анализа. Использовали спектофотометр StatFax 2100, вошер StatFax 2600 (Awareness Technology, USA) и готовые наборы «Вектор-Бест» (Новосибирск, Россия).
Мозг разделяли фронтальной секцией через точку P0 в координатах Хорслей‒Кларка на два блока и готовили по 50 фронтальных срезов с задней поверхности переднего блока и 100 срезов – с передней поверхности заднего блока, что позволяло в полном объеме выявить цитоархитектонику SO, супрахиазматического (SCh) и PV ядра гипоталамуса [14]. Срезы окрашивали гематоксилином и эозином, а также по Нисслю [3]. Иммуногистохимическое исследование проводили готовыми наборами производства DakoCytomation (Дания) для выявления макрофагального антигена (окрашивает микроглиальные клетки) и кислого глиального протеина (визуализирует астроциты). Количественно определяли объемную долю нейронов (%), средние объемы ядер нейронов (мкм3), среднее число граничных нейронов и астроглиоцитов в окружении нейрона, а также коэффициент микроглия/нейрон. В условиях стресса также рассчитывали степень повреждения нейронов (по А.И. Чубинидзе в модификации [6], в баллах), общую потерю нейронов (%) и степень глиальной реакции, оцененную по приросту яркости в окраске на микроглиальные клетки (усл. ед.).
Результаты исследования и их обсуждение
SO визуализировалось в виде плотного овоидного скопления крупных нейронов, примерно по 50–60 клеток на срезе; SCh – как неравномерное скопление 30–40 полигональных нейронов средних и небольших размеров несколько каудальнее SO; PV – под эпендимой третьего желудочка в виде крупноклеточной части из 60–80 компактно сгруппированных нейроэндокринных клеток и мелкоклеточной части, расположенной более латерально. Данные количественного морфологического анализа представлены в табл. 1.
Таблица 1
Показатели морфометрии основных ядер переднего гипоталамуса крыс с различной реактивностью (M ± m)
|
Морфометрические показатели |
Реактивность |
|
|
Низкая |
Высокая |
|
|
Супраоптическое ядро |
||
|
Объемная доля нейронов, % Средний объем ядер нейронов, мкм3 Среднее число граничных нейронов в объеме Среднее число граничных астроцитов Коэффициент микроглия/нейрон |
36,2 ± 2,1 372,0 ± 18,9 13,9 ± 0,7 5,7 ± 0,4 5,53 ± 0,34 |
24,9 ± 1,3 * 452,0 ± 30,6 * 9,1 ± 0,6 6,1 ± 0,4 3,45 ± 0,23 * |
|
Супрахиазматическое ядро |
||
|
Объемная доля нейронов, % Средний объем ядер нейронов, мкм3 Среднее число граничных нейронов в объеме Среднее число граничных астроцитов Коэффициент микроглия/нейрон |
40,2 ± 2,5 169,3 ± 7,1 14,8 ± 1,1 4,6 ± 0,3 8,31 ± 0,57 |
48,4 ± 2,7 * 327,0 ± 11,8 * 15,3 ± 1,2 4,0 ± 0,3 5,01 ± 0,36 * |
|
Паравентрикулярное ядро |
||
|
Объемная доля нейронов, % Средний объем ядер нейронов, мкм3 Среднее число граничных нейронов в объеме Среднее число граничных астроцитов Коэффициент микроглия/нейрон |
47,5 ± 2,2 414,7 ± 30,1 17,7 ± 1,3 7,1 ± 0,4 8,12 ± 0,48 |
44,8 ± 1,9 435,8 ± 29,4 11,0 ± 0,6 * 4,6 ± 0,3 * 8,07 ± 0,48 |
Примечание. * – достоверные различия между группами.
Как видно из представленных данных, для SO животных ВР группы были характерны относительно большая объемная доля нейронов, размеры их ядер и коэффициент глия/нейрон, но меньшее число граничных нейронов. Количество граничных астроцитов в SO не различалось между группами. Для SCh крыс с ВР были характерны относительно более высокие объемная доля нейронов и средний объем ядер (в 1,92 раза больше, Р < 0,001), но относительно низкий коэффициент микроглия/нейрон. Количества граничных нейронов и граничных астроцитов практически не различались между собой. Объемная доля нейронов, средние размеры ядер клеток и коэффициент микроглия/нейрон в PV были сходными у животных ВР и НР групп. В то же время на один нейрон в PV животных ВР группы приходилось относительно меньше граничных нейронов и астроцитов. В целом наиболее яркие структурные отличия выявлены в SO и SCh, а минимальные – в PV (рисунок).
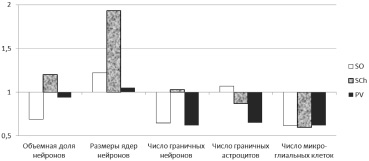
Особенности строения ядер переднего гипоталамуса, связанные с высокой реактивностью. За единицу принято значение показателя в НР группе животных
При анализе данных различий следует принимать во внимание такие ключевые моменты, как потенциальные функциональные возможности отдельных нейронов и сложность нейронного окружения, которая предполагает как серьезную синергию их деятельности, так и наличие защитно-трофических свойств нейроглии [7, 8, 10].
В совокупности выявленные особенности могут быть расценены как свидетельство относительно более сложной внутренней организации SO гипоталамуса и его относительно большей потенциальной резистентности к повреждающим воздействиям у животных с НР. У животных с ВР организация SO менее сложная, но его нейроны обладают признаками более интенсивных триггерных реакций при нейросекреторной регуляции гомеостаза. Для SCh можно говорить о примерно равных функциональных возможностях у животных с различной реактивностью, но при большей потенции SCh к триггерным реакциям у животных ВР группы, но большей резистентности к нагрузкам и повреждающим воздействиям – у животных с НР. В отношении PV крыс с ВР не выявлено структурных предпосылок к его большей активности или большей устойчивости к действию повреждающих факторов и функциональных перегрузок, в сравнении с аналогичным ядром у крыс НР группы.
Моделирование стресса сопровождалось у животных ВР группы снижением АКТГ крови до 1,25 ± 0,10 пг/мл (против 3,88 ± 0,31 пг/мл в контроле, P < 0,001) и повышением уровня кортизола до 27,05 ± 2,24 нмоль/л (против 18,09 ± 1,50 нмоль/л в контроле, P < 0,01), что расценено как начальная стадия истощения адреналовой (стрессорной) гормональной оси. Определено по уровню гормонов гипофизарно-надпочечниковой системы – АКТГ и кортизол. У животных НР группы после стресса в крови выявлено умеренно высокое количество АКТГ (4,13 ± 0,38 пг/мл против 3,03 ± 0,27 пг/мл в контроле) и крайне высокое содержание кортизола (93,72 ± 10,09 нмоль/л против 20,75 ± 1,86 нмоль/л, P < 0,001). Это соответствовало фазе напряжения острого стресса [9].
Стресс-индуцированное повреждение нейронов в значительной степени варьировало по глубине в различных ядрах переднего гипоталамуса. Данные морфометрии представлены в табл. 2.
У интактных животных степень повреждения нейронов составляла несколько процентов только в SO и PV, что было связано с наличием нейросекреции и была заметно большей у крыс ВР группы. Стресс-индуцированные изменения нейронов у животных ВР группы были достаточно интенсивными в SO (22 %) и PV (25,6 %) при явно меньшей степени повреждении нейронов SCh (9,4 %). У крыс НР группы степень повреждения нейронов оказывалась значительно меньше и не превышала 14,3 %. Общая потеря нейронов варьировалась в меньшей степени и составляла в среднем от 6,5 % (SCh) до 11,3 % (PV) в ВР группе и от 3,5 % (SCh) до 6,53 % (PV) – в НР группе. Выраженность глиальной реакции при стрессе была заметно выше у животных ВР группы.
Таким образом, в наибольшей степени при стрессе поражаются нейроны SO и PV, в наименьшей степени – SCh. Высокая реактивность является фактором, обеспечивающим за счет выявленных ранее структурных особенностей (относительно более сложная организация нейронного окружения и высокое микроглиальное представительство), относительно большие повреждения SO и SCh в сравнении с изменениями при стрессе в аналогичных ядрах переднего гипоталамуса у животных с НР.
Таблица 2
Количественные показатели повреждения основных ядер переднего гипоталамуса крыс с различной реактивностью при хроническом стрессе (M ± m)
|
Морфометрические показатели |
Реактивность |
|||
|
Низкая |
Высокая |
|||
|
Интактные |
Стресс |
Интактные |
Стресс |
|
|
Супраоптическое ядро |
||||
|
Степень повреждения нейронов, баллов Общая потеря нейронов, % Глиальная реакция, усл. ед. |
0,6 ± 0,1 0 7,8 ± 0,4 |
14,3 ± 1,1 * 3,2 ± 0,2 * 21,7 ± 1,4 * |
2,7 ± 0,2 # 0 10,6 ± 0,7 |
22,0 ± 1,2 *# 7,5 ± 0,5 *# 65,3 ± 4,5 *# |
|
Супрахиазматическое ядро |
||||
|
Степень повреждения нейронов, баллов Общая потеря нейронов, % Глиальная реакция, усл. ед. |
0 0 5,1 ± 0,3 |
3,8 ± 0,5 * 1,9 ± 0,1 * 11,6 ± 0,6 |
0 0 7,3 ± 0,5 * |
9,4 ± 0,2 *# 6,5 ± 0,4 *# 29,5 ± 1,7 *# |
|
Паравентрикулярное ядро |
||||
|
Степень повреждения нейронов, баллов Общая потеря нейронов, % Глиальная реакция, усл. ед. |
0,5 ± 0,1 0 8,9 ± 0,6 |
13,8 ± 1,4 * 6,5 ± 0,6 * 30,5 ± 2,2 * |
3,5 ± 0,2 # 0 8,6 ± 0,5 |
25,6 ± 1,3 *# 11,3 ± 0,9 *# 63,8 ± 4,1 *# |
Примечание. * – достоверные стресс-индуцированние изменения; # – между ВР и НР группами.
С учетом того, что описанные гипоталамические ядра напрямую связаны с реализацией нейроэндокринной программы стресса [1, 13], их относительно меньшая резистентность у животных с ВР позволяет предположить у таких животных более быстрое истощение механизмов стрессорного реагирования на соответствующие по силе воздействия окружающей среды.
Заключение
Одной из структурных основ генетически детерминированной (конституциональной) реактивности являются морфофункциональные особенности ядер переднего гипоталамуса. У лабораторных животных с высокой реактивностью выявлены структурные предикты более высоких триггерных свойств и активности SO и PV (в меньшей степени – SCh) в нейросекреторной регуляции гомеостаза при меньшей резистентности к действию факторов высокой интенсивности. Выявленные особенности являются основой вариабельности механизмов гомеостазирования и адаптивных реакций, обусловленными различиями в реактивности организма.
Рецензенты:
Яковлев А.Т., д.м.н., профессор, главный научный сотрудник, ФКУЗ «Волгоградский научно-исследовательский противочумный институт» Роспотребнадзора, г. Волгоград;
Ряднов А.А., д.б.н., доцент, заведующий кафедрой анатомии и физиологии животных, ФГБОУ ВПО «Волгоградский государственный аграрный университет», г. Волгоград.
Работа поступила в редакцию 15.08.2013.
Библиографическая ссылка
Постнова М.В., Новочадов В.В., Потанин М.Б. МОРФОФУНКЦИОНАЛЬНЫЕ ОСОБЕННОСТИ ЯДЕР ПЕРЕДНЕГО ГИПОТАЛАМУСА В ОБЕСПЕЧЕНИИ СТРЕСС-РЕАКТИВНОСТИ ОРГАНИЗМА // Фундаментальные исследования. 2013. № 10-2. С. 366-370;URL: https://fundamental-research.ru/ru/article/view?id=32285 (дата обращения: 21.02.2026).



