Механизмы радиационно-индуцированной клеточной смерти раковых клеток опосредуются изменением экспрессии большого числа генов и являются скоординированным клеточным ответом, ключевую роль в котором играет белок р53. P53 способен вызвать апоптоз клеток в ответ на повреждение ДНК [5]. Генетический анализ опухолевых клеток человека продемонстрировал ключевую роль р53 в подавлении онкологических процессов. Больше половины опухолей человека из всего широкого спектра типов несут мутации гена TP53, который кодирует белок 53, а наследование мутантного гена ТР53 делает его носителей предрасположенными к онкологическому синдрому Ли–Фраумени [6]. Мутация гена ТР53 затрагивает целый кластер других генов, экспрессия которых зависит от белка р53. Например, запуск p53-зависимого апоптоза связан с индукцией транскрипции компонентов как внешнего, так и внутреннего механизма клеточной смерти, включая такие белки, как BAX, FAS, NOXA и PUMA [7]. Известно, что мутации гена ТР53 приводят к существенным изменениям в механизме клеточного ответа на стрессовые воздействия, в частности, на радиационно-индуцированное увеличение внутриклеточной концентрации АФК. Опухоли с мутантным геном ТР53 обладают высокой радиорезистентностью и способностью к метастазированию, что, как полагают, связано с их генетической нестабильностью [9]. Результатом мутации гена ТР53 может стать разрушение нормальных и возникновение новых сетей экспрессирующихся генов, возникновение новых белковых взаимодействий, приводящих к появлению радиорезистентности.
Использование полно-транскриптомных методов анализа позволяет выявить группы, дифферециально-экспрессирующиеся в разных клеточных линиях в ответ на одно и тоже воздействие. Транскриптомные методы анализа приобретают решающее значение в изучении ответа нормальных и раковых клеток на внешние стрессовые воздействия, в частности, радиационное облучение. Один из способов изучения транскриптома основан на технологии гибридизационных ДНК-чипов высокой плотности. Основным достоинством технологии является возможность одновременного анализа экспрессии всей совокупности экпрессирующихся генов. Это в свою очередь позволяет изучать геном как целостную систему [3].
Целью настоящей работы стал поиск кластеров дифференциально-экспрессирующихся в раковых клетках с нормальным и мутантным геном ТР53 после генов скоординированная экспрессия генов, которых повторяет динамику изменения внутриклеточной концентрации АФК после радиационного облучения в раковых клетках с мутантным и нормальным по геном TP53.
Материал и методы исследования
В экспериментах использовали клеточные линии:
1) клеточная линия рака кишечника HCT-116 p53-/- (мутантная по гену ТР53);
2) клеточная линия рака кишечника HCT-116 p53+/+ (гены ТР53 дикого типа).
Клетки культивировали при 37 °С, во влажной атмосфере, содержащей 5 % СО2. Для культивирования использовали среду RPMI-1649 или DMEM, содержащую L-глутамин, 12 % фетальной коровьей сыворотки и 50 мкг/мл гентамицина. Клетки облучали рентгеновским излучением, генерируемым терапевтическим акселератором Cliniac 600 при комнатной температуре в дозах 4 Гр одноразово. Мощность дозы составляла 0,03 Гр/с, при фокусном расстоянии 104 см. Высота водяного столба над клетками составляла 1 см. Клетки облучались в 24 луночных планшетах (объём лунки 2,5 мл).
Профили экспрессии генов изучались с использованием гибридизационных ДНК-микроматриц высокой плотности серии HGU133A (Human Genome U133A) фирмы Affymetrix (Санта-Клара, Калифорния, США) через 15 мин, 12 и 24 часа после радиационного воздействия. РНК выделялось с использованием набора RNeasy Mini (Qiagen, США). Качество выделенной РНК оценивалось по целостности 18S и 28S рибосомальной РНК с использованием с помощью электрофореза в 1 % агарозном геле. Библиотека клонированных ДНК готовилась с использованием набора GeneChip Expression 3’-Amplification One-Cycle cDNA Synthesis Kit (Affymetrix). Мечение биотином антисмысловых библиотек клонированных РНК и очистка проводилась с использованием набора GeneChip Expression 3’-Amplification Reagents for IVT Labeling (Affymetrix). Матрица окрашивалась стрептовидин-фикоэритрином и сканировалась на сканере GeneAtlas System (Affymetrix, Санта-Клара, Калифорния, США) [1]. Обработка данных полученных после сканирования ДНК-микроматриц, проводилась с использованием алгоритмов MAS5.
Статистическая обработка данных экспрессии генов выполнялась с использованием программного пакета SAM (http://stat.stanford.edu/~tibs/SAM/). Для кластерного анализа и построения дендрограмм использовали программы Cluster 3.0 и TreeView. Принадлежность генов к тому или иному механизму репарации ДНК определяли по базе данных KEGG. Сравнительный анализ существующих взаимодействий среди белков выполнялся при помощи программы STRING 9.0 (доступна по адресу: – http://string-db.org).
Результаты исследования и их обсуждение
На рис. 1 представлены данные сравнительного кластерного анализа динамики транскриптома клеточных линий НСТ-116р53+/+ (с геном ТР53 дикого типа) и НСТ-116р53-/- (с мутированным геном ТР53). Из рис. 1 можно увидеть, что существует несколько кластеров генов динамика экспрессии, которые значительно отличаются между клеточными линиями НСТ-116р53+/+и НСТ-116р53-/-. 1-й кластер представлен 1 геном – RAB2A и PHF14 (группа 1, рис. 1). 2-й кластер генами NME5, SURF2, RRP15, TSFM, RNASEH2B, COPS8, DPH5, ALMS1, FBXO11, MDM1, C5orf54, CCNE2, BRIP1, QRSL1 и ERVMER34-1 (группа 2, рис. 1). 3-я группа генов представлена SREBF1, LTBP4, ZFAND5, GREB1, CENTP и GNAT3 (группа 3, рис. 1). Гены RAB2A и PHF14 в клетках линии НСТ-116р53+/+ имеют сниженную экспрессию по сравнению с контролем на протяжении всего эксперимента (1,12 и 24 ч), тогда как в клетках линии НСТ-116р53-/- их экспрессия значительно увеличена по сравнению с контрольной группой во всех временных точках. Эти гены не связаны между собой, и их продукты не вступают во взаимодействие. Ген RAB2A кодирует белок, относящийся к семейству онкогенов RAS. Его функции заключаются в транспорте комплекса RAS из эндоплазматического ретикулума в аппарат гольджи. Ген PHF14 кодирует белок с неясными функциями. Гены 2 кластера кодируют белки, относящиеся к различным сигнальным и метаболическим путям. Но все они имеют общий профиль экспрессии. В клетках линии НСТ-116р53+/+ с нормальным геном ТР53 через 1 час после радиационного воздействия их экспрессия подавлена в сравнении с контрольной группой. В клетках с мутантным геном ТР53 (линия НСТ-116р53-/-) экспрессия этого кластера генов увеличена, т.е. находится в противофазе по отношению к экспрессии этих же генов в линии НСТ-116р53+/+. Ген BRIP1 кодирует BRCA1, взаимодействующий белок С-концевой хеликазы 1.

Рис. 1. Дендрограмма, отражающая кластеризацию генов, дифференциально экпрессирующихся в клетках линии НСТ-116р53+ (с геном ТР53 дикого типа) и НСТ-116р53- (с мутантным геном ТР53) после облучения гамма-излучением. (Примечание. Чем темнее цвет, тем выше экспрессия гена по сравнению с контрольной группой. Достоверность отличий по отношению к контрольной группе установлена на уровне р < 0,05)
Он необходим для поддержания хромосомной стабильности. Участвует в репарации двойных разрывов ДНК путем гомологичной рекомбинации в манере, которая зависит от его связи с BRCA1 [8]. Ген NME5 кодирует белок, экспрессирующийся в неметастатических клетках. Наиболее важным, с нашей точки зрения, является набор генов CCNE2, RNASEH2B, COPS8 и BRIP1. Продукты этих генов ингибируют активность белка р53. В клетках с геном ТР53 дикого типа экспрессия этих генов подавлена в течении 1 часа после радиационного воздействия. Через 12 и 24 часа после облучения их экспрессия немного увеличена или не отличается от контрольной группы (рис. 1). В клетках линии НСТ-116р53-/- экспрессия этих генов на протяжении всего эксперимента является высокой по сравнению с контрольной группой.
В состав группы генов, объединенных в 3-й кластер, входят следующие гены: CENPT, GREB, ZFAND5, LTBP4, SREBF1 и GNAT3. Ген CENPT кодирует центромерный белок и является компонентом CENPA-NAC (нуклеосом-связанного) комплекса, который играет центральную роль в сборке кинетохорных белков, участвующих в процессе мейоза и сегрегации хромосом. Ген GREB1 кодирует эстроген-зависимый регулятор роста рака груди. Он является первичной мишенью в регуляции эстрогеновых рецепторов. Обладает функциями регулятора при гормон-зависимом росте рака груди и рака простаты. Ген ZFAND5 кодирует «цинковый палец», тип домена – AN1. Он может ингибировать активацию NF-kappa-B через сверхэкспрессию генов RIPK1 и TRAF6 и экспрессию фактора некроза опухолей TNF, IL-1 и TLR4-индуцировнную активацию NF-kappa-B на доз-зависимый манер. Сверхэкспрессия ZFAND5 делает клетки чувствительными к TNF-индуцированному апоптозу. Продукт гена ZFAND5 может быть также вовлечен в регуляцию активации NF-kappa-B и апоптоза [4]. Ген LTBP4 кодирует латентный трансформирующий фактор роста бета-связывающего белка 4. Продукт этого гена может быть задействован в сборке, секреции и доставки TGFB1 в сайты связывания, в которых они хранятся и/или активируются. Продукт этого гена может играть решающую роль в контроле активности TGFB1 и может иметь структурную роль во внеклеточном матриксе. Ген SREBF1 кодирует стерол-регуляторный элемент связывания транскрипционного фактора 1. Активатор транскрипции, необходимый для гомеостаза липидов, регулирует транскрипцию гена рецептора ЛНП, а также жирных кислот и в меньшей степени пути синтеза холестерина. Ген GNAT3-гуанин-нуклеотид связывающий белок (G-protein) играет важную роль в трансдукции горького и сладкого вкуса, а также в трансдукции вкуса однозамещенного глутамата натрия и инозинмонофосфата.
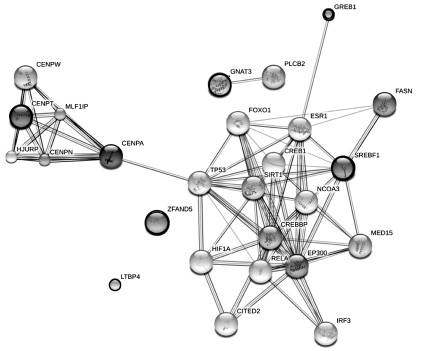
Рис. 2. Карта белковых взаимодействий генов, объединённых в 3-й кластер (рис. 1). Черной окантовкой выделены белки, гены которых были отобраны в результате кластеризации. Остальные белки отображены на карте для демонстрации взаимосвязей отобранных генов
Динамика экспрессии генов этой группы отличается больше всего среди 3-х найденных кластеров. В клетках линии НСТ-116р53-/- экспрессия этих генов снижена во всех временных точках, тогда как в клетках линии НСТ-116р53+/+ она повышена по сравнению с контрольной группой.
На рис. 2 представлена карта взаимодействия продуктов генов 3 кластера. Как видно из рисунка, в клетке формируется 1 белковый ансамбль, в котором участвуют продукты 3 генов, объединённых в 3-й кластер. Это гены GREB1, CENPT и SREBF1, которые связаны с активностью белка р53. Однако, исходя из функций этих генов, нельзя выявить их роль в процессах радиорезистентности. На роль генов, участвующих в развитии радиорезистентности, больше подходит ген ZFAND5. Его сверхэкспрессия делает клетки чувствительными к TNF-индуцированному апоптозу, который опосредуется каспазой 8 и 3. В клетках линии НСТ-116р53+/+ гамма-излучение индуцирует апоптоз через внешний механизм, тогда как в клетках линии НСТ-116р53-/- гамма-излучение не индуцирует апоптоз [2]. Сделанные ранее опыты согласуются с данными экспериментов по определению экспрессии генов с использованием ДНК-микроматриц.
В заключение, можно сделать вывод, что после радиационного облучения экспрессия связанных генов GREB1, CENPT и SREBF1 индуцируется в клетках линии НСТ-116р53+/+ и подавляется в клетках линии НСТ-116р53-/-. Экспрессия гена ZFAND5 пропорциональна устойчивости клеток к радиационно-индуцированному апоптозу.
Работа выполнена при поддержке Федеральной целевой программы «Исследования и разработки по приоритетным направлениям развития научно-технологического комплекса России на 2007–2013 годы» ГК № 14.512.11.0058.
Рецензенты:
Балыкин М.В., д.б.н., профессор, заведующий кафедрой адаптивной физической культуры Института медицины, экологии и физической культуры, ФГБОУ ВПО «Ульяновский государственный университет», г. Ульяновск;
Слесарев С.М., д.б.н., доцент, заведующий кафедрой биологии и биоэкологии Института медицины, экологии и физической культуры, ФГБОУ ВПО «Ульяновский государственный университет», г. Ульяновск.
Работа поступила в редакцию 07.08.2013.
Библиографическая ссылка
Глущенко Е.С., Белогубов П.В., Антонова А.В., Семенова М.А., Живодерников И.В., Свеколкин В.П., Викторов Д.А., Мастиленко А.В., Столбовская О.В., Саенко Ю.В. ТРАНСКРИПТОМНЫЙ АНАЛИЗ ДИФФЕРЕНЦИАЛЬНО-ЭКСПРЕССИРУЮЩИХСЯ ГЕНОВ В РАКОВЫХ КЛЕТКАХ С МУТАНТНЫМ И НОРМАЛЬНЫМ ГЕНОМ ТР53 ПОСЛЕ РАДИАЦИОННОГО ВОЗДЕЙСТВИЯ // Фундаментальные исследования. 2013. № 10-2. С. 339-343;URL: https://fundamental-research.ru/ru/article/view?id=32279 (дата обращения: 31.01.2026).



