Несмотря на значительный прогресс, достигнутый в настоящее время при применении остеоиндукторов и остеокондукторов для восстановления костных дефектов, разработка новых материалов продолжает оставаться актуальной задачей современной хирургии, в том числе челюстно-лицевой. Традиционным в биомедицинских исследованиях методом оценки влияния остеопластических материалов на заживление костных дефектов является создание искусственного костного дефекта с последующим изучением динамики его заживления. В данной работе были изучены две новые композиции, приготовленные на основе нового биорегулятора, выделенного из сыворотки крови крупного рогатого скота, включенного в состав хитозанового геля: композиция Матрибон содержала синтетический гидроксиапатит; другая ‒ Матрибон Х – его не содержала.
Биорегулятор, выделенный из сыворотки крови крупного рогатого скота, представляет собой пептидно-белковый комплекс, стимулирует адгезию, миграцию и пролиферацию соединительно-тканных элементов, обеспечивает поддержание жизнеспособности клеток и репарацию ткани с сохранением всех морфологических единиц [1, 4, 2, 6]. Была показана эффективность данного биорегулятора в составе хитозанового геля при заживлении кожных ран и ожогов в эксперименте на животных in vivo [6, 4]. Сывороточный биорегулятор способствовал восстановлению хрящевой ткани в эксперименте [3, 5].
Целью настоящего исследования явилось изучение влияния двух композиций на восстановление костной ткани при введении в искусственно вызванный костный дефект. Были изучены течение регенераторных процессов в костных дефектах, характер взаимодействия композиции и регенерата в костной ране.
Материалы и методы исследования
Исследование было проведено на самцах крыс Wistar, весом 180‒220 г, которые содержались в стандартных условиях вивария ИБР им. Н.К. Кольцова РАН. Всем животным под наркозом в один проводили операцию по нанесению стандартного дефекта в дистальном эпифизе бедра (2×2 мм), разделяли на группы по 24 крыс в каждой: 1-я – контрольная, в костные дефекты ничего не вносили; 2-я – контрольная, в костные дефекты вводили композицию, состоящую из хитозанового геля и гидроксиапатита (ГАП); 3-я – в костные дефекты вводили композицию Матрибон Х; 4-я группа – в костные дефекты вводили композицию Матрибон.
Композиция Матрибон представляла собой синтетический гидроксиапатит (10-30 масс. %) (Гидроксиапол ГАП-99г-0,5; производство ЗАО «НПО Полистом»), хитозановый гель (70–90 масс. %), содержащий биорегулятор, который получали из сыворотки крови крупного рогатого скота по ранее разработанной методике [7]. Композиция МатрибонХ представляла собой хитозановый гель (90,0–99,9 масс. %), содержащий сывороточный биорегулятор. Для предотвращения выпадения материалов из входного отверстия его закрывали стерильной тонкой коллагеновой пленкой. Сроки выведения животных из опытов – 14, 30, 90, 300-е сутки. В каждом сроке изучали гистологические срезы 6 крыс из группы. Животных выводили из эксперимента путем декапитации после эфирного наркоза, затем иссекали поврежденную конечность, включая большой вертел. Забранный материал фиксировали в 4 %-м растворе формалина, затем проводили вырезку сегмента бедра, содержащего зону повреждения с захватом окружающих здоровых тканей на расстоянии 2–3 мм от раны. Фрагменты костной ткани декальцинировали в растворе ЭДТА и подвергали стандартной гистологической обработке с заливкой в парафин и окраской парафиновых срезов гематоксилином и эозином. При получении гистосрезов блоки ориентировали таким образом, чтобы нож проходил параллельно к направлению канала раны (поперечные срезы кости).
Результаты исследования и их обсуждение
На 14-е сутки во всех 4-х группах экспериментальных животных наблюдали образование обширных участков соединительной ткани, сохранение сетчатой структуры, расстояния между Гаверсовыми каналами были незначительными. При этом в контроле (1-я группа) и в 3-й группе на этом сроке наблюдали обширные участки костно-мозговой ткани, а во 2-й группе были видны обширные участки окруженных соединительной тканью частиц ГАП. В 4-й группе расстояния между Гаверсовыми каналами несколько увеличивались, вокруг частиц ГАП в соединительной ткани наблюдали выраженную клеточную реакцию, представленную лимфо-макрофагальными элементами (рис. 1).
На 30-е сутки во всех группах наблюдали так же сохранение обширных участков, представленных соединительной тканью и сетчатой структурой. В 1-й группе расстояния между Гаверсовыми каналами продолжали оставаться незначительными, костный дефект на значительных территориях был заполнен клеточно-волокнистой соединительной тканью (ретикулофиброзная костная ткань), формировалась губчатая кость. Во 2-й и 3-й группе можно отметить увеличение расстояния между Гаверсовыми каналами. Во 2-й группе наблюдается формирование незрелой костной ткани. В 3-й, а также 4-й группах, наблюдали обширные участки костно-мозговой ткани. Кроме того, в 4-й группе участки, представленные соединительной тканью, резко уменьшены, а расстояния между Гаверсовыми каналами увеличены (рис. 2).
На 90-е сутки во всех группах наблюдали так же сохранение обширных участков, представленных соединительной тканью и сетчатой структурой, прослеживались обширные участки костно-мозговой ткани. Во 2-й группе уменьшается количество ГАП, включенного в соединительную ткань. В 3-й в 4-й группах отмечалось явное увеличение плотности костной ткани, существенное сужение Гаверсовых каналов в 4-й группе (рис. 3).
На 300-е сутки во всех группах наблюдали обширные участки костно-мозговой ткани. В 1-й и 2-й группах плотность костной ткани несколько повышена, по сравнению с предыдущим сроком. Во 2-й группе ГАП резорбировался и практически не визуализировался. В 3-й, и особенно 4-й группе следует отметить сужение Гаверсовых каналов за счет существенного увеличения плотности костной ткани (рис. 4).
Из полученных данных можно заключить, что уже на 14-е сутки эксперимента наблюдались признаки различной степени выраженности костеобразовательной активности. В сроки от 30 до 90 суток происходило замещение костных дефектов новообразованной костной тканью. При этом проявляла себя способность к остеоинтеграции, которая особенно ярко проявлялась на поздних сроках в опытных 3-й и 4-й группах, когда наблюдалось замуровывание фрагментов подсаженного материала в новообразованное костное вещество. Особо следует указать на довольно раннее появление признаков репаративного остеогенеза, что свидетельствует о довольно высокой остеопотентности композиций, содержащих сывороточный биорегулятор. При незначительном содержании ГАП восстановление происходило за счет новообразующихся костных элементов, легко замещающих хитозановую основу композиции.
а 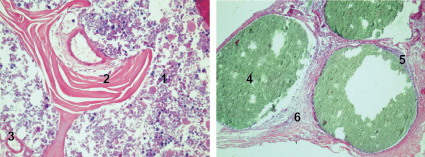 б
б
 г
г
Рис. 1. Состояние дефектов бедренных костей у крыс на 14-е сутки после нанесения травмы: а – в костные дефекты ничего не вносили (1-я контрольная группа); б – в костные дефекты вводили композицию, состоящую из хитозанового геля и гидроксиаппатита (ГАП) (2-я группа); в – в костные дефекты вводили композицию, состоящую из хитозанового геля (90,0–99,9 масс. %) и сывороточного биорегулятора (3-я группа); г – в костные дефекты вводили композицию, состоящую из гидроксиаппатита (10–30 масс. %), хитозанового геля (70-90 масс. %) и биорегулятора, выделенного из сыворотки крови крупного рогатого скота (4-я группа). Окраска гематоксилин-эозином. Увеличение ок. х10. об. х 20. Цифрами отмечены: 1 – костный мозг; 2 – пластинчатая костная ткань; 3 – сосуд; 4 – гранулы ГАП; 5 – фиброзная капсула; 6 – формирование плотной костной ткани
Заключение
Проведенное исследование выявляет значительную роль сывороточного биорегулятора в процессах остеоиндукции и остеокондукции, то есть в процессе ранозаживления кости. Именно при применении композиций Матрибон и МатрибонХ отмечалась активная репарация кости, выражающаяся в восстановлении плотной костной ткани, формировании костного мозга, восстановлении остеонов на более ранних сроках, в отличие от контрольных групп, где в основном формируется губчатая кость. Это позволяет рекомендовать применение композиций Матрибон и МатрибонХ для лечения различных переломов костей опорно-двигательной системы и в челюстно-лицевой хирургии.
Обе композиции обеспечивают повышенную способность стимулировать репаративные процессы костеобразования с восстановлением морфологически нормального костного матрикса. Матрибон рекомендуется для заполнения крупных дефектов костной ткани, а . композиция МатрибонХ, которая обеспечивает повышенную способность стимулировать пролиферацию фибробластов, остеобластов, может использоваться для восполнения дефектов мягких тканей, а также хрящевой и костной тканей за счет активации внутреннего клеточного резерва.
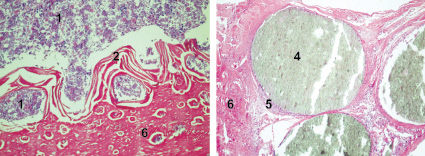
а 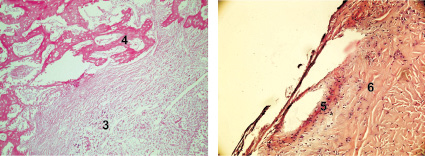 б
б
 г
г
Рис. 2. Заживление костных дефектов крыс на 30-е сутки после нанесения травмы: а – в костные дефекты ничего не вносили (1-я контрольная группа); б – в костные дефекты вводили композицию, состоящую из хитозанового геля и гидроксиаппатита (ГАП) (2-я группа); в – в костные дефекты вводили композицию, состоящую из хитозанового геля (90,0-99,9 масс. %) и сывороточного биорегулятора (3-я группа); г – в костные дефекты вводили композицию, состоящую из гидроксиаппатита (10–30 масс. %), хитозанового геля (70–90 масс. %) и биорегулятора, выделенного из сыворотки крови крупного рогатого скота (4-я группа). Окраска гематоксилин-эозином. Увеличение ок. х10. об. х 20. Цифрами отмечены: 1 – костный мозг; 2 – пластинчатая костная ткань; 3 – ретикулофиброзная костная ткань; 4 – губчатая костная ткань; 5 – незрелая костная ткань; 6 – формирование плотной костной ткани; 7 – Гаверсовы каналы
а 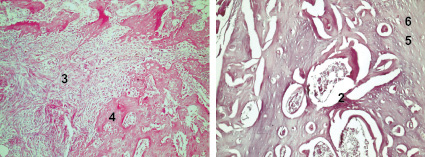 б
б
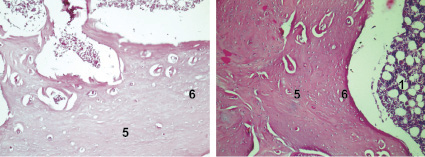 г
г
Рис. 3. Заживление костных дефектов крыс на 90-е сутки после нанесения травмы: а – в костные дефекты ничего не вносили (1-я контрольная группа); б – в костные дефекты вводили композицию, состоящую из хитозанового геля и гидроксиаппатита (ГАП) (2-я группа); в – в костные дефекты вводили композицию, состоящую из хитозанового геля (90,0–99,9 масс. %) и сывороточного биорегулятора (3-я группа); г – в костные дефекты вводили композицию, состоящую из гидроксиаппатита (10–30 масс. %), хитозанового геля (70–90 масс. %) и биорегулятора, выделенного из сыворотки крови крупного рогатого скота (4-я группа). Окраска гематоксилин-эозином. Увеличение ок. х10. об. х 20. Цифрами отмечены: 1 – костный мозг; 2 – пластинчатая костная ткань; 3 – ретикулофиброзная костная ткань; 4 – губчатая костная ткань; 5 – плотная костная ткань; 6 – Гаверсовы каналы
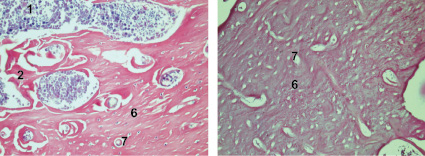
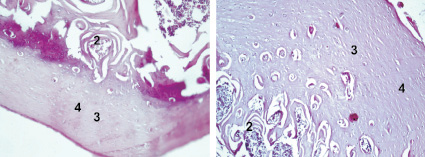 б
б
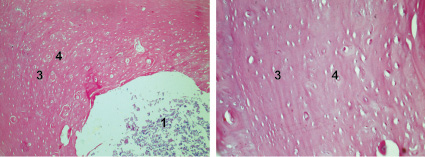 г
г
Рис. 4. Заживление костных дефектов крыс на 300-е сутки после нанесения травмы: а - в костные дефекты ничего не вносили (1-я контрольная группа); б - в костные дефекты вводили композицию, состоящую из хитозанового геля и гидроксиаппатита (ГАП) (2-я группа); в - в костные дефекты вводили композицию, состоящую из хитозанового геля (90,0-99,9 масс. %) и сывороточного биорегулятора (3-я группа); г - в костные дефекты вводили композицию, состоящую из гидроксиаппатита (10-30 масс. %), хитозанового геля (70-90 масс. %) и биорегулятора, выделенного из сыворотки крови крупного рогатого скота (4-я группа). Окраска гематоксилин-эозином. Увеличение ок. х10. об. х 20. Цифрами отмечены: 1 - костный мозг; 2 - пластинчатая костная ткань; 3 - плотная костная ткань; 4 - Гаверсовы каналы
Рецензенты:
Домарацкая Е.И., д.б.н., ведущий научный сотрудник, и.о. зав. лабораторией гистогенеза ФГБУН Института биологии развития им. Н.К. Кольцова РАН, г. Москва;
Григорян Э.Н., д.б.н., зав. лабораторией проблем регенерации ФГБУН Института биологии развития им. Н.К. Кольцова РАН, г. Москва.
Работа поступила в редакцию 14.08.2013.
Библиографическая ссылка
Шайхалиев А.И., Стрецкий Г.М., Краснов М.С., Рыбакова Е.Ю., Тихонов В.Е., Ямскова В.П., Ямсков И.А. ДЕЙСТВИЕ НОВЫХ КОМПОЗИЦИЙ НА ВОССТАНОВЛЕНИЕ КОСТНЫХ ДЕФЕКТОВ У КРЫС В ЭКСПЕРИМЕНТЕ // Фундаментальные исследования. 2013. № 9-2. С. 271-276;URL: https://fundamental-research.ru/ru/article/view?id=32259 (дата обращения: 20.01.2026).



