Проблемой аналитической химии редких элементов является определение малых концентраций в природных и промышленных объектах.
Во второй половине 20 века для обнаружения и определения редких элементов в различных объектах широкое распространение получили комплексы с органическими реагентами различных классов. В частности, нашли применение реактивы группы триоксифлуоронов. Впервые 9-метил-2,3,7-триоксифлуорон был предложен в 1937 г. швейцарскими химиками Венчером и Дукертом как реактив на сурьму [4].
Впоследствии были синтезированы [5] и использованы в анализе множество производных триоксифлуорона с различными заместителями в положении – R (рис. 1).
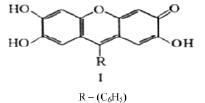
Рис. 1. Формула R-триоксифлуорона R – С13Н3О5
В случае фенилфлуорона положение R–замещен группой фенила – С6Н5.
В промышленных условиях различные содержания молибдена чаще определяют колориметрически визуально в виде роданидного комплекса при восстановлении его до Мо4+ в присутствии вольфрама [1].
Недостатком роданидного определения молибдена является малая чувствительность, что приводит к необходимости отделения молибдена от элементов, мешающих собственным светопоглощением в области поглощения молибдена. Процесс восстановления Мо6+ до Мо4+ неустойчивый, динамичный и зависит от условий восстановления.
Растворы комплексы молибдена с роданидом нельзя подвергать измерению поглощательной способности световой энергии через оптические приборы (ФЭК, СФ и др.), так как при разложении пробы молибден может находиться в растворе в различных ионных состояниях, с которыми роданидный комплекс может давать опалесценцию, невидимую для глаза, но приборы будут фиксировать резкое увеличение оптической плотности раствора [3].
Присутствие вольфрама осложняет анализ роданидным методом. Если от большинства мешающих элементов можно избавиться при разложении анализируемого материала либо кислым гидролизом, либо сплавлением со щелочами, либо отделением экстракцией, то вольфрам всюду сопутствует молибдену. Поэтому задача определения молибдена в присутствии вольфрама весьма актуальна.
В данной работе показана возможность фотометрического определения молибдена в состоянии Мо6+ в присутствии вольфрама в природных и промышленных объектах в комплексе с фенилфлуороном (ФФ) [2].
Экспериментальная часть
Исходные 0,01 М растворы молибдена и вольфрама готовили растворением в воде Na2MoO4·2H2O «чда» и Na2W4·2H2O» «чда». Рабочие растворы получали разбавлением исходных растворов. Фенилфлуорон применяли марки «чда». Растворы ФФ 0,001 М готовили растворением точной навески в этиловом спирте с добавлением 1 мл 8 н HCl и доводили до соответствующего объема этиловым спиртом. Оптимальные значения рН создавали растворами едкого калия и соляной кислоты и контролировали стеклянным электродом с использованием иономера универсального ЭВ-74, прокалиброванного по стандартным буферным растворам.
Спектры поглощения растворов молибдена, вольфрама, реагента ФФ и комплексов Мо и W регистрировали в участке спектра 250–700 нм с помощью спектрофотометра СФ-26.
Результаты исследования и их обсуждение
Для исследования возможности использования комплексообразования молибдена с фенилфлуороном в анализе промышленных объектов предварительно были изучены оптимальные условия взаимодействия Мо с ФФ, а также оптические свойства образующихся комплексов.
Предварительно проведенным поиском было установлено, что при добавлении раствора ФФ к раствору Мо и создании оптимальных условий раствор ФФ из желтой окраски переходит в красную.
Спектры поглощения растворов Мо, W и ФФ в интервале длин волн 270–620 нм представлены на рис. 2.
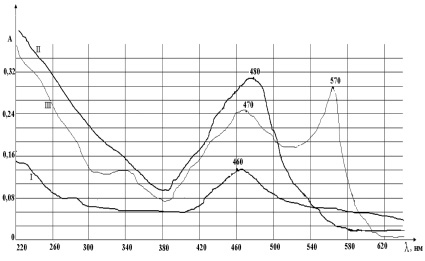
Рис. 2. Спектры поглощения растворов: I – Раствор ФФ; II – Раствор комплекса W с ФФ; III – Раствор Мо с ФФ. СМо = СW = СФФ = 1·10–4 м, V = 10 мл, рН = 1,75
Как видно из рис. 2, раствор фенилфлуорона поглощает световую энергию в области 420–500 нм с максимумом 460 нм. При комплексообразовании Мо, W с ФФ наблюдается сдвиг максимумов в более длинноволновую область спектра по сравнению с максимумом поглощения самого реактива, а также увеличение по интенсивности поглощения световой энергии.
Растворы W с ФФ поглощают световую энергию в той же области, как и растворы реактива в интервале 420–500 нм, только с максимумом поглощения при λ – 480 нм.
Растворы Мо с ФФ поглощают световую энергию в интервале спектра 420–600 нм и имеют два максимума поглощения при λ1 = 470 нм, λ2 = 570 нм. Оба максимума по своей интенсивности выше интенсивности поглощения растворы самого реактива. При максимальном поглощении растворов комплекса Мо с ФФ при λ2 = 570 нм интенсивность поглощения световой энергии комплексов W и ФФ минимальное (рис. 3).
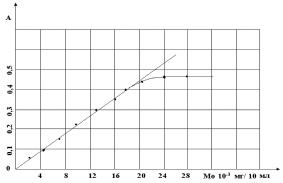
Рис. 3. Калибровочный график зависимости А от СМо.СМо = n∙10–3 мг/мл, СФФ = 2∙10–4 м, рН = 2,5, V = 10 мл
Методами молярных отношений и изомолярных серий установлено соотношение Мо:ФФ = 1:1.
Подобраны оптимальные условия фотометрирования реакции молибдена с фенилфлуороном. Для этого исследовано влияние различных факторов на интенсивность поглощения световой энергии растворами комплекса Мо с ФФ.
Растворы комплексов Мо с ФФ максимально поглощают световую энергию в области рН 2,0–3,5 с максимумом при рН 2,5; вольфрама – при рН 3–4 с максимумом 3,5. Растворы комплекса Мо с ФФ достигают максимального поглощения через 30 мин после их приготовления и остаются постоянными в течение 5 часов.
В подобранных оптимальных условиях растворы комплексов Мо с ФФ подчиняются закону светопоглощения Бугера–Ламберта–Бера в интервале концентрации Мо от 0,003 до 0,20 мг в 10 мл раствора (рис. 4).
Исследовано влияние W на интенсивность поглощения растворов комплекса Мо с ФФ. Для этого брали растворы с постоянными концентрациями Мо и ФФ и, добавляя различные концентрации W, создавали рН 2,5 в V = 10 мл и через 30 мин фотометрировали на СФ-26.
Как видно из рис. 4, до соотношения Мо: W = 1: 1 наблюдается увеличение оптической плотности, при дальнейшем увеличении СW раствора – снижение.
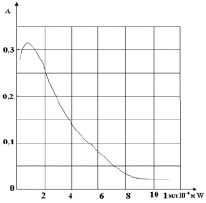
Рис. 4. Влияние W на А комплекса Мо с ФФ. СМо = 1 мл∙10–4 м, С W = 1 мл∙10–4 м, СФФ = 2 мл∙10–4м
В результате проведенных экспериментов по поиску замаскирования W реактивами винной, лимонной кислотами, пирофосфатом натрия и др., с которыми W образует бесцветные комплексы, установлено, что пирофосфат натрия в условиях эксперимента устраняет влияние W на А раствора комплекса Мо с ФФ.
Полученные данные были использованы для определения малых концентраций Мо в комплексе с ФФ в присутствии W в промышленных пробах (сухие пробы переводили в раствор сплавлением с NaOH).
Строили калибровочный график по Мо 0,003–0,2 мг, добавляли по 2 мл∙10–4 м ФФ, щепотку пирофосфата натрия, создавали рН 2,5 и объем доводили до 10 мл и через 30 мин фотометрировали на СФ-26 на содержание Мо в промышленных пробах на фоне W (таблица).
Определение молибдена в присутствии вольфрама в промышленных пробах НГМЗ
|
Номер проб |
Мо мг/мл |
W, мг/мл |
Найдено Мо, мг/мл |
Разница |
|
2873 |
сл |
0,008 |
0,0041 |
– |
|
2865 |
сл |
0,003 |
0,003 |
– |
|
2952 |
0,009 |
0,006 |
0,0091 |
+0,0001 |
|
3004 |
0,005 |
0,005 |
0,0041 |
–0,0009 |
Результаты по определению Мо в комплексе с ФФ в присутствии различных концентраций W были подвергнуты статистической обработке. Коэффициент вариации не превышает 0,5 %.
Нижний предел обнаружения молибдена в комплексе с ФФ в промышленных пробах составляет 5∙10–9 г/мл Мо.
Рецензенты:
Качкаров Ж.А., д.х.н., профессор кафедры неорганической и физической химии, КБГУ, г. Нальчик;
Султыгова З.Х., д.х.н., профессор кафедры химии, ИнгГУ, г. Назрань.
Работа поступила в редакцию 18.07.2013.
Библиографическая ссылка
Саламов А.Х., Алакаева Л.А. ОПРЕДЕЛЕНИЕ МОЛИБДЕНА В ПРИСУТСТВИИ ВОЛЬФРАМА В РАЗЛИЧНЫХ ОБЪЕКТАХ // Фундаментальные исследования. 2013. № 10-1. С. 86-89;URL: https://fundamental-research.ru/ru/article/view?id=32221 (дата обращения: 16.02.2026).



