В структуре заболеваемости и смертности среди онкологических заболеваний рак прямой кишки занимает ведущие позиции. В последнее время отмечается прирост абсолютного числа заболевших колоректальным раком [1], что указывает на высокую социальную значимость проблем диагностики и необходимость поиска новых способов лечения пациентов с раком прямой кишки.
Лечение рака прямой кишки, особенно у больных с распространенной стадией заболевания, является комплексным и включает радикальную операцию с удалением органа и прилегающей жировой клетчатки и лучевую терапию в сочетании с полихимиотерапией [2]. Противоопухолевые препараты вводят внутривенно, что сопровождается побочными эффектами, связанными с параллельным влиянием цитостатиков на активно пролиферирующие и быстро обновляющиеся клеточные системы [3]. В ряде случаев для повышения эффективности и уменьшения побочных эффектов цитостатической терапии используют другие способы доставки химиопрепаратов, как, например, регионарное введение [4], что позволяет увеличить их местную концентрацию [5] и снизить вероятность появления нежелательных эффектов, связанных с токсическим влиянием на организм в целом за счет абсорбции медикаментов напрямую тканью опухоли [6].
Структурно-клеточные изменения отдаленных от первичного опухолевого узла брыжеечных лимфатических узлов при моделируемом раке прямой кишки в условиях проведения регионарной цитостатической терапии является проявлением комплексного ответа лимфатической системы на такое воздействие. Изучение брыжеечных лимфатических узлов позволит оценить влияние локальной противоопухолевой терапии на звенья лимфатической системы и их способность к сохранению барьерно-детоксикационной функции, обеспечивающей противоопухолевую резистентность и предотвращающей генерализацию эндотоксикоза.
Цель исследования – выявить характерные особенности структурной организации брыжеечных лимфатических узлов в условиях роста злокачественной опухоли прямой кишки при параректальном пути введения химиопрепаратов.
Материалы и методы исследования
Исследование проведено на 30 экспериментальных животных – крысах-самцах популяции Wistar с массой 300–400 г (НИИ клинической и экспериментальной лимфологии СО РАМН, Новосибирск). Все эксперименты выполнены в соответствии с «Правилами проведения работ с использованием экспериментальных животных», утвержденными приказом Минздрава СССР № 577 от 12.08.77 г. Эксперименты выполнены с соблюдением принципов гуманности, изложенных в директиве Европейского Сообщества (86/609/ЕС).
У крыс-самцов индуцировали экспериментальную опухоль толстой кишки путем интраректальных инстилляций химического канцерогена N-метил-N-нитрозомочевины (МНМ). Вводили по 4 мг МНМ в 0,5 мл изотонического раствора натрия хлорида один раз в неделю в течение 4 недель (всего 4 инстилляции) [2].
Определены экспериментальные группы:
1. Интактные животные (10 животных).
2. Животные с индуцированной опухолью прямой кишки, без лечения (10 животных).
3. Животные с индуцированной опухолью прямой кишки, леченные по схеме Мейо, параректальное введение (10 животных).
Химиотерапию экспериментальным животным проводили по схеме Мейо [2]: 5-фторурацил и лейковарин спустя 11 мес. после инстилляции МНМ в дозе, рассчитанной на кг веса животного. Введение цитостатиков осуществлялось тремя курсами (3 дня каждую неделю) в дозе 0,1 мг лейковарина и 0,1 мг фторурацила параректальным путем.
Забор материала у животных проводился спустя 11 месяцев после инстилляции канцерогена, верификации роста опухоли и окончании курсов химиотерапии под эфирным наркозом. Для гистологического исследования забирали ткань опухоли, краниальные брыжеечные лимфатические узлы. Краниальные брыжеечные лимфатические узлы, расположенные вдоль краниальной брыжеечной артерии и ее ветвей делили на центральные (проксимальные и дистальные) и периферические [8]. Забирали околоободочные брыжеечные лимфатические узлы (центральные дистальные), залегающие в вентральном (№ 1) и дорзальном (№ 2) концах корневого тела в общем корне брыжейки восходящей ободочной и тонкой кишки.
По стандартной гистологической методике выполняли проводку материала, заливали объекты исследования в парафиновые блоки, с которых делали гистологические срезы толщиной 5–7 мкм. Срезы окрашивали гематоксилин-эозином и азур II-эозином. Гистологические препараты изучали на световых микроскопах NIKON (Япония), МБС-10 при увеличении 32, 400 и 1000 раз, с помощью окулярной тестовой системы производили морфометрию срезов и подсчет клеточных элементов в опухоли и отдельных структурно-функциональных зонах лимфатических узлов. Статистическую обработку данных проводили с помощью t-критерия Стьюдента для зависимых выборок и определяли значимость различий (р – стандартная ошибка среднего). Критический уровень значимости в данном исследовании принимался р < 0,05.
Результаты исследования и их обсуждение
У всех экспериментальных животных спустя 11 месяцев после инстилляции химического канцерогена N-метил-N-нитрозомочевины в стенке прямой кишки выявлена злокачественная эпителиальная опухоль: сочетание умеренно дифференцированной аденокарциномы и плоскоклеточного ороговевающего рака (диморфный рак) с преобладанием железистого компонента. Макроскопически опухоль была представлена экзофитным бугристым образованием на широком основании, иногда это была опухоль язвенно-инфильтративного характера с распространением на кожу вокруг ануса. Микроскопически опухоль представлена хаотично расположенными тубулярными (железистыми) структурами, выстланными полиморфными клетками с эксцентрично расположенными гиперхромными ядрами, вакуолизацией цитоплазмы (рис. 1). Имеются участки опухоли с плоскоклеточной дифференцировкой, встречаются «луковицы» ороговения, и роговые кисты. Отмечается инфильтрирующий рост за пределы слизистой прямой кишки в подслизистый и мышечный слои, а иногда – в окружающую жировую клетчатку.
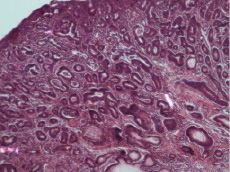
Рис. 1. Ткань опухоли в стенке прямой кишки у крыс. Окраска гематоксилином и эозином. Микрофото. Ув. 10×40
В условиях регионарной химиотерапии лечебный патоморфоз наблюдался как в эпителиальном, так и в стромальном компонентах, однако с преимущественным сохранением самой структуры опухоли. Эпителиальные клетки, представляющие субстрат опухоли, увеличены в размерах, отмечается выраженная вакуолизация цитоплазмы, появление «размытости» контуров отдельных клеток. Имело место увеличение размеров ядер, ослабление интенсивности их окраски. Контур желез часто прерывистый, «разорван», в просвете слизистое содержимое с примесью большого количества нейтрофильных лейкоцитов. В строме опухоли – очаговая и диффузная воспалительная инфильтрация в виде лимфоидных клеток различной степени зрелости, плазматических клеток, макрофагов, нейтрофильных лейкоцитов. Встречаются фокусы некрозов и кровоизлияний, местами – обширные. В участках погибшей паренхимы отмечаются очаги созревающей грануляционной ткани. Исследование лечебного патоморфоза опухоли выявило наличие 2-х способов гибели раковых клеток – некроза и апоптоза.
В условиях роста экспериментальной злокачественной опухоли прямой кишки в первом и втором брыжеечных лимфатических узлах отмечались признаки фолликулярной гиперплазии с увеличением доли герминативных центров (на 56,42 %, (р < 0,001) и на 61,74 %, (р < 0,001) соответственно) и зоны мантии (на 64,34 %, (р < 0,001) и на 61,02 %, (р < 0,001) соответственно) (табл. 1). Увеличение размеров герминативных центров сопровождалось ростом числа клеток на стадии митотического деления, лимфобластов и средних лимфоцитов и сокращением числа зрелых лимфоцитов (табл. 2). Описанные изменения свидетельствуют об активации процессов клеточной пролиферации и бласттрансформации в условиях антигенной стимуляции в герминативных центрах. Во втором органе число макрофагов оказалось ниже контрольных значений на 22,96 % (р < 0,01).
В условиях параректального пути введения химиопрепаратов в обоих брыжеечных лимфатических узлах относительная площадь герминативных центров вторичных лимфоидных узелков увеличилась на 21,88 % (р < 0,01) и на 29,24 % (р < 0,001) соответственно), что сопровождалось усилением пролиферативной активности клеток, увеличением числа лимфобластов и средних лимфоцитов. В пользу активизации процессов бласттрансформации в герминативных центрах указывает факт увеличения содержания моноцитарных макрофагов и ретикулярных клеток как антигенпрезентирующих клеток. Рост числа низкодифференцированных форм лимфоидных клеток в герминативных центрах сопровождался сокращением количества зрелых лимфоцитов (на 17,35 % (р < 0,001) и на 17,76 % (р < 0,001) соответственно). Доля мантийной зоны во 2-м лимфатическом узле сократилась.
Развитие злокачественной опухоли прямой кишки привело к увеличению удельных размеров межфолликулярной зоны в обоих брыжеечных лимфатических узлах. Морфометрические показатели паракортикальной зоны первого органа статистически значимо выросли (на 30,66 % р < 0,001), а во втором органе наблюдается тенденция к увеличению. Паракортикальная гиперплазия сопровождалась увеличением числа иммунбластов и средних лимфоцитов (табл. 2). Такие преобразования свидетельствуют об активации процессов бласттрансформации в этой зоне брыжеечных лимфатических узлов. Увеличение макрофагальной активности в первом органе – в доказательство вышесказанного. Число зрелых лимфоцитов оказалось ниже такового в 1 группе животных, что свидетельствует о том, что на данный момент идет активное использование ранее накопленных клеток, и зрелые Т-лимфоциты расходуются в процессах иммунного ответа вне органа [12] (табл. 2).
Таблица 1
Относительные площади структурно-функциональных зон брыжеечных лимфатических узлов в условиях роста экспериментальной злокачественной опухоли прямой кишки (M ± m) %
|
Структурно-функциональные зоны |
1 группа животных (n = 10), первый и второй брыжеечные л.у. |
2 группа животных (n = 10), первый и второй брыжеечные л.у. |
3 группа животных (n = 10), первый и второй брыжеечные л.у. |
|
Герминативный центр |
2,07 ± 0,16 1,5 ± 0,17 |
4,75 ± 0,46* 3,92 ± 0,22* |
6,08 ± 0,17• 5,54 ± 0,29• |
|
Мантийная зона |
1,99 ± 0,14 2,14 ± 0,11 |
5,58 ± 0,62* 5,49 ± 0,58* |
5,19 ± 0,32 4,27 ± 0,28• |
|
Вторичные лимфоидные узелки |
4,05 ± 0,16 3,64 ± 0,16 |
10,33 ± 0,69* 9,42 ± 0,9* |
11,27 ± 0,28 9,81 ± 0,34 |
|
Первичные лимфоидные узелки |
7,87 ± 0,29 8,23 ± 0,32 |
4,81 ± 1,21* 2,72 ± 0,26* |
3,59 ± 0,17 2,77 ± 0,16 |
|
Межузелковая зона |
2,78 ± 0,08 2,69 ± 0,15 |
6,23 ± 0,71* 5,36 ± 0,53* |
9,35 ± 0,46• 7,04 ± 0,45• |
|
Паракортикальная зона |
25,99 ± 1,15 22,55 ± 0,99 |
37,48 ± 2,86* 26,42 ± 2,54 |
26,94 ± 1,59• 26,79 ± 2,35 |
|
Мозговые тяжи |
22,81 ± 0,71 24,21 ± 1,59 |
16,05 ± 1,56* 25,21 ± 4,33 |
22,22 ± 1,98• 24,55 ± 1,44 |
|
Мозговые синусы |
29,41 ± 2,18 29,83 ± 1,37 |
16,05 ± 1,62* 23,49 ± 3,17 |
14,39 ± 0,85 18,49 ± 1,77 |
|
Краевой синус |
2,62 ± 0,13 3,64 ± 0,21 |
3,72 ± 0,1* 3,05 ± 0,42 |
4,08 ± 0,19 3,37 ± 0,23 |
|
Корковый промежуточный синус |
1,03 ± 0,14 1,5 ± 0,09 |
1,93 ± 0,23* 1,71 ± 0,2 |
3,12 ± 0,32• 2,84 ± 0,55• |
|
Капсула и трабекулы |
3,41 ± 0,17 3,72 ± 0,12 |
3,4 ± 0,15 2,62 ± 0,25* |
5,04 ± 0,24• 4,34 ± 0,17• |
|
Корковое вещество |
40,69 ± 1,86 37,1 ± 1,62 |
58,86 ± 3,58* 43,92 ± 3,99 |
51,16 ± 1,81 46,41 ± 2,16 |
|
Мозговое вещество |
52,23 ± 1,78 54,04 ± 1,62 |
32,09 ± 2,02* 48,71 ± 7,42 |
36,61 ± 1,73 43,04 ± 1,86 |
|
В-зависимая зона |
37,52 ± 2,09 38,77 ± 2,09 |
37,42 ± 3,5 42,71 ± 5,66 |
46,44 ± 2,1• 44,16 ± 2,46 |
|
Т-зависимая зона |
28,72 ± 1,17 25,24 ± 0,94 |
44,07 ± 3,72* 31,78 ± 3,03* |
36,29 ± 1,94 33,83 ± 2,76 |
|
Корково/мозговой индекс |
0,78 ± 0,02 0,69 ± 0,02 |
1,83 ± 0,09 0,9 ± 0,01 |
1,39 ± 0,03 1,08 ± 0,02 |
Примечание:
* – отличия достоверны по сравнению с 1-й группой животных при Р < 0,05;
• – отличия достоверны по сравнению со 2-й группой животных при Р < 0,05.
В условиях параректального способа введения химиопрепаратов относительная площадь межузелковой зоны возросла в обоих органах (на 33,37 % (р < 0,01) в 1-м органе, на 23,86 % (р < 0,05) – во 2-м). Размеры паракортикальной зоны сократились в первом лимфатическом узле (на 28,12 % р < 0,01). Стоит отметить, что относительная площадь этой структурной единицы в группе животных без лечения в первом брыжеечном лимфатическом узле изначально выше, чем во втором. В паракортикальной зоне обоих органов отмечаются признаки усиления пролиферативной активности клеток и активации процессов бласттрансформации: число клеток на стадии митотического деления, число низкодифференцированных форм лимфоидных клеток, а именно иммунобластов и средних лимфоцитов, статистически значимо увеличилось (табл. 2). В доказательство активации иммунологических процессов в паракортикальной зоне брыжеечных лимфатических узлов указывает факт увеличения доли макрофагов и ретикулярных клеток как антигенпрезентирующих (рис. 2). Сокращение относительного числа зрелых лимфоцитов связано с их активным выходом в периферическую циркуляцию с последующим участием в иммунных процессах. Таким образом, параректальное введение химиопрепаратов характеризовалось не только сохранением процессов пролиферации и бласттрансформации в паракортикальной зоне отдаленных от первичной опухоли лимфатических узлов, но и усилении их активности.
Таблица 2
Цитоархитектоника структурно-функциональных зон брыжеечных лимфатических узлов самцов крыс линии Вистар в условиях роста экспериментальной злокачественной опухоли прямой кишки (M ± m) %
|
Клеточные элементы |
1 группа животных (n = 10), первый и второй брыжеечные л.у. |
2 группа животных (n = 10), первый и второй брыжеечные л.у. |
3 группа животных (n = 10), первый и второй брыжеечные л.у. |
|
Герминативный центр вторичных лимфоидных узелков |
|||
|
Иммунобласты |
6,36 ± 0,29 7,46 ± 0,41 |
11,24 ± 0,29* 9,86 ± 0,27* |
13,67 ± 0,35• 16,04 ± 0,62• |
|
Средние лимфоциты |
15,79 ± 0,52 13,65 ± 0,55 |
21,43 ± 0,68* 18,98 ± 0,63* |
25,71 ± 1,0• 21,02 ± 0,99 |
|
Малые лимфоциты |
67,25 ± 1,48 69,72 ± 1,22 |
56,09 ± 1,18* 61,55 ± 1,79* |
46,36 ± 1,88• 50,62 ± 1,51• |
|
Макрофаги |
4,43 ± 0,31 4,05 ± 0,26 |
3,84 ± 0,21 3,12 ± 0,15* |
4,9 ± 0,31• 4,29 ± 0,29• |
|
Ретикулярные клетки |
3,08 ± 0,3 2,77 ± 0,34 |
3,31 ± 0,25 2,87 ± 0,15 |
4,61 ± 0,32• 3,32 ± 0,2 |
|
Клетки с фигурами митозов |
3,08 ± 0,3 2,35 ± 0,34 |
4,1 ± 0,16* 3,62 ± 0,15* |
4,76 ± 0,32 4,7 ± 0,34• |
|
Паракортикальная зона |
|||
|
Иммунобласты |
1,86 ± 0,11 1,19 ± 0,15 |
2,86 ± 0,12* 3,48 ± 0,15* |
3,96 ± 0,22• 4,69 ± 0,23• |
|
Средние лимфоциты |
5,01 ± 0,26 4,49 ± 0,18 |
9,57 ± 0,37* 11,06 ± 0,47* |
12,16 ± 0,64• 12,05 ± 0,54 |
|
Малые лимфоциты |
87,85 ± 1,29 89,27 ± 1,1 |
82,09 ± 0,93* 80,17 ± 1,2* |
76,98 ± 1,53• 75,91 ± 1,68• |
|
Макрофаги |
1,76 ± 0,2 2,02 ± 0,16 |
2,55 ± 0,14* 2,13 ± 0,12 |
2,95 ± 0,17 3,25 ± 0,22• |
|
Ретикулярные клетки |
2,51 ± 0,22 2,48 ± 0,21 |
2,47 ± 0,09 2,53 ± 0,09 |
3,32 ± 0,16• 3,44 ± 0,17• |
|
Тучные клетки |
1,02 ± 0,18 0,55 ± 0,12 |
0,46 ± 0,09* 0,63 ± 0,09 |
0,65 ± 0,14 0,67 ± 0,15 |
|
Мозговые тяжи |
|||
|
Средние лимфоциты |
2,53 ± 0,19 2,69 ± 0,15 |
3,84 ± 0,25* 3,64 ± 0,19* |
5,19 ± 0,29• 5,36 ± 0,24• |
|
Малые лимфоциты |
23,79 ± 0,65 25,53 ± 0,71 |
22,09 ± 0,91 21,51 ± 0,78* |
21,97 ± 0,81 23,04 ± 0,99 |
|
Иммунобласты |
3,05 ± 0,13 3,63 ± 0,22 |
3,67 ± 0,17* 3,73 ± 0,17 |
3,26 ± 0,19 3,67 ± 0,24 |
|
Незрелые плазмоциты |
15,37 ± 0,54 13,93 ± 0,49 |
16,59 ± 0,55 19,78 ± 0,46* |
12,72 ± 0,63• 11,92 ± 0,47• |
|
Зрелые плазмоциты |
49,68 ± 0,82 48,36 ± 0,94 |
45,42 ± 0,94* 43,45 ± 0,71* |
47,61 ± 1,13 47,37 ± 1,03• |
|
Макрофаги |
1,16 ± 0,17 1,52 ± 0,22 |
2,71 ± 0,11* 2,6 ± 0,11 |
2,85 ± 0,16 2,88 ± 0,19 |
|
Ретикулярные клетки |
2,84 ± 0,19 2,93 ± 0,22 |
2,88 ± 0,09 2,78 ± 0,14 |
3,15 ± 0,19 2,68 ± 0,15 |
|
Клетки с фигурами митозов |
1,58 ± 0,16 1,41 ± 0,21 |
2,79 ± 0,1* 2,52 ± 0,11* |
3,26 ± 0,19• 3,08 ± 0,16• |
|
Мозговые синусы |
|||
|
Средние лимфоциты |
3,76 ± 0,33 4,51 ± 0,22 |
4,82 ± 0,14* 5,19 ± 0,21* |
3,85 ± 0,16• 3,83 ± 0,19• |
|
Малые лимфоциты |
54,01 ± 1,74 52,94 ± 1,16 |
46,19 ± 0,96* 41,91 ± 0,75* |
41,73 ± 0,97• 36,78 ± 0,91• |
|
Иммунобласты |
1,38 ± 0,2 1,38 ± 0,16 |
2,45 ± 0,1* 2,52 ± 0,16* |
2,45 ± 0,16 2,67 ± 0,19 |
|
Незрелые плазмоциты |
2,76 ± 0,22 3,0 ± 0,26 |
6,57 ± 0,22* 6,2 ± 0,24* |
7,61 ± 0,29• 8,37 ± 0,35• |
|
Зрелые плазмоциты |
31,7 ± 0,85 32,67 ± 0,69 |
34,01 ± 0,85 38,56 ± 1,05* |
38,49 ± 0,64• 42,29 ± 1,25• |
|
Макрофаги |
1,38 ± 0,16 1,75 ± 0,22 |
2,28 ± 0,12* 2,09 ± 0,16 |
2,28 ± 0,12 2,23 ± 0,17 |
|
Ретикулярные клетки |
3,76 ± 0,24 3,0 ± 0,22 |
2,89 ± 0,13* 2,77 ± 0,17 |
2,79 ± 0,14 2,94 ± 0,21 |
|
Тучные клетки |
1,25 ± 0,12 0,75 ± 0,16 |
0,79 ± 0,13* 0,75 ± 0,13 |
0,79 ± 0,16 0,89 ± 0,15 |
Примечание:
* – отличия достоверны по сравнению с 1-й группой животных при Р < 0,05;
• – отличия достоверны по сравнению со 2-й группой животных при Р < 0,05.
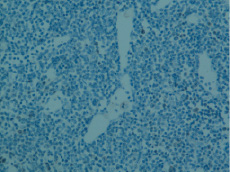
Рис. 2. Брыжеечный лимфатический узел. Паракортикальная гиперплазия. Окраска гематоксилином и эозином. Микрофото. Ув. 10×40
Развитие злокачественной опухоли прямой кишки привело в первом брыжеечном лимфатическом узле к сокращению относительной площади мозговых тяжей на 29,64 % (р < 0,001), что, однако, сопровождалось статистически значимым увеличением числа средних лимфоцитов, плазмобластов, незрелых плазмоцитов и макрофагов (табл. 1, 2). Во втором органе в отсутствии изменений размеров изучаемой зоны имело место увеличение числа средних лимфоцитов и незрелых плазмоцитов. В мозговых тяжах обоих брыжеечных лимфатических узлов отмечается рост пролиферативной активности клеток (на 43,37 % (р < 0,001) в 1-м органе и на 44,08 % (р < 0,001) – во 2-м). Увеличение числа низкодифференцированных и промежуточных форм плазматических клеток сопровождалось сокращением числа зрелых плазмоцитов.
Параректальное введение химиопрепаратов привело к увеличению доли мозговых тяжей в первом брыжеечном лимфатическом узле на 27,77 % (р < 0,05), при этом соответствующие параметры во втором органе значимо не изменились. В клеточной популяции изучаемой структурной единицы обоих брыжеечных лимфатических узлов возросла доля средних лимфоцитов (на 26,01 % (р < 0,001) и на 32,09 % (р < 0,001) соответственно). Процентное содержание незрелых плазмоцитов статистически значимо сократилось относительно показателей группы нелеченных животных, а зрелых плазматических клеток – возросло во втором органе и отмечается тенденция к увеличению в первом. Сокращение числа созревающих форм плазматических клеток в мозговых тяжах указывает на подавление активности иммунологических процессов в этой зоне [9].
В условиях роста злокачественной опухоли прямой кишки относительные размеры мозговых синусов в первом брыжеечном лимфатическом узле сократились на 45,43 % (р < 0,001), а краевого и коркового промежуточного синусов – увеличились (на 29,57 % (р < 0,001) и на 46,63 % (р < 0,001) соответственно). Такие изменения свидетельствуют об активном прямом пути транспорта лимфы, однако более выраженном лимфонаполнении корковых промежуточных синусов, что и повлияло на изменения цитоархитеконики в этой и других структурных зонах органа. Во втором брыжеечном лимфатическом узле имелась тенденция к уменьшению размеров мозговых синусов и отсутствие изменений со стороны краевого и коркового промежуточного синусов.
В мозговых синусах отмечаются признаки цитоза: увеличение процентного содержания средних лимфоцитов, всех форм плазматических клеток, макрофагов. Доля ретикулярных и тучных клеток в мозговых синусах первого брыжеечного лимфатического узла статистически значимо сократилась. В обоих органах уменьшилось число зрелых лимфоцитов (табл. 2).
В ответ на проводимую химиотерапию при параректальном пути введения препаратов в первом и втором органах отмечалось увеличение размеров корковых промежуточных синусов (на 38,14 %, (р < 0,01) в 1-м и на 39,79 %, (р < 0,1) во 2-м) по сравнению с показателями во 2-й группе животных. Размеры мозговых и краевых синусов значимо не изменились. Более выраженное лимфонаполнение корковых промежуточных синусов оказало влияние на лимфоидную ткань, соприкасающуюся с ними (паракортикальная зона и герминативные центры), где напряженность иммунологических реакций оказалась более выраженной, на что указывают признаки усиления пролиферативной активности клеток и активации процессов бласттрансформации, увеличения количества макрофагов и ретикулярных клеток, как антигенпрезентирующих клеток.
В мозговых синусах первого и второго органов имело место сокращение числа средних и малых лимфоцитов. Относительное количество незрелых плазмоцитов и зрелых плазматических клеток в мозговых синусах увеличилось.
Структурные изменения брыжеечных лимфатических узлов в условиях развития злокачественной опухоли прямой кишки привели к увеличению доли коркового вещества и сокращению доли мозгового вещества (в первом органе эти изменения являются статистически значимыми). Относительные размеры зоны, населенной преимущественно В-лимфоцитами, не изменились, а размеры зоны, ответственной за рост и дифференцировку Т-лимфоцитов, статистически значимо увеличились (табл. 1).
В условиях параректального введения химиопрепаратов микроанатомические преобразования брыжеечных лимфатических узлов в итоге не привели к значимым изменениям размеров коркового и мозгового вещества. В результате проведенной химиотерапии размеры зоны, населенной преимущественно В-лимфоцитами, увеличились в первом брыжеечном лимфатическом узле на 19,42 % (р < 0,05). Отмечается тенденция к увеличению размеров изучаемой структурной единицы и в первом органе. Относительная площадь Т-зависимой зоны не претерпела достоверно значимых изменений.
В условиях развития рака прямой кишки корково-мозговой индекс для первого брыжеечного лимфатического узла составил 1,83 соответственно по морфотипу с фрагментированного (в группе интактных животных) он меняется на компактный. Второй брыжеечный лимфатический узел остался узлом фрагментированного морфотипа. В группе с параректальным введением цитостатиков корково-мозговой индекс для первого лимфатического узла составил 1,39, а для второго – 1,08.
Заключение
В условиях роста злокачественной опухоли прямой кишки в брыжеечных лимфатических узлах выявлены признаки значительных изменений структурно-клеточной организации, активации процессов пролиферации и бласттрансформации в зонах, ответственных за клеточное и гуморальное звенья иммунитета, признаки плазматизации мозговых тяжей, выраженного синусного цитоза. Подобные преобразования имели место на фоне внутриузлового перераспределения лимфы в корковые промежуточные синусы, что и повлияло на изменения цитоархитеконики в зонах органа, ответственных за процессы детоксикации и противоопухолевую резистентность.
В условиях параректального способа введения химиопрепаратов наблюдалось сохранение активности процессов пролиферации и бласттрансфомации в герминативных центрах и паракортикальной зоне, на фоне более выраженного лимфонаполнения корковых промежуточных синусов. В мозговых тяжах наблюдалось увеличение числа средних лимфоцитов, однако сокращение числа созревающих форм плазматических клеток. Отмечается относительная равномерность структурно-клеточных преобразований в 1 и 2 брыжеечных лимфатических узлах. Транспортная функция брыжеечных лимфатических узлов не увеличилась.
Рецензенты:
Голубева И.А., д.м.н., профессор кафедры анатомии, ГБОУ ВПО НГМУ Минздрава России, г. Новосибирск;
Бгатова Н.П., д.б.н., профессор, зав. лабораторией ультраструктурных исследований, ФГБУ «НИИ клинической и экспериментальной лимфологии» СО РАМН, г. Новосибирск.
Работа поступила в редакцию 12.07.2013.
Библиографическая ссылка
Исакова Н.Б., Исакова Н.Б., Исакова Н.Б., Старкова Е.В., Старкова Е.В. БРЫЖЕЕЧНЫЕ ЛИМФАТИЧЕСКИЕ УЗЛЫ ПРИ МОДЕЛИРОВАНИИ РАКА ПРЯМОЙ КИШКИ В УСЛОВИЯХ ПАРАРЕКТАЛЬНОГО ВВЕДЕНИЯ ХИМИОПРЕПАРАТОВ // Фундаментальные исследования. 2013. № 9-1. С. 50-57;URL: https://fundamental-research.ru/ru/article/view?id=32176 (дата обращения: 15.12.2025).



