Митохондрии являются важнейшими внутриклеточными структурами, определяющими функционирование клеток млекопитающих в норме и при патологии. Уникальная способность митохондрий к поддержанию гомеостаза обеспечивается рядом их свойств, среди которых матричность, эластичность, связанная с характерным только для мембран митохондрий специализированным белковым составом.
Согласно литературным данным, мембранные ферменты функционируют в составе биомембран в виде сложных надмолекулярных ансамблей, что может приводить к проявлению ими особых свойств, не реализующихся в гомогенных водных растворах. Многие ферменты плазматических мембран животных клеток способны переходить из мембраносвязанной формы в «растворимую». Функционирование мембранных ферментов зависит от локального окружения и определяется их взаимодействием с липидными и белковыми компонентами мембран [1]. Контролируемая метаболитами обратимая адсорбция энзимов на мембранах органелл расширяет регуляторные возможности клетки [13]. Биологическая роль различных мембранных ферментов может в значительной степени определяться их способностью к связыванию с мембраной, приводя к существенным изменениям особенностей строения и функционирования энзимов.
Проводились эксперименты по включению одного из ключевых ферментов биотрансформации печени алкогольдегидрогеназы (АДГ) в искусственные мембраны. Показано, что увеличение количества АДГ, связанной на единицу массы носителя, сопровождается снижением её активности, причиной которого являются возникающие диффузионные затруднения, препятствующие доступу субстратов к активным центрам фермента [11]. Имеются доказательства тесной метаболической связи между обменами субстратов и продуктов алкогольдегидрогеназной и лактатдегидрогеназной реакций: этанол-ацетальдегид и лактат-пируват [5].
Лактатдегидрогеназа (ЛДГ) как фермент гликолиза играет важную роль в регуляции энергетического обмена клетки и способна взаимодействовать с мембранами субклеточных органелл [9]. Существуют сведения о связи лактатдегидрогеназы и алкогольдегидрогеназы в условиях in vitro [7; 14]. Однако в настоящее время отсутствуют какие-либо представления о роли функционального взаимодействия ЛДГ-АДГ в составе надмолекулярного кластера с мембранами митохондрий печени в эксперименте.
Целью данной работы явилось изучение каталитических и кинетических свойств ЛДГ, АДГ и комплекса АДГ-ЛДГ митохондрий печени крыс, а также исследование сил электростатического взаимодействия ферментативного комплекса с мембраной митохондрий.
Материал и методы иследования
Эксперименты проведены на 15 крысах самцах линии Wistar массой 180–200 г, содержащихся в условиях вивария при свободном доступе к пище и воде. Исследование активности и кинетических свойств ЛДГ и АДГ проводили в митохондриальной фракции печени животных, которую получали методом дифференциального центрифугирования на центрифуге Multifuge 1 S-R [6]. Для оценки взаимодействия ферментов с мембраной проводилась солюбилизация мембраносвязанных форм ЛДГ, АДГ путем суспендирования митохондрий в 0,15 М NaCl, pH 6,0 [12].
Активность ЛДГ определяли с использованием в качестве субстрата молочной кислоты (прямая реакция, ЛДГпр) и пировиноградной кислоты (обратная реакция, ЛДГобр) [3]. Исследование активности АДГ осуществляли с использованием в качестве субстрата этилового спирта (прямая реакция, АДГпр) и ацетальдегида (обратная реакция, АДГобр) по М. Koivusalo et al. (1989) [10]. Концентрацию белка определяли по методу Лоури в модификации [8]. Оценку каталитических и кинетических свойств ферментов в надмолекулярной системе (АДГ-ЛДГ) проводили путем одновременного внесения в пробу субстратов для лактатдегидрогеназы и алкогольдегидрогеназы.
Для определения кинетических констант АДГ и ЛДГ реакций использовали полную кривую накопления продуктов реакции (V от t). Используя математический метод, рассчитывали кинетические параметры ферментативной реакции (Kt, Vmax, Kn, Ka, Kd) в гетерогенной системе, где Kt – время полупревращения субстрата (усл.ед.); Vmax – максимальная скорость реакции (усл.ед.); Ka – коэффициент каталитической эффективности (усл.ед.); Kn – коэффициент кооперативности ферментативной реакции (усл.ед.); Kd – коэффициент структурных изменений фермента (усл.ед.) [2]. Характер ингибирования и активации ферментов определяли по В.И. Крупянко (1990) [4].
Результаты исследований обрабатывали с использованием t-критерия Стьюдента с помощью программы Statistica 6.0. При расчете t-критерия Стьюдента применяли поправку Бонферрони, позволяющую устранить ошибку первого рода, возникающую при сравнении более чем двух выборок данным методом.
Результаты исследования и их обсуждение
Использование 0,15 М раствора NaCl с целью изменения сил электростатического взаимодействия ферментативного комплекса с мембраной митохондрий показало, что 65 % суммарной активности ЛДГпр интактных животных приходится на лабильно связанную с мембраной форму фермента (солюбилизат), тогда как 35 % суммарной активности ЛДГпр прочно связаны с мембранами митохондрий (после солюбилизации). Аналогичное распределение активности выявлено для АДГпр и комплекса ЛДГпр-АДГпр: преобладающее количество общей активности АДГпр (53 %), кластера ЛДГпр-АДГпр (63 %) отмечено в солюбилизате, 47 % АДГпр и 37 % комплекса – прочно связаны с мембранами (рис. 1). Согласно литературным данным, изменение способности белков к связыванию с мембраной может сопровождаться существенными преобразованиями в строении и в функционировании энзимов [1].
Выявлено, что у животных в обратной реакции преобладает лабильно связанная с мембраной форма лактатдегидрогеназы (57 %). Иная картина характерна для АДГобр крыс, при которой подавляющее количество фермента находится в связанном с мембранами состоянии (78 %), и лишь 22 % суммарной активности АДГобр приходится на лабильно связанную форму фермента. Для комплекса ЛДГобр-АДГобр интактных животных выявлено преобладание прочно связанных (57 %) форм энзима над лабильными (43 %) (рис. 1). Перераспределение ферментов между «свободными» и связанными с мембранами формами в комплексе, вероятно, связано с модификацией структуры мембран.
Удельная активность ЛДГпр в митохондриальной фракции печени до солюбилизации в составе кластера АДГпр-ЛДГпр статистически значимо уменьшилась в 2,6 раза, удельная активность АДГпр, наоборот, увеличилась в 5,6 раза по сравнению с активностью ферментов в односубстратных реакциях (рис. 2). Изменение каталитических свойств ЛДГ в составе кластера до солюбилизации обусловлено изменением кинетических характеристик фермента: статистически значимо возросло Kt в 3,2 раза, отмечено снижение каталитической эффективности ЛДГпр надмолекулярного комплекса (табл. 1). Выявлен механизм, посредством которого происходит снижение активности ЛДГпр, – смешанное ингибирование. Повышение активности АДГпр в составе кластера обусловлено двухпараметрически рассогласованной активацией [4].
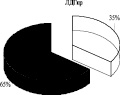
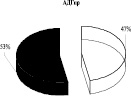
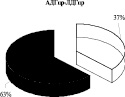
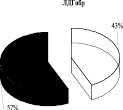
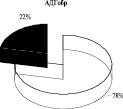
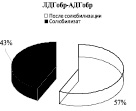
Рис. 1. Распределение общей активности (нмоль НАДН/мин) ЛДГ, АДГ и их комплексов в митохондриях печени крыс до и после солюбилизации
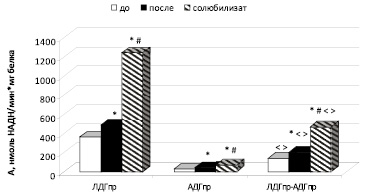
Рис. 2. Удельная активность лактатдегидрогеназы и алкогольдегидрогеназы и комплекса ЛДГпр-АДГпр в митохондриальной фракции печени крыс до и после солюбилизации. Примечания: * – статистически значимые различия при р < 0,05 по сравнению с активностью до солюбилизации; # – статистически значимые различия при р < 0,05 по сравнению с активностью после солюбилизации; < – статистически значимые различия при р < 0,05 по отношению к АДГпр; > – статистически значимые различия при р < 0,05 по отношению к ЛДГпр
Полученные результаты показали, что удельная активность прочно связанных форм ЛДГпр в митохондриальной фракции печени (после солюбилизации) в составе кластера АДГпр-ЛДГпр статистически значимо уменьшилась в 2,4 раза, удельная активность АДГпр, наоборот, возросла в 4,6 раза по сравнению с активностью ферментов в односубстратных реакциях (рис. 2). Снижение активности ЛДГпр происходило по типу псевдоингибирования, повышение активности АДГпр – по типу двухпараметрически рассогласованной активации. Выявлено понижение сродства и каталитической эффективности ЛДГпр кластера соответственно в 16 и 3,3 раза по сравнению с кинетическими характеристиками лактатдегидрогеназы в прямой реакции. Отмечено повышение коэффициента кооперативности и коэффициент структурных изменений АДГпр в составе ЛДГпр-АДГпр в 1,3 и 1,2 раза соответственно (таблица).
Кинетические свойства лактатдегидрогеназы, алкогольдегидрогеназы и кластера АДГ-ЛДГ в митохондриальной фракции печени крыс до и после солюбилизации
|
Показатели, (усл.ед.) |
Условия эксперимента |
ЛДГ |
АДГ |
АДГ-ЛДГ |
|||
|
ЛДГпр |
ЛДГобр |
АДГпр |
АДГобр |
АДГпр-ЛДГпр |
АДГобр-ЛДГобр |
||
|
Vmax |
Досолюбилизации |
11,04 ± 0,58 |
12,02 ± 0,05 |
1,62 ± 0,09 |
3,75 ± 0,19 |
9,67 ± 0,51&^ |
50,75 ± 2,68&^ |
|
После солюбилизации |
10,53 ± 0,56 |
8,48 ± 0,45 |
1,22 ± 0,07 |
7,74 ± 0,41 |
51,22 ± 2,70&^ |
25,56 ± 1,35&^ |
|
|
Солюбилизат. |
22,53 ± 1,19*# |
5,63 ± 0,29*# |
2,32 ± 0,12*# |
2,58 ± 0,14*# |
8,37 ± 0,44&^*# |
11,21 ± 0,59&^*# |
|
|
Ka |
До солюбилизации |
8,55 ± 0,45 |
9,65 ± 0,51 |
0,54 ± 0,029 |
4,27 ± 0,23 |
2,34 ± 0,12&^ |
6,20 ± 0,33 &^ |
|
После солюбилизации |
5,89 ± 0,32 |
5,32 ± 0,28 |
0,49 ± 0,03 |
2,36 ± 0,12 |
1,77 ± 0,09&^ |
5,87 ± 0,31^ |
|
|
Солюбилизат |
10,22 ± 0,54*# |
12,2 ± 0,64*# |
0,37 ± 0,02*# |
0,83 ± 0,04*# |
3,84 ± 0,20&^*# |
5,03 ± 0,27&^*# |
|
|
Kn |
До солюбилизации |
0,78 ± 0,05 |
0,78 ± 0,05 |
0,87 ± 0,05 |
0,73 ± 0,04 |
0,90 ± 0,05& |
0,95 ± 0,05&^ |
|
После солюбилизации |
0,82 ± 0,04 |
0,81 ± 0,05 |
0,86 ± 0,05 |
1,22 ± 0,06 |
0,98 ± 0,05&^ |
0,91 ± 0,05&^ |
|
|
Солюбилизат |
0,84 ± 0,05 |
0,66 ± 0,03*# |
1,09 ± 0,06*# |
1,24 ± 0,07* |
0,84 ± 0,05^# |
0,85 ± 0,05&^* |
|
|
Kd |
До солюбилизации |
1,56 ± 0,08 |
1,54 ± 0,09 |
1,75 ± 0,09 |
1,47 ± 0,08 |
1,81 ± 0,09& |
1,89 ± 0,10&^ |
|
После солюбилизации |
1,64 ± 0,09 |
1,61 ± 0,08 |
1,71 ± 0,09 |
2,44 ± 0,13 |
1,97 ± 0,10&^ |
1,81 ± 0,10&^ |
|
|
Солюбилизат |
1,69 ± 0,09 |
1,32 ± 0,07*# |
2,19 ± 0,12*# |
2,47 ± 0,13* |
1,69 ± 0,09^* |
1,69 ± 0,08&^* |
|
|
Kt |
До солюбилизации |
1,29 ± 0,07 |
1,25 ± 0,07 |
2,99 ± 0,16 |
0,88 ± 0,05 |
4,14 ± 0,22&^ |
8,18 ± 0,43&^ |
|
После солюбилизации |
1,79 ± 0,09 |
1,59 ± 0,09 |
2,50 ± 0,13 |
3,29 ± 0,17 |
29,0 ± 1,53 &^ |
4,35 ± 0,23&^ |
|
|
Солюбилизат |
2,20 ± 0,12*# |
0,46 ± 0,03*# |
6,31 ± 0,33*# |
3,12 ± 0,16* |
2,18 ± 0,11^*# |
2,23 ± 0,12&^*# |
|
Примечания: & – статистически значимые различия при р < 0,05 по отношению к группе ЛДГ; ^ – статистически значимые различия при р < 0,05 по отношению к группе АДГ; * – статистически значимые различия при р < 0,05 по отношению к группе ЛДГ, АДГ и ЛДГ-АДГ до солюбилизации; # – статистически значимые различия при р < 0,05 по отношению к группе АДГ, ЛДГ и ЛДГ-АДГ после солюбилизации.
Удельная активность и каталитическая эффективность лабильно связанных форм ЛДГпр в митохондриальной фракции печени (солюбилизат) у интактных животных в составе кластера АДГпр-ЛДГпр статистически значимо уменьшились в 2,7 раза, удельная активность АДГпр, наоборот, увеличилась в 6,9 раза по сравнению с активностью ферментов в односубстратных реакциях. Возросли также показатели Kn, Kd АДГпр надмолекулярного кластера АДГпр-ЛДГпр в 1,3 раза. Установлен механизм, посредством которого происходит снижение активности ЛДГпр, – неконкурентное ингибирование. Повышение активности алкогольдегидрогеназы в прямой реакции в составе кластера обусловлено двухпараметрически согласованной активацией [4].
Показано, что использование 0,15 М раствора NaCl вызывает статистически значимое повышение удельной активности односубстратной ЛДГпр, АДГпр в солюбилизате в 3,4 и 2,8 раза соответственно по сравнению с активностью ферментов до солюбилизации. Удельная активность ЛДГпр, АДГпр митохондрий после солюбилизации возросла в 1,3 и 1,8 раза по сравнению с активностью энзимов до солюбилизации. Выявлены статистически значимые отличия активности между прочно и лабильно связанными формами ЛДГпр и АДГпр. Удельная активность ЛДГпр, АДГпр солюбилизата выше в 2,5 и 1,5 раза соответственно по сравнению с активностью прочно связанных с мембраной ферментов.
Активность надмолекулярного кластера ЛДГпр-АДГпр в солюбилизате, во фракции митохондрий после солюбилизации статистически значимо повысилась в 3,4 и 1,5 раза по сравнению с активностью комплекса до солюбилизации. Удельная активность лабильно связанной формы кластера ЛДГпр-АДГпр выше активности прочно связанного с мембраной комплекса ферментов в 2,3 раза.
Выявлено, что удельная активность ЛДГобр в митохондриальной фракции печени до солюбилизации у интактных животных в составе кластера АДГобр-ЛДГобр статистически значимо не отличается от активности односубстратной реакции ЛДГобр. Удельная активность, каталитическая эффективность, значения коэффициентов Kn, Kd АДГобр статистически значимо увеличились в 2,4; 1,5; 1,3; 1,3 раза по сравнению с каталитическими и кинетическими свойствами фермента в односубстратной реакции (рис. 3; таблица). Повышение активности АДГобр обусловлено двухпараметрически рассогласованной активацией.
После солюбилизации удельная активность ЛДГобр и АДГобр в митохондриальной фракции печени крыс в составе кластера АДГобр-ЛДГобр статистически значимо увеличилась соответственно в 1,4 и 1,6 раза по сравнению с активностью ферментов в односубстратных реакциях по типу двухпараметрически рассогласованной активации.
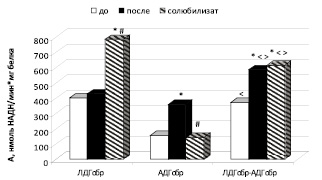
Рис. 3. Удельная активность лактатдегидрогеназы и алкогольдегидрогеназы и комплекса ЛДГобр-АДГобр в митохондриальной фракции печени крыс до и после солюбилизации. Примечания: * – статистически значимые различия при р < 0,05 по сравнению с активностью до солюбилизации; # – статистически значимые различия при р < 0,05 по сравнению с активностью после солюбилизации; < – статистически значимые различия при р < 0,05 по отношению к АДГобр; > – статистически значимые различия при р < 0,05 по отношению к ЛДГобр
Удельная активность лабильно связанных форм ЛДГобр в митохондриальной фракции печени (солюбилизат) у интактных животных в составе кластера АДГобр-ЛДГобр статистически значимо уменьшилась в 1,3 раза, удельная активность АДГобр, наоборот, увеличилась в 4,4 раза по сравнению с активностью ферментов в односубстратных реакциях (рис. 2). Отмечено снижение каталитической эффективности и сродства ЛДГобр кластера ЛДГобр-АДГобр в 2,4 и 4,8 раза соответственно. Каталитическая эффективность АДГобр комплекса и сродство фермента к субстрату возросли в 6,03 и 1,4 раза (таблица). Выявлен механизм, посредством которого происходит снижение активности ЛДГобр, – псевдоингибирование. Повышение активности алкогольдегидрогеназы в обратной реакции в составе кластера обусловлено двухпараметрически согласованной активацией [4].
Полученные результаты показали, что после солюбилизации происходит повышение удельной активности односубстратной лабильно связанной ЛДГобр в 1,9 раза по сравнению с активностью фермента до солюбилизации. Выявлены статистически значимые отличия активности между прочно и лабильно связанными формами ЛДГобр: удельная активность ЛДГобр солюбилизата выше в 1,8 раза.
Удельная активность АДГобр митохондрий после солюбилизации возросла в 2,3 раза по сравнению с активностью энзима до солюбилизации. Полученные результаты показали, что удельная активность прочно связанной односубстратной АДГобр статистически значимо выше в 2,5 раза по сравнению с лабильно связанной формой АДГобр.
После солюбилизации активность прочно и лабильно связанных фракций надмолекулярного комплекса ЛДГобр-АДГобр также возросла в 1,6 и 1,7 раза по сравнению с активностью кластера до солюбилизации (рис. 3).
Таким образом, использование 0,15 М раствора NaCl показало, что преобладающее количество общей суммарной активности ЛДГпр, АДГпр, ЛДГобр, кластера ЛДГпр-АДГпр интактных животных приходится на лабильно связанную с мембраной форму фермента (солюбилизат). Для АДГобр, надмолекулярного комплекса ЛДГобр-АДГобр крыс выявлено преобладание прочно связанных с мембраной форм энзимов.
До солюбилизации и в солюбилизате в составе кластера отмечено снижение удельной активности лактатдегидрогеназы как в прямой, так и в обратной реакциях, увеличение активности АДГпр и АДГобр по сравнению с односубстратными реакциями.
Показано, что после солюбилизации мембранносвязанных ферментов удельная активность ЛДГ, АДГ и их комплексов во фракциях прочно и лабильно связанных с мембранами ферментов возрастает по сравнению с активностью до солюбилизации. Для односубстратных реакций ферментов и энзимов гетерогенной системы (АДГ-ЛДГ) выявлены изменения кинетических характеристик лактатдегидрогеназы и алкогольдегидрогеназы, которые приводят к смещению направленности метаболизма клетки.
Т.о., в условиях внутриклеточного окружения ЛДГ и АДГ образуют кластерный надмолекулярный комплекс, в различной степени связанный с мембранами митохондрий. Каталитически активная конформация ферментов может в значительной степени формироваться мембраной. При связывании ЛДГ и АДГ с мембраной формируется оптимальное микроокружение, обеспечивающее нативную конформацию и каталитическую активность ферментов.
Рецензенты:
Корягин А.С., д.б.н., профессор кафедры физиологии и биохимии человека и животных, ГОУ ВПО «ННГУ им. Н.И. Лобачевского», г. Нижний Новгород;
Веселов А.П., д.б.н., профессор, заведующий кафедрой биохимии и физиологии растений, декан биологического факультета, ГОУ ВПО «ННГУ им. Н.И. Лобачевского», г. Н. Новгород.
Работа поступила в редакцию 12.07.2013.
Библиографическая ссылка
Соловьева А.Г., Уланова А.А., Зимин Ю.В. ОЦЕНКА ВЗАИМОДЕЙСТВИЯ НАДМОЛЕКУЛЯРНОГО КЛАСТЕРА «АЛКОГОЛЬДЕГИДРОГЕНАЗА–ЛАКТАТДЕГИДРОГЕНАЗА» С МЕМБРАНОЙ МИТОХОНДРИЙ ПЕЧЕНИ КРЫС // Фундаментальные исследования. 2013. № 8-6. С. 1400-1405;URL: https://fundamental-research.ru/ru/article/view?id=32145 (дата обращения: 20.02.2026).



