Черника обыкновенная (Vaccinium myrtillus L.) является одним из ценных растительных источников фенольных соединений, обладающих фармакологической активностью [3, 8]. Фармакопейным сырьем являются плоды воздушно-сухие и побеги [1, 2]. В настоящее время широкое применение препаратов на основе плодов черники при различных заболеваниях глаз связывают с содержащимися в них антоцианами, подклассом флавоноидов [8]. Побеги черники входят в состав противодиабетического сбора «Арфазетин-Э» [2]. Однако вопросы стандартизации плодов и побегов черники по-прежнему остаются нерешенным. Применяемая на территории Российской Федерации фармакопейная статья на воздушно-сухие плоды черники обыкновенной содержит далеко не все показатели качества, требуемые в соответствии с ОСТ 91500.05.001-00 «Стандарты качества лекарственных средств. Основные положения» к нормативным документам на лекарственное растительное сырье (отсутствует раздел «Микроскопия», не предусмотрено количественное определение действующих веществ, качественный анализ представлен пробирочными реакциями) [4]. На наш взгляд, стандартизацию плодов черники целесообразно проводить по содержанию антоцианов как наиболее уязвимой группе биологически активных соединений (БАС). Следует отметить, что в Европейской фармакопее, кроме воздушно-сухих, регламентируется качество свежих плодов, которые являются более перспективным источником антоцианов [7]. Стандартизация побегов черники в настоящее время осуществляется по содержанию дубильных веществ [3, 5]. Однако, с нашей точки зрения, гипогликемическое, противовоспалительное, капилляроукрепляющее, кардиопротективное, антиагрегантное действие, а также выявленная недавно ноотропная активность побегов также могут быть обусловлены другой группой БАС – флавоноидами [3, 6].
В связи с этим целью настоящего исследования было проведение фармакогностического исследования побегов и плодов черники обыкновенной и разработка методик их анализа.
Материалы и методы исследования
В исследовании использованы тонкослойная хроматография (ТСХ), адсорбционная жидкостная колоночная хроматография и спектроскопические методы. При использовании метода ТСХ разделение веществ проводили на пластинках «Сорбфил ПТСХ-АФ-А-УФ». Регистрацию спектров проводили с помощью спектрофотометра «Specord 40» (Analytik Jena) в диапазоне длин волн 190–700 нм.
Объектом исследования являлись побеги черники обыкновенной, заготовленные в Пензенской области и Республике Марий Эл в 2010–2011 гг., а также плоды черники обыкновенной свежезамороженные (ЗАО «Хладокомбинат западный», Московская область, г. Одинцово, ТУ 9165-002-47569210-00); образцы плодов из разных регионов РФ (Алтайский край, Республика Татарстан); плоды черники воздушно-сухие (ООО ПКФ «Фитофарм» (г. Анапа, Краснодарский край), ЗАО «Иван-Чай» (г. Москва).
Результаты исследования и их обсуждение
На первоначальном этапе нами была проведена работа по выделению действующих веществ из плодов и побегов черники обыкновенной с использованием метода адсорбционной жидкостной колоночной хроматографии.
При фитохимическом исследовании плодов на сорбент (силикагель L 40/100) наносили и высушивали на воздухе предварительно упаренный под вакуумом сок свежих плодов черники. Полученный порошок наносили на слой силикагеля, сформированный в хлороформе. Хроматографическую колонку элюировали хлороформом и смесью хлороформ-этанол (0,1 % НСl) в различных соотношениях (97:1; 97:2; 97:3; 95:5; 93:7; 90:10; 85:15; 80:20; 70:30, 60:40, 50:50; 40:60; 20:80, этанол). Контроль за ходом элюирования осуществляли с помощью ТСХ-анализа в системе н-бутанол-ледяная уксусная кислота-вода (4:1:2).
В результате нами был выделен ряд фракций, содержащих вещества антоциановой природы. После их очистки с помощью рехроматографии на полиамиде (Woelm) с использованием смеси хлороформа и этанола (0,01 % НСl) в градиентном режиме были выделены 3 доминирующих антоциана с Rf около 0,51; 0,36 и 0,20 в системе н-бутанол – ледяная уксусная кислота-вода (4:1:2) (рис. 1). Изучение электронных спектров показало, что кривые поглощения выделенных антоцианов имеют характерные максимумы при 281 ± 2 нм и в видимой области в интервале 538 ± 2 – 551 ± 2 нм. Для вещества с Rf 0,51 максимум поглощения соответствовал 538 ± 2 нм; для вещества с Rf 0,36 – 546 ± 2 нм; веществу с Rf 0,20 соответствовала длина волны при максимуме поглощения 551 ± 2 нм. На основании данных УФ- и 1Н-ЯМР-спектров соединение с Rf около 0,36 идентифицировано как цианидин-3-О-глюкозид.
Из побегов черники обыкновенной получали извлечение методом дробной модифицированной мацерации на 70 % этиловом спирте. Полученное извлечение упаривали под вакуумом и наносили на сорбент силикагель L 40/100. Хроматографирование проводили так же, как описано для плодов, но без добавления хлороводородной кислоты. Элюаты делили на фракции примерно равного объема (200 мл), которые затем упаривали под вакуумом. В дальнейшем для выделения индивидуальных веществ отдельные фракции рехроматографировали на полиамиде (Woelm) и силикагеле L 40/100. Дополнительную очистку проводили перекристаллизацией из спирта и воды. Ход хроматографического разделения и очистки веществ контролировали методом ТСХ в системе н-бутанол-ледяная уксусная кислота-вода (4:1:2) и этилацетат – безводная муравьиная кислота – вода (80:8:12) (рис. 2). Пятна на пластинке детектировали по свечению в УФ-свете при длине волны 254 и 366 нм и по окраске после обработки хроматограмм щелочным раствором диазобензолсульфокислоты.
Выделенные вещества были исследованы с помощью УФ-, 1Н-ЯМР-спектроскопии, масс-спектрометрии, различных химических превращений, ТСХ. Кислотный гидролиз выделенного доминирующего флавоноида проводили путем нагревания вещества с 10 % раствором кислоты хлороводородной на кипящей водяной бане в течение 2,5 ч. Ферментативный гидролиз проводили с использованием эмульсина при температуре 37 ± 2 °С. В результате были выделены вещества, которые предварительно идентифицированы как кверцетин-3-О-β-D-ксилопиранозид, кофейная кислота, даукостерин, упоминаемые в литературных источниках [9].
На наш взгляд, целесообразным для идентификации и подтверждения доброкачественности сырья является спектроскопический метод.
Извлечение из плодов черники в диапазоне длин волн 190–700 нм имеет максимумы поглощения в видимой (546 ± 2 нм) и УФ-области спектра (281 ± 2 нм). Соотношение оптических плотностей в УФ-области и в видимой области спектра (А282/А546) является показателем сохранности антоцианов в сырье. Для антоцианов и извлечения из свежих плодов это соотношение составляет примерно 1:1,5–1,8 (рис. 3). Для воздушно-сухих плодов это соотношение изменяется в пользу коротковолнового максимума и составляет 1,0:0,10–0,15 (рис. 3). Такое различие, вероятно, обусловлено изменением химического состава плодов черники в результате высушивания в пользу полифенольных соединений.

Рис. 1. ТСХ–анализ плодов: система растворителей н-бутанол – ледяная уксусная кислота – вода (4:1:2). Обозначения:1 – спиртовое извлечение из воздушно-сухих плодов черники;2 – спиртовое извлечение из плодов черники свежих; 3 – мальвидин-3-О-глюкозид; 4 – цианидин-3-О-глюкозид;5 – дельфинидин-3-О-глюкозид

Рис. 2. ТСХ-анализ побегов: система растворителей этилацетат – безводная муравьиная кислота – вода (80:8:12). Обозначения: 1 – раствор РСО рутина; 2 – извлечение из побегов черники обыкновенной на 70 % этиловом спирте; 3 – раствор кверцетин-3-О-β-D-ксилопиранозида; 4 – раствор кофейной кислоты
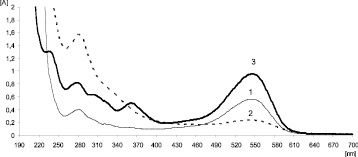
Рис. 3. Спектры поглощения водно-спиртового извлечения из свежих плодов черники обыкновенной (1), воздушно-сухих плодов черники обыкновенной (2) и цианидин-3-О-глюкозида (3) в 95 % этиловом спирте, содержащем 1 % НСl
Извлечение из побегов черники имеет максимумы поглощения при длинах волн 292 ± 2 и 331 ± 2 нм. Вклад в кривую поглощения могут вносить кверцетин-3-О-β-D-ксилопиранозид, кофейная кислота и другие присутствующие в сырье фенольные соединения (рис. 4, 5).
Для подтверждения доброкачественности лекарственного растительного сырья плодов и побегов черники обыкновенной нами были разработаны методики количественного определения действующих соединений в сырье.
В связи с тем, что антоцианы являются более биологически активной и в то же время более лабильной группой соединений, нами предлагается стандартизировать и свежие и воздушно-сухие плоды по содержанию антоцианов (в отличие от требований Европейской фармакопеи). Для целей стандартизации был определен удельный показатель поглощения выделенного цианидин-3-О-глюкозида в 1 % растворе хлороводородной кислоты в 95 % этиловом спирте при аналитической длине волны 546 нм, который составил 100 ± 4,3. Полученное значение удельного показателя поглощения было использовано при разработке методики количественного определения антоцианов в плодах черники. Сравнилась экстракционная способность спиртов различных концентраций, влияние рН, температуры, соотношения «сырье – экстрагент» и времени экстрагирования. Определено, что наибольший выход антоцианов из быстрозамороженных плодов черники наблюдается при использовании в качестве экстрагента 95 % этилового спирта, содержащего 1 % раствора хлороводородной кислоты, соотношение «сырье – экстрагент» – 1:50; время экстракции – 30 мин на кипящей водяной бане. Для воздушно-сухих плодов черники обыкновенной соответственно: экстрагент – 60 %-й этиловый спирт, содержащий 1 % хлороводородной кислоты; соотношение «сырье – экстрагент» – 1:50; время экстракции на водяной бане при температуре 85–90 °С в течение 90 мин. Содержание суммы антоцианов в исследуемых образцах свежих плодов составляло 3,80–4,10 %, для образцов воздушно-сухих плодов этот показатель варьировался от 4,04 до 4,79 %.
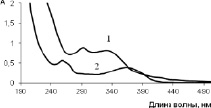
Рис. 4. Спектры поглощения извлеченияна 70 % спирте из побегов черники обыкновенной (1), раствора кверцетин-3-О-β-D-ксилопиранозида (2)
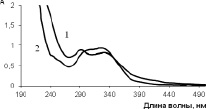
Рис. 5. Спектры поглощения извлечения на 70 % спирте из побегов черники обыкновенной (1) и раствора кофейной кислоты (2)
Побеги мы предлагаем анализировать по содержанию флавоноидов, которые также могут вносить существенный вклад в фармакологическое действие препаратов и более подвержены различным факторам окружающей среды в отличие от анализируемой в настоящее время группы дубильных веществ. При разработке методики количественного определения флавоноидов в побегах в связи со схожестью строения и химических свойств доминирующего флавоноида и рутина расчет содержания БАС проводили в пересчете на рутин. Анализ проводили методом дифференциальной спектрофотометрии с алюминия хлоридом при аналитической длине волны 420 нм, соответствующей максимальной разнице оптических плотностей извлечения после добавления алюминия хлорида и исходного извлечения. В ходе исследования было установлено, что оптимальным экстрагентом является 70 % этиловый спирт, который позволяет наиболее полно извлечь флавоноиды из сырья по сравнению с другими концентрациями; оптимальным является соотношение «сырье – экстрагент» – 1:50; время экстракции – 30 мин после закипания экстрагента на кипящей водяной бане. Содержание флавоноидов и исследуемых образцах варьировалось от 0,62 до 1,62 %.
Все результаты были статистически обработаны. Ошибка единичного определения суммы антоцианов в плодах черники воздушно-сухих с доверительной вероятностью 95 % составляет ± 3,52 %; в свежих плодах ± 4,54 %. Ошибка единичного определения суммы флавоноидов в побегах черники с доверительной вероятностью 95 % составляет ± 3,56 %.
Выводы
Таким образом, в ходе исследования:
– Проведено фитохимическое исследование надземных органов черники обыкновенной.
– Разработаны методики качественного анализа действующих веществ в используемых видах фармакопейного сырья черники обыкновенной (плодах и побегах) (методы тонкослойной хроматографии и электронной спектроскопии).
– Разработаны методики количественного анализа действующих веществ в плодах и побегах.
Разработанные методики качественного и количественного анализа включены в проекты фармакопейных статей на исследуемые виды сырья.
Рецензенты:
Шаталаев И.Ф., д.б.н., профессор, заведующий кафедрой химии фармацевтического факультета, ГБОУ ВПО «Самарский государственный медицинский университет» Министерства здравоохранения Российской Федерации, г. Самара;
Правдивцева О.Е., д.фарм.н., доцент кафедры фармакогнозии с ботаникой и основами фитотерапии, ГБОУ ВПО «Самарский государственный медицинский университет» Министерства здравоохранения Российской Федерации, г. Самара.
Работа поступила в редакцию 11.07.2013.
Библиографическая ссылка
Рязанова Т.К. ФАРМАКОГНОСТИЧЕСКОЕ ИССЛЕДОВАНИЕ ПЛОДОВ И ПОБЕГОВ ЧЕРНИКИ ОБЫКНОВЕННОЙ // Фундаментальные исследования. 2013. № 8-5. С. 1136-1140;URL: https://fundamental-research.ru/ru/article/view?id=32097 (дата обращения: 01.02.2026).



