Большинство заболеваний сердца связано с ишемией миокарда. Одной из причин ишемии может являться дефицит оксида азота (NO). Недостаточное кровоснабжение сердца вызывает метаболические нарушения в кардиомиоцитах, что, в свою очередь, приводит к развитию вторичной митохондриальной дисфункции. Митохондриальная дисфункция представляет собой патологический процесс, который может быть вызван различными повреждающими факторами, в частности, ишемией. Выделяют первичную митохондриальную дисфункцию, являющуюся следствием врождённого генетического дефекта, и вторичную, возникающую при некоторых приобретённых заболеваниях [2]. Вторичная митохондриальная дисфункция включается в патогенез хронической сердечной недостаточности и острого коронарного синдрома [2, 13]. Дисфункция митохондрий приводит к нарушению окислительного декарбоксилирования пирувата, окисления ацетил-КоА, окислительного фосфорилирования, β-окисления жирных кислот, непрямого окислительного дезаминирования аминокислот, системы антиоксидантной защиты и гиперпродукции митохондриями активных форм кислорода.
В свете вышесказанного целесообразным является поиск средств метаболической коррекции вторичной дисфункции митохондрий при заболеваниях сердца в условиях дефицита NO. Одним из возможных соединений, улучшающих метаболизм кардиомиоцитов при ишемии миокарда, является донор NO L-аргинин. На настоящий момент проведён ряд исследований, касающихся возможности применения аргинина в кардиологии [1]. Однако влияние этой аминокислоты на функционирование митохондрий кардиомиоцитов не изучалось.
Цель исследования: изучить влияние аргинина на содержание метаболитов NO, активность оксидоредуктаз митохондрий и процессы спонтанного окисления белков в ткани сердца крыс в условиях ингибирования синтеза NO, и, исходя из полученных данных, оценить действие аргинина на функциональное состояние митохондрий клеток сердца.
Материалы и методы исследования
Исследование проводилось на 40 крысах самцах линии Вистар массой 230–270 г. Крысы были разделены на 5 групп, каждая из которых включала по 8 животных. Первой группе ежедневно в течение 7 дней 1 раз в сутки внутрибрюшинно вводился 0,9 % раствор NaCl, второй и третьей группам ежедневно в течение 7 дней 1 раз в сутки внутрибрюшинно вводился водный раствор L-NG-нитроаргинина метилового эфира (L-NAME) – неселективного ингибитора NO-синтазы в дозах 25 и 200 мг/кг соответственно, четвёртой и пятой группам на фоне ежедневного в течение 10 дней введения 1 раз в сутки per os раствора аргинина в дозе 500 мг/кг на 0,9 % растворе NaCl внутрибрюшинно вводился в течение 7 дней 1 раз в сутки водный раствор L-NAME в дозах 25 и 200 мг/кг соответственно. Выбор доз проводился на основе литературных данных [1, 7, 11, 14].
При работе с крысами руководствовались «Правилами проведения работ с использованием экспериментальных животных». Умерщвление животных проводилось под эфирным наркозом путём вскрытия брюшной полости и пересечения спинной аорты.
Сыворотку крови использовали для определения содержания в ней метаболитов NO. Из ткани сердца с помощью гомогенизатора Potter S получали гомогенат и выделяли из него митохондрии методом дифференциального центрифугирования [10]. Для оценки окислительной модификации белков использовали надосадочную жидкость, а осадок, содержащий митохондрии, ресуспендировали в 0,25 М растворе сахарозы с добавлением детергента Тритона Х-100 (для разрушения митохондриальных мембран) и далее использовали для определения активности митохондриальных ферментов: сукцинатдегидрогеназы, митохондриальной Mn-зависимой супероксиддисмутазы, α-гидроксибутиратдегидрогеназы и глутаматдегидрогеназы, а также для измерения концентрации метаболитов NO в митохондриях.
Общее содержание белка в пробах определяли по методу Лоури с помощью стандартизированного набора DiaSyS Diagnostic Systems. Окислительную модификацию белков оценивали с помощью метода R.L. Levine [12] в модификации Е.Е. Дубининой [5], основанного на реакции взаимодействия карбонильных групп и иминогрупп окисленных аминокислотных остатков с 2,4-динитрофенилгидразином (2,4-ДНФГ) с образованием 2,4-динитрофенилгидразонов, обладающих специфическим спектром поглощения в ультрафиолетовой и видимой областях спектра. Оптическую плотность образовавшихся динитрофенилгидразонов регистрировали на спектрофотометре СФ-2000 при длинах волн 254, 270, 280, 356, 363, 370, 430 и 530 нм.
Активность α-гидроксибутиратдегидрогеназы и глутаматдегидрогеназы измеряли с помощью стандартизированных наборов Dia SyS Diagnostic Systems.
Активность сукцинатдегидрогеназы исследовали с помощью метода, основанного на определении восстановленного гексацианоферрата [10]. Активность супероксиддисмутазы определяли при помощи метода В.А. Костюка [6].
Определение концентрации метаболитов NO (нитритов и нитратов) проводили с помощью метода в модификации В.А. Метельской [8] на иммуноферментном анализаторе StatFax 3200.
Полученные в ходе исследования результаты обрабатывались с помощью программы Microsoft Excel 2003. Для определения различий между независимыми группами использовали U-критерий Манна‒Уитни. Уровень отличий рассматривался как статистически значимый при вероятности ошибки (p) < 0,05.
Результаты исследованияи их обсуждение
Из таблицы 1 видно, что введение L-NAME вызывает дозозависимое снижение концентрации метаболитов NO и в сыворотке крови, и в митохондриях сердца. Менее выраженное снижение концентрации метаболитов NO в митохондриях сердца по сравнению с сывороткой крови может быть связано с особенностями распределения L-NAME в организме или с некоторой селективностью его действия в отношении конститутивных форм NO-синтаз [4]. По-видимому, L-NAME как ингибитор оказывает более выраженное действие на эндотелиальную NO-синтазу, являющуюся главным поставщиком NO для крови, чем на индуцибельную NO-синтазу, являющуюся главным продуцентом NO в митохондриях сердца (фермент экспрессируется в сердце как при патологии, так и в норме, и обладает в сотни раз большей активностью, чем конститутивные формы NO-синтаз [3]).
Аргинин при совместном введении с L-NAME в обеих дозах увеличивает концентрации метаболитов NO как в сыворотке крови, так и в митохондриях клеток сердца. Это косвенно указывает на способность аргинина активировать синтез NO даже при ингибировании NO-синтаз.
Применение L-NAME приводит к снижению активности α-гидроксибутиратдегидрогеназы, практически не зависящему от дозы ингибитора NO-синтазы. Введение аргинина не вызывает достоверного изменения активности фермента на фоне L-NAME в дозе 25 мг/кг, но приводит к резкому (в 4,3 раза) увеличению активности α-гидроксибутиратдегидрогеназы на фоне L-NAME в дозе 200 мг/кг. α-гидроксибутиратдегидрогеназной активностью обладают 2 изофермента лактатдегидрогеназы (ЛДГ) – ЛДГ-1 и ЛДГ-2, так как только эти 2 изофермента ЛДГ способны катализировать обратимую реакцию превращения α-гидроксибутирата в 2-оксобутират. В митохондриях клеток сердца в отличие от цитоплазмы кардиомиоцитов нет ЛДГ-2, а присутствует только ЛДГ-1 (и не измеряемая данным методом ЛДГ-5). Митохондриальная ЛДГ-1 связана с внешней стороной внутренней мембраны митохондрий, её активный центр обращён в матрикс. Этот фермент является составной частью митохондриального лактат-окисляющего комплекса, обеспечивающего дегидрирование лактата и одновременно транспорт образующегося пирувата в митохондрию [9]. Обратная реакция восстановления пирувата в лактат в митохондриях сердца малоактивна. Поэтому повышение активности α-гидроксибутиратдегидрогеназы митохондрий должно свидетельствовать об активации процесса окисления лактата.
Концентрация метаболитов NO, общий белок и показатели активности ферментов митохондрий (результаты представлены в форме:среднее значение ± стандартное отклонение, M ± s)
|
0,9 %-й раствор NaCl в/б |
L-NAME 25 мг/кг в/б |
L-NAME 200 мг/кг в/б |
L-NAME 25 мг/кг в/б + аргинин 500 мг/кг per os |
L-NAME 200 мг/кг в/б + аргинин 500 мг/кг per os |
|
|
Концентрация метаболитов NO в сыворотке крови, мкмоль/л |
111,84 ± 9,09 |
74,62 ± 8,56* (↓33,28 %) |
31,73 ± 12,88* (↓71,63 %) |
89,69 ± 13,06** (↑16,3 %) |
49,16 ± 5,06** (↑35,2 %) |
|
Концентрация метаболитов NO в митохондриях клеток сердца, мкмоль/л |
96,62 ± 19,33 |
77,98 ± 13,24* (↓19,2 %) |
52,82 ± 13,81* (↓45,33 %) |
108,66 ± 11,33** (↑28,4 %) |
105,13 ± 10,02** (↑49,1 %) |
|
Общий белок неседиментированной фракции, мг/мл |
4,54 ± 1,12 |
3,86 ± 1,71 |
6,31 ± 1,02* |
6,79 ± 1,10** |
8,06 ± 0,55** |
|
Общий белок митохондриальной фракции, мг/мл |
4,44 ± 1,16 |
3,35 ± 0,74 |
4,98 ± 1,88 |
8,95 ± 1,05** |
5,49 ± 2,47 |
|
Активность α-гидроксибути_ратдегидрогеназы, ЕД/г белка |
63,07 ± 15,63 |
42,09 ± 9,55* |
45,61 ± 13,69* |
39,3 ± 3,63** |
169,11 ± 42,47** |
|
Активность глутаматдегидрогеназы, ЕД/г белка |
9,38 ± 1,39 |
6,75 ± 1,99* |
2,22 ± 0,94* |
10,28 ± 1,77** |
4,02 ± 0,45** |
|
Активность сукцинатдегидрогеназы, нмоль сукцината/мин на г белка |
18,17 ± 2,87 |
32,78 ± 5,91* |
8,31 ± 2,16* |
14,64 ± 5,07 |
15,12 ± 4,66 |
|
Активность супероксиддисмутазы, оптическая плотность, у.е./ мг белка |
16,66 ± 7,29 |
83,51 ± 34,61* |
69,95 ± 15,42* |
10,37 ± 3,40** |
6,57 ± 3,27** |
Примечания:
* – достоверные отличия от группы, получавшей 0,9 %-й раствор NaCl (p < 0,05);
** – достоверные отличия от групп, получавших L-NAME в соответствующих дозах (p < 0,05).
Активность глутаматдегидрогеназы под действием L-NAME достоверно дозозависимо снижается на 28,15 % при дозе 25 мг/кг и на 76,46 % при дозе 200 мг/кг. Введение аргинина на фоне L-NAME в дозе 25 мг/кг приводит к увеличению активности фермента более чем в 1,5 раза, а на фоне L-NAME в дозе 200 мг/кг – в 1,8 раз. Значительное увеличение активности глутаматдегидрогеназы под действием аргинина объясняется избыточным поступлением аминокислот в организм животного, что приводит к необходимости их утилизации путём непрямого окислительного дезаминирования.
Активность сукцинатдегидрогеназы под действием L-NAME изменяется разнонаправлено: доза 25 мг/кг приводит к достоверному увеличению активности фермента в 1,8 раза, а доза 200 мг/кг – к её снижению в 2,2 раза. Введение аргинина на фоне L-NAME в дозе 25 мг/кг приводит к снижению активности фермента в 2,2 раза, а на фоне L-NAME в дозе 200 мг/кг – к повышению его активности в 1,8 раз, но эти изменения не являются статистически значимыми. Интересно, что при использовании аргинина в обоих случаях активность сукцинатдегидрогеназы близка к значению контрольной группы, то есть имеет место нормализация активности фермента под действием аргинина в условиях ингибирования синтеза NO.
Введение L-NAME в дозе 25 мг/кг приводит к увеличению активности супероксиддисмутазы более чем в 4 раза, а в дозе 200 мг/кг – в 3,2 раза. Аргинин вызывает резкое снижение активности фермента как на фоне L-NAME в дозе 25 мг/кг в 8 раз, так и на фоне L-NAME в дозе 200 мг/кг в 10,7 раза. Этот эффект аргинина, видимо, обусловлен его антиоксидантным действием.
Введение L-NAME в дозе 25 мг/кг достоверно (p < 0,05 – по сравнению с контрольной группой) снижает показатели спонтанной ОМБ при длине волны 430 нм в 49,5 раз (рисунок). L-NAME же в дозе 200 мг/кг достоверно снижает значения спонтанной ОМБ при λ = 356 нм на 38,2 % (p < 0,01 – по сравнению с контрольной группой), а при 363 нм – на 31,3 % (p < 0,05 – по сравнению с контрольной группой). Введение аргинина на фоне L-NAME в дозе 25 мг/кг снижает показатели спонтанной ОМБ при длинах волн 356 и 363 нм соответственно в 3,4 и 2,6 раз, а на фоне L-NAME в дозе 200 мг/кг – при длинах волн 356, 363 и 370 нм соответственно в 1,8, 1,7 и 1,6 раз (p < 0,05 – по сравнению с группами, получавшими L-NAME в соответствующих дозах). Таким образом, аргинин снижает количество как ранних маркёров окислительной деструкции белков – нейтральных альдегиддинитрофенилгидразонов (их максимум поглощения 356 нм), так и поздних – нейтральных кетондинитрофенилгидразонов (максимумы поглощения 363 и 370 нм). Такая динамика указывает на непрямой антиоксидантный эффект аргинина, который, по-видимому, не связан с его действием на активность митохондриальных оксидоредуктаз.
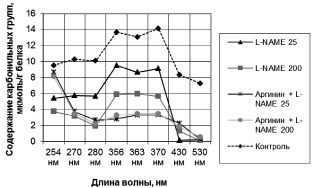
Результаты спонтанной ОМБ: содержание карбонильных групп на 1 г белка в пробе
Выводы
Ингибирование синтеза NO под действием L-NAME приводит к статистически значимым изменениям активности изучаемых ферментов митохондрий и развитию вторичной митохондриальной дисфункции.
Аргинин стимулирует образование метаболитов NO в сыворотке крови и ещё более выражено в митохондриях ткани сердца крыс в условиях ингибирования синтеза NO, вызванного L-NAME.
Действие аргинина на метаболизм клеток сердца крыс можно в целом оценить как положительное, потому что он замедляет процессы свободно-радикального окисления белков в цитоплазме этих клеток и нормализует активность большинства ферментов митохондрий, способствуя компенсации митохондриальной дисфункции.
Рецензенты:
Булатецкий С.В., д.м.н., профессор кафедры уголовного процесса и криминалистики, полковник полиции, Рязанский филиал ФГКОУ ВПО «Московский университет Министерства внутренних дел Российской Федерации», г. Рязань;
Емельянова А.С., д.б.н., профессор кафедры технологии производства и переработки продукции животноводства, ФГБОУ ВПО «Рязанский государственный агротехнологический университет имени П.А. Костычева», г. Рязань.
Работа поступила в редакцию 15.07.2013.
Библиографическая ссылка
Звягина В.И., Медведев Д.В., Бельских Э.С., Фрольцов Д.В. ВОЗДЕЙСТВИЕ ДОНОРА ОКСИДА АЗОТА (II) L-АРГИНИНА НА АКТИВНОСТЬ МИТОХОНДРИАЛЬНЫХ ОКСИДОРЕДУКТАЗ И ОКИСЛИТЕЛЬНЫЕ ПРОЦЕССЫ В ТКАНИ СЕРДЦА КРЫС В УСЛОВИЯХ ДЕФИЦИТА ОКСИДА АЗОТА // Фундаментальные исследования. 2013. № 8-5. С. 1087-1091;URL: https://fundamental-research.ru/ru/article/view?id=32089 (дата обращения: 21.12.2025).



