Определение содержания родия в минеральном сырье является важной аналитической задачей. В качестве методов анализа для этой цели могут быть использованы вольтамперометрические методы, так как они позволяют с достаточной степенью точности определять микроколичества различных металлов. Метод инверсионной вольтамперометрии (ИВ) относится к высокочувствительным инструментальным методам анализа. Однако при определении родия этим методом возникают определенные трудности. Зафиксировать процесс электровосстановления ионов родия (III) на графитовом электроде (ГЭ) на вольтамперных кривых не удается. Это связано с параллельно протекающим процессом каталитического выделения водорода, что приводит к перекрытию процесса электровосстановления ионов родия (III). Процесс электроокисления осадка родия протекает при потенциалах больше 1 В и перекрывается процессом выделения кислорода.
Определение ионов родия (III) осуществляют электроосаждением родия совместно с менее благородным металлом (металлом-активатором). Так в литературе имеются данные по электровосстановлению родия совместно с ртутью [3]. На вольтамперных кривых фиксируются пики, связанные с электроокислением как чистых электроотрицательных компонентов бинарного сплава, так и дополнительные анодные пики при более положительных потенциалах. Однако природа дополнительных анодных пиков не была до сих пор выяснена.
Целью данной работы было изучить процессы электроокисления бинарных электролитических осадков на основе родия и оценить природу наблюдаемых анодных пиков, используя метод инверсионной вольтамперометрии.
Материал и методы исследования
Все исследования в работе проводили с использованием вольтамперометрических анализатора ТА–4 (ООО «НПП «ТомьАналит», г. Томск) в комплекте с персональным компьютером. В качестве электролизера использовались кварцевые стаканчики объемом 20 см3. Индикаторным электродом служил импрегнированный полиэтиленом графитовый электрод (ГЭ). Электродом сравнения служил хлоридсеребряный электрод (х.с.э.), заполненный насыщенным раствором KCl.
Электроосаждение бинарных электролитических осадков проводилось из растворов, содержащих ионы ртути (II) и родия (III), ионы индия (III) и родия (III). Родий применялся в виде хлоридного комплекса [RhCl6]3–. Электрохимическую очистку поверхности электрода проводили в фоновом электролите в течение минуты при потенциале + 1,0 В. Поверхность электрода обновляли после каждого измерения. Перемешивание раствора в процессе электролиза осуществлялось автоматически путем вибрации рабочего электрода, что предусмотрено используемыми анализаторами. Все исследования были проведены с использованием реактивов квалификации не ниже «х.ч.» при нормальных условиях.
Результаты исследования и их обсуждение
Система ртуть-родий
Характерные вольтамперные кривые электроокисления бинарного электролитического осадка ртуть-родий c поверхности графитового электрода представлены на рис. 1. Пик при потенциале +0,06 В соответствует процессу электроокисления ртути, осажденной на поверхность ГЭ (фазовый пик ртути). Пик при потенциале +0,33 В зависит как от концентрации ионов родия (III) в растворе, так и от концентрации ионов ртути (II).
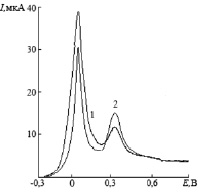
Рис. 1. Вольтамперные кривые электроокисления осадка ртуть-родий с поверхности ГЭ. Условия опытов: фон 1 M HCI, потенциал электролиза – Eэ = –1 В время электролиза – τэ = 100 с, скорость развертки – W = 80 мВ/с, 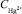 = 100 мг/дм3;1 –
= 100 мг/дм3;1 – 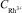 = 0,1 мг/дм3; 2 –
= 0,1 мг/дм3; 2 – 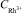 = 0,2 мг /дм3
= 0,2 мг /дм3
Дальнейшее увеличение концентрации ионов родия (III) (кривая 2) приводит к уменьшению пика при потенциале + 0,06 В и к увеличению дополнительного анодного пика при потенциале + 0,33 В. Причем ток дополнительного анодного пика (кривые 1 и 2) прямо пропорционален концентрации ионов родия (III) в растворе. Потенциал дополнительного анодного пика не изменяется при изменении содержания родия в электролитическом осадке, что указывает на постоянство фазовой структуры, из которой происходит электроокисление родия.
Экспериментальные исследования, проведенные нами, позволили установить, что в условиях постоянства количества ртути и переменного количества родия в осадке, суммарное количество электричества, расходуемое на окисление ртути из сплава с родием остается постоянным. Это возможно, если дополнительный анодный пик при потенциале +0,33 В обусловлен селективным электроокислением ртути из интерметаллического соединения (ИМС) с родием.
Согласно фазовой диаграмме [5], ртуть и родий образуют между собой три ИМС состава RhHg5, RhHg4.53, RhHg2,что соответствует мольным долям родия 0,17; 0,18; 0,33. Селективное электроокисление из разных по составу ИМС должно формировать анодные пики при разных потенциалах.
Ранее было показано [2], что смещение потенциала анодного пика ртути при образовании на электроде твердого раствора или ИМС можно рассчитать по соотношению:
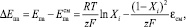 (1)
(1)
где Епа – потенциал анодного пика электроотрицательного компонента в чистой фазе; 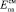 – потенциал анодного пика при его селективном электроокислении из сплава; εсмсм – интегральная теплота смешения компонентов при образовании твердого раствора или ИМС; Xi – мольная доля электроположительного компонента в сплаве.
– потенциал анодного пика при его селективном электроокислении из сплава; εсмсм – интегральная теплота смешения компонентов при образовании твердого раствора или ИМС; Xi – мольная доля электроположительного компонента в сплаве.
Как известно, теплоты смешения при сплавообразовании равносильны образованию ковалентной связи между металлами. Рассчитать энергию связи двух металлов в кристаллической решетке можно с помощью корреляционного уравнения Полинга [6]:
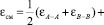
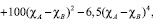 (2)
(2)
где εA–A, εB–B – энергия разрыва связи металл–металл; χA, χB – электроотрицательности компонентов сплава.
В литературе отсутствуют данные по энергии связи Rh–Rh, поэтому энергия связи была рассчитана нами по теплоте сублимации родия [1, 4].
Таким образом, для расчета энергии смешения были использованы энергии разрыва связи металл–металл: εHg–Hg = 35,081 кДж/моль; εRh–Rh = 99,802 кДж/моль, и электроотрицательности металлов: χRh = 2,28; χHg = 2. Рассчитанная по этим данным теплота смешения компонентов родия и ртути равна 67,45 кДж /моль.
Зная теплоту смешения, можно рассчитать величину смещения потенциалов пиков селективного электроокисления ртути из ИМС с родием, относительно потенциала пика электроокисления ртути с поверхности графитового электрода для анодного пика, наблюдаемого на вольтамперной кривой, а затем и потенциалы анодных пиков ртути из ИМС с родием по формуле:
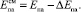 (3)
(3)
Результаты расчета потенциала анодных пиков селективного электроокисления ртути из ИМС с родием приведены в табл. 1.
Таблица 1
Сравнение рассчитанных и экспериментально определенных значений потенциалов пиков селективного электроокисления ртути из ИМС с родием
|
Потенциал анодного максимума Hg, В (Eпа(Hg) = 0,06 В) |
Состав ИМС |
||
|
RhHg5 XRh = 0,17 |
RhHg4,53 XRh = 0,18 |
RhHg2 XRh = 0,33 |
|
|
Eпа, расч, |
–0,26 |
–0,28 |
–0,17 |
|
Eпа, расч, |
0,32 |
0,34 |
0,23 |
|
Eпа, эксп, |
0,33 |
- |
– |
По рассчитанным потенциалам смещения пика электроокисления ртути можно оценить потенциал дополнительного анодного пика и сделать вывод о том, какой фазовой структуре соответствует пик селективного электроокисления ртути из ИМС с родием. Данные табл. 1 показывают, что наблюдаемый нами анодный пик при потенциале +0,33 В соответствует селективному электроокислению ртути из ИМС с родием состава RhHg5. Величину тока данного дополнительного анодного пика можно использовать в аналитических целях для определения Rh(III).
Система индий-родий
Совместное электроосаждение бинарного сплава индий-родий проводилось при потенциале предельного тока индия –1 В. Данных по описанию вольтамперных кривых электроокисления компонентов из бинарного сплава родий-индий в литературе нет.
При электроокислении осадка родий-индий на вольтамперной кривой, представленной на рис. 2, кроме фазового пика электроокисления индия при потенциале –0,68 В, наблюдается дополнительный анодный пик при потенциале –0,04 В. Нами также было замечено, что ток дополнительного анодного пика (кривые 1 и 2) прямо пропорционален концентрации ионов родия (III) в растворе. Дополнительный анодный пик удалось зафиксировать на вольтамперной кривой при соотношении компонентов в растворе равным или менее СIn: СRh = 1000:1.
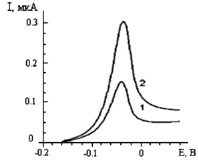
Рис. 2. Дополнительный анодный пик при электроокислении осадка индий-родий с поверхности ГЭ. Условия опытов: фон – 1 М HCl, Еэ = – 1В; τэ = 100 с, W = 80 мВ/с;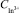 = 300 мг/ дм3;1 –
= 300 мг/ дм3;1 – 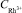 = 0,5 мг/дм3; 2 –
= 0,5 мг/дм3; 2 – 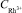 = 1 мг/дм3
= 1 мг/дм3
Экспериментальные исследования, проведенные нами, позволили установить, что в условиях постоянства количества индия (III) в растворе и переменного количества родия (III), суммарное количество электричества, расходуемое на окисление индия из сплава с родием, остается постоянным. Это возможно, если дополнительный анодный пик при потенциале –0,04 В обусловлен селективным электроокислением индия из интерметаллического соединения с родием.
Согласно фазовой диаграмме [5], индий и родий образуют между собой три ИМС состава In3Rh, In2Rh, InRh, что соответствует мольным долям родия 0,25; 0,33; 0,5. Селективное электроокисление индия из разных по составу ИМС должно формировать анодные пики при разных потенциалах, однако в данном случае дополнительный пик только один. Для установления состава ИМС, из которого происходит селективное электроокисление индия, был использован расчетный метод по уравнениям (1)–(3). Для расчета энергии смешения по формуле (2) были использованы энергии разрыва связи металл – металл: εIn–In = 30,135 кДж/моль; εRh–Rh = 99,802 кДж/моль, и электроотрицательности металлов: χIn = 1,78; χRh = 2,28; εсм = 146,6 кДж/моль. Результаты расчетов приведены в табл. 2.
Таблица 2
Рассчитанные и экспериментально наблюдаемые значения потенциалов анодных пиков селективного электроокисления индия из ИМС с родием
|
Потенциал анодного пика индия, В (Eпа(In) = –0,68В) |
Состав ИМС |
||
|
In3Rh XRh = 0,25 |
In2Rh XRh = 0,33 |
InRh XRh = 0,5 |
|
|
Eпа, расч, |
–0,63 |
–0,17 |
–0,094 |
|
Eпа, расч, |
–0,05 |
–0,51 |
–0,59 |
|
Eпа, эксп, |
–0,04 |
– |
– |
Из табл. 2 видно, что полученный экспериментально пик селективного электроокисления индия из ИМС с родием соответствует фазовой структуре In3Rh c мольной долей родия 0,25. По величине тока данного пика возможно определять содержание ионов Rh(III) в анализируемых растворах методом ИВ.
Выводы
1. Методом инверсионной вольтамперометрии изучены процессы электроокисления бинарных электролитических осадков ртуть-родий и индий-родий. Показано, что на вольтамперной кривой, кроме пиков электроокисления чистых компонентов (ртуть или индий) при более положительных потенциалах наблюдается дополнительный пик, ток которого зависит как от концентрации ионов ртути (II) или индия (III), так и от концентрации ионов родия (III) в растворе.
2. Установлено, что наблюдаемые дополнительные анодные пики обусловлены селективным электроокислением ртути или индия из ИМС с родием.
3. Расчетным путем оценены фазовые составы ИМС ртути или индия с родием, селективное электроокисление отрицательных компонентов из которых (Hg5Rh или In3Rh) приводит к появлению на вольтамперной кривой дополнительного анодного пика.
4. Показано, что токи этих пиков можно использовать в аналитических целях для определения родия методом инверсионной вольтамперометрии.
Рецензенты:
Мокроусов Г.М., д.х.н., профессор, заведующий кафедрой аналитической химии, ФГБОУ ВПО «Национальный исследовательский Томский государственный университет», г. Томск;
Ковалева С.В., д.х.н., профессор, заведующая кафедрой неорганической химии, ФГБОУ ВПО «Томский государственный педагогический университет», г. Томск.
Работа поступила в редакцию 01.07.2013.Библиографическая ссылка
Пакриева Е.Г., Нестеров А.А., Колпакова Н.А. ОЦЕНКА ФАЗОВОГО СОСТАВА ЭЛЕКТРОЛИТИЧЕСКИХ ОСАДКОВ, СОДЕРЖАЩИХ РОДИЙ (III) МЕТОДОМ ИНВЕРСИОННОЙ ВОЛЬТАМПЕРОМЕТРИИ // Фундаментальные исследования. 2013. № 8-3. С. 692-695;URL: https://fundamental-research.ru/ru/article/view?id=31983 (дата обращения: 01.03.2026).



