Эффективность извлечения рения из различных по природе и содержанию минеральных объектов неразрывно связана с уровнем развития аналитической химии этого металла. Ранее для определения рения использовали спектрофотометрию, гравиметрию, кинетические, электрохимические, экстракционно-флуориметрические методы, рентгено-флуоресцентный анализ [1].
В современной аналитической практике для определения рения широко используют такие мощные методы, как атомно-эмиссионная спектроскопия с индуктивно связанной плазмой (АЭС-ИСП), масс-спектрометрия с индуктивно связанной плазмой (ИСП-МС), эффективные электрохимические методы [2].
Несмотря на высокую чувствительность современных методов, прямое определение рения затрудненно вследствие низких содержаний элемента в анализируемых объектах и мешающего влияния матричных компонентов. Поэтому часто применяют концентрирование из анализируемых растворов и отделение его от матрицы.
На базе ИНОЦ «Золото-платина» каф. ГРПИ, Института природных ресурсов НИ ТПУ (г. Томск) разработана новая методика вольтамперометрического определения количественного содержания рения в природных минералах и рудах, включающая в себя дистилляционный способ подготовки анализируемых проб.
Электрохимические реакции, приводящие к появлению каталитических токов, известны уже давно. Еще в тридцатых годах было установлено, что даже следы некоторых металлов резко снижают перенапряжение выделения водорода. В присутствии платиновых соединений этот эффект становится заметным даже при их концентрации порядка 10–7 моль/л [4].
Впервые каталитическую волну водорода для определения рения предложил Гейровский [6]. Он определял до 10–6 моль/лRe в марганцевых солях на фоне ацетатного буферного раствора (рН 4,7) после обработки его сероводородом. Каталитическая волна, обусловленная ионом 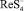 , отвечает –1,2 В. В фосфатном буферном растворе (рН 7) каталитическая волна наблюдается при – 1,6 В. Диффузионный ток этой волны значительно выше, чем это теоретически соответствует процессу простого восстановления
, отвечает –1,2 В. В фосфатном буферном растворе (рН 7) каталитическая волна наблюдается при – 1,6 В. Диффузионный ток этой волны значительно выше, чем это теоретически соответствует процессу простого восстановления 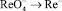 . Лингейн предполагает следующий механизм восстановления
. Лингейн предполагает следующий механизм восстановления 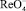 в этом буфере [3]:
в этом буфере [3]:
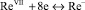
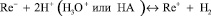
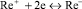
Известна методика каталитического определения рения, предложенная Гиёрбиро [5]. Им предложено использовать систему:
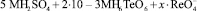 .
.
Рений катализирует процесс окисления теллура с появлением каталитической волны на ртутно-капающем электроде, что позволяет определять его в интервале от 4∙10–7 до 1∙10–5 М.
Целью работы было исследование электрохимического поведения Re(VII) в растворах пероксида водорода на ртутно-пленочных электродах и разработка методики вольтамперометрического определения рения(VII) в минеральном сырье.
Материалы и методы исследования
В работе использовали вольтамперометрический анализатор типа ТА-4 (НПП «Томьаналит», г. Томск) с трехэлектродной ячейкой. Перемешивание раствора осуществлялось с помощью встроенной в анализатор автоматической функции вибрации электродов. Рабочим электродом был ртутно-пленочный электрод (РПЭ); электродом сравнения и вспомогательным электродом служили насыщенные хлоридсеребрянные электроды. Электролизером служили стаканчики из оптически прозрачного кварца объемом 20 см3. Вольтамперометрические измерения проводили на фоне 0,1 MH2SO4 с добавлением H2O2. Рабочие растворы рения (VII) готовили разбавлением стандартных образцов от фирмы «Merck» разбавлением 1 МHCl. Все использовавшиеся реактивы были марки «х.ч.» или «ос.ч.». Приготовление растворов осуществлялось с использованием бидистиллированной воды.
Результаты исследования и их обсуждение
Пероксид водорода восстанавливается на ртутном катоде в соответствии с уравнением
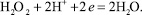 (1)
(1)
В кислых растворах этот процесс протекает при Е1/2 = −0,9 В нас.в.э. Добавление некоторых веществ к раствору приводит к резкому смещению потенциала и появлению каталитического тока [2].
Возникновение каталитических токов в присутствии некоторых металлов в среде пероксида водорода может быть связано с двумя факторами:
1. Процессами двойного катализа: ион металла-катализатора восстанавливается под активирующим действием пероксида водорода, потом происходит химическое восстановление пероксида водорода образующейся восстановленной формой металла-катализатора.
2. Образованием достаточно прочных комплексных соединений, в которых пероксид водорода входит во внутреннюю сферу комплекса в виде недиссоциируемой молекулы в качестве аниона.
При вольтамперометрических исследованиях получена катодная каталитическая волна в виде пика в области потенциалов от 0,0 до 0,20 В (рис. 1).
Данная каталитическая волна, образующаяся в кислых растворах соединений Re(VII), была изучена на фонах различных кислот (HCl, H3PO4, H2SO4, HClO4), содержащих Н2О2. На рис. 2 приведены градуировочные зависимости токов электрокаталитического разложения пероксида водорода от концентрации перренат-ионов в этих растворах.
Наибольшей чувствительностью и лучшей воспроизводимостью обладает раствор 1 МH2SO4, содержащий 0,03 моль/дм3 Н2О2.
Изучение влияния концентрации пероксида водорода на ток катодного пика показало, что кривая имеет предел тока, который обусловлен концентрацией Н2О2 при постоянной концентрации перренат-ионов в растворе (рис. 3).
Для определения низких содержаний перренат-ионов в пробах методом вольтамперометрии целесообразно использовать концентрацию пероксида водорода в растворе 0,03…0,045 моль/дм3.
Мерой скорости реакции химического взаимодействия 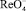 с пероксидом водорода является ток пика электрокаталитической реакции (1). Изучение зависимости тока каталитической волны от времени взаимодействия
с пероксидом водорода является ток пика электрокаталитической реакции (1). Изучение зависимости тока каталитической волны от времени взаимодействия 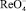 с пероксидом водорода (рис. 4) позволяет предположить механизм процесса:
с пероксидом водорода (рис. 4) позволяет предположить механизм процесса:
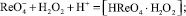 (2)
(2)
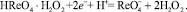 (3)
(3)
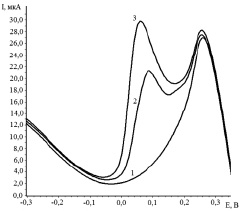
Рис. 1. Вольтамперные кривые разложения пероксида водорода в присутствии  . Условия эксперимента: фон 0,1 М H2SO4 + 0,03 М Н2О2; скорость изменения потенциала 0.08 В/с;1 – линия фона; 2 – фон + СRe(VII) = 8∙10–7 моль/ дм3; 3 – фон + СRe(VII) = 16∙10–7 моль/ дм3
. Условия эксперимента: фон 0,1 М H2SO4 + 0,03 М Н2О2; скорость изменения потенциала 0.08 В/с;1 – линия фона; 2 – фон + СRe(VII) = 8∙10–7 моль/ дм3; 3 – фон + СRe(VII) = 16∙10–7 моль/ дм3
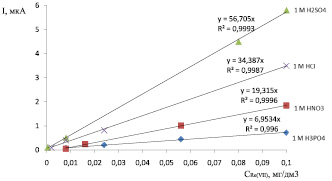
Рис. 2. Зависимости токов электрокаталитического разложения пероксида водорода от концентрации перренат-ионов при использовании различных фоновых электролитов
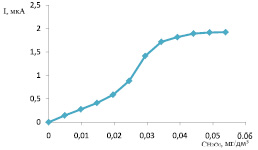
Рис. 3. Зависимость токов процесса электровосстановления водорода от концентрации пероксида водорода
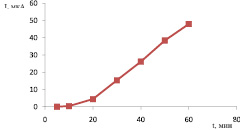
Рис. 4. Зависимость тока каталитической волны от времени взаимодействия  с Н2О2
с Н2О2
Электрохимической реакцией, дающей полезный аналитический сигнал в виде катодной каталитической волны, является реакция (3).
В то же время в связи с отсутствием процесса осаждения на поверхности РПЭ время предварительного электролиза (τэ) не имеет больших значений, оно составляет 10‒20 секунд. При этом достигается максимальное значение величин тока процесса.
Как видно из рис. 5, наблюдается прямолинейная зависимость между током катодного максимума и концентрацией ионов рения (VII) в растворе. По каталитической волне водорода, образующейся в этой системе, предложено проводить определение малых количеств рения (VII) методом вольтамперометрии.
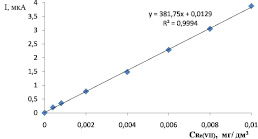
Рис. 5. Зависимость тока катодного максимума от концентрации рения (VII)
В качестве проб подготовки выбран метод дистилляции, основанный на летучести семиокиси рения из горячих высококипящих растворов.
Для переведения рения в раствор навеску пробы массой 1 г смачивали 1 МNaOH, затем небольшими порциями добавляли 10 мл 30 % Н2О2. После разложения пробу выщелачивали бидистиллированной водой, помещали в перегонную колбу.Раствор постепенно нейтрализуют 10 мл концентрированной серной кислоты (1:1) и отгоняют при температуре 290–300 °С в течение 30–40 мин. За время перегонки в перегонную колбу добавляют 1–2 мл окислителя (в данном случае 30 % пероксид водорода) для оптимизации процесса образования  .
.
Образующийся при отгонке Re2O7 улавливают в трех приемниках с бидистиллированной водой. Во время отгонки все приемники охлаждают смесью воды со льдом. После дистилляции рений находится в растворе в форме перренат-иона 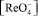 .
.
По завершении отгонки содержимое приемников объединяли. Отбирали аликвотную часть раствора (0,5–1 мл), добавляли в фоновый раствор объемом 10 мл 0,1 М H2SO4 и 0,03 мл 30 % H2O2 и проводили вольтамперометрический анализ.
Оценка правильности методики проводилась методом «введено-найдено». В мелкоистертую навеску пробы доломита Ca, Mg[CO3]2 добавляли известную концентрацию стандарта рения, проводили все стадии химической пробоподготовки и вольтамперометрическим методом фиксировали полученные результаты (табл. 1).
По разработанной методике проводилось определение рения в минеральном золоторудном сырье Сибири и Дальнего Востока. В табл. 2 представлены результаты определения рения в породах и рудах различного состава.
Таблица 1
Оценка точности вольтамперометрического измерения сигнала, полученного для определения ионов рения (VII) в растворах методом «введено-найдено», (n = 5; P = 0,95)
|
Введено рения, г/т |
Найдено рения, (Xср), г/т |
Относительное значение показателя точности ±δ, % |
|
0,200 |
0,209 |
36 |
|
0,500 |
0,516 |
34 |
|
2,000 |
2,084 |
33 |
Таблица 2
Результаты вольтамперометрического определения рения в породах
|
Наименование |
Номер пробы |
Содержание, г/т |
|
|
Хср, г/т |
Sr |
||
|
Дунит |
7007 |
0,179 |
0,021 |
|
О – 17/3 |
0,056 |
0,014 |
|
|
7052 |
0,383 |
0,038 |
|
|
7036/1 |
0,095 |
0,025 |
|
|
О – 27/1а |
0,081 |
0,003 |
|
|
Гарцбургит |
7073 |
0,035 |
0,007 |
|
7084 |
0,067 |
0,011 |
|
|
О – 19/1 |
0,025 |
0,007 |
|
|
О – 46/3 |
0,034 |
0,015 |
|
|
Габбро |
7018 |
0,314 |
0,033 |
|
О – 31/4 |
0,116 |
0,022 |
|
|
63/3 |
0,044 |
0,012 |
|
Предложенная методика вольтамперометрического определения рения в минеральном сырье по высоте максимума каталитической волны восстановления водорода может быть использована для контроля содержаний его в геологических объектах.
Выводы
1. Установлен характер и механизм процесса взаимодействия рения (VII) с пероксидом водорода.
2. Разработана новая методика каталитического вольтамперометрического метода определения рения (VII) на РПЭ. Наиболее чувствительным фоновым электролитом для определения содержаний рения является серная кислота с добавкой пероксида водорода.
3. Каталитические процессы, происходящие на поверхности индикаторного электрода или в объеме раствора, обусловливают повышение предельного тока, что приводит к повышению чувствительности определений. Таким образом, добавка пероксида водорода обусловливает снижение предела обнаружения рения в пробах и одновременно расширяет область определяемых концентраций.
4. На основании проведенных исследований влияния мешающих матричных компонентов в качестве подготовки пробы к определению был выбран метод дистилляционного отделения рения.
Рецензенты:
Мокроусов Г.М., д.х.н., профессор, заведующий кафедрой аналитической химии, ФГБОУ ВПО «Национальный исследовательский Томский государственный университет», г. Томск;
Ковалева С.В., д.х.н., профессор, заведующая кафедрой неорганической химии, ФГБОУ ВПО «Томский государственный педагогический университет», г. Томск.
Работа поступила в редакцию 01.07.2013.
Библиографическая ссылка
Оськина Ю.А., Горчаков Э.В., Колпакова Н.А. ОПРЕДЕЛЕНИЕ РЕНИЯ ВОЛЬТАМПЕРОМЕТРИЧЕСКИМ МЕТОДОМ // Фундаментальные исследования. 2013. № 8-3. С. 687-691;URL: https://fundamental-research.ru/ru/article/view?id=31982 (дата обращения: 05.03.2026).



