Наиболее используемыми для группового концентрирования органических веществ из растворов являются полимеры, а также модифицированные и немодифицированные кремнеземы [1, 8, 9]. Проще и дешевле использовать для этой цели полимерные сорбенты, однако их недостатком является склонность к неизбирательной сорбции максимального количества компонентов раствора. Повышение селективности связано с приданием гидрофобности поверхностному слою и модифицированием комплексами металлов, как это было показано ранее для силикагелей [4, 7].
Витамин К1 (филлохинон) наиболее распространен в природных растительных экстрактах, в том числе получаемых из чайных листьев. Его определение является непростой аналитической задачей вследствие значительного количества мешающих веществ. Предварительное концентрирование проводят обычно на полидиметилсилоксане [2] и других неполярных полимерах, способных к неизбирательной сорбции на своей поверхности большинства полярных соединений [7, 9].
Целью настоящей работы является исследование избирательной сорбции филлохинона в присутствии других кислородсодержащих соединений на поверхностном слое дипропилдитиокарбамата меди Cu(dpdtc)2 с последующим газохроматографическим определением.
Экспериментальная часть
Хроматографическое исследование проведено на газовом хроматографе «Agilent Technologies – 6890 N» с пламенно-ионизационным детектором и приставкой парофазного ввода пробы. Использована капиллярная колонка FFAP (Angilent) длиной 30 м, внутренним диаметром 0,25 мм и толщиной пленки 0,3 мкм. Температура колонки на начальном этапе 40 °С, затем нагрев в течение 5 мин со скоростью 4 °С/мин до 175 °С, выдержка при 200 °С в течение 5 мин. Скорость прохождения газа через колонку 4 мл/мин.
Патрон-концентратор представляет собой стальную трубку, содержащую 0,1–1,0 г сорбента полисорб-2 с адсорбционным слоем хелатного комплекса. Приготовление сорбента включало нанесение комплекса на поверхность путем испарения раствора хлороформа, содержащего 5 мас. % комплекса металла по отношению к массе носителя. Затем сорбент высушивали при пониженном давлении 650–700 мм рт. ст и комнатной температуре.
Таблица 1
Характеристика поверхности сорбентов на основе полисорба-2, модифицированных хелатами металлов
|
Характеристика |
Cu-diethyl-DTC |
Cu-dipropyl-DTC |
Cu-dibutyl-DTC |
|
Sуд, м2/г |
71,6 ± 0,8 |
74,2 ± 0,7 |
76,2 ± 0,8 |
|
Средний объем пор, см3/г |
1,2 ± 0,1 |
0,8 ± 0,1 |
0,9 ± 0,1 |
|
Средний диаметр пор, нм |
16 ± 2 |
9 ± 1 |
11 ± 2 |
Сорбцию в динамическом режиме проводили, прокачивая через патрон-концентратор водный или водно-этанольный раствор модельной смеси альдегидов, кетонов и сложных эфиров с концентрациями 10–50 мг/л со скоростью 1 мл/мин. Для создания потока образца через сорбент использовали микронасос Gilson Minipuls-2 (США). После концентрирования осуществляли обратную продувку концентратора гелием в течение 5 мин для удаления избытка воды и этанола. Обработанный таким образом концентратор помещали в 10 мл виал с герметично закрытый пробкой и проводили термодесорбцию из парофазной приставки в сорбционную петлю-ловушку при 180 °С в течении 20 мин, затем в газовую линию хроматографа.
В отсутствие концентрирования аликвоту объемом 5 мл помещали в герметично закрытый виал объемом 10 мл. В парофазной приставке виал термостатировали при 90 °С в течение 12 мин, что обеспечивает полный перевод жидкости в паровую фазу и, таким образом, соответствие компонентного состава раствора и анализируемой паровой пробы.
Для предварительной экстракции к 20 г листьев зеленого чая добавляли 150 мл органического растворителя или их смесь и 50 мл бидистиллированной воды, затем перемешивали в ультразвуковой ванне 30 минут. Ультрафиолетовое облучение образцов чайных листьев проводили лампой Vilber Lourmat VL-6.M мощностью 6 Вт с длиной волны 312 нм в течение 1–8 часов и термостатировании при 40 °С в течение 3–12 ч.
Количественный анализ проводили методом внутреннего стандарта по фторэтанолу, качественный анализ по временам удерживания библиотеки Angilent для колонки Angilent-FFAP.
Абсолютную погрешность определения массовой доли кислородсодержащих компонентов в смеси определяли по формуле
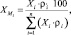
которую рассчитывали последовательно [6]. Сначала вычисляли абсолютную погрешность U1 по формуле:
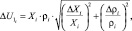
где ΔXi – абсолютная погрешность определения объемной доли каждого компонента; Δρi – абсолютная погрешность определения плотности каждого компонента.
Затем рассчитывали абсолютную погрешность суммы произведений U1, по формуле:
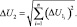
Окончательную абсолютную погрешность определения кислородсодержащих компонентов в смеси рассчитываем по формуле:
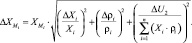
Результаты исследований и их обсуждение
Для твердофазной экстракции филлохинона апробирована серия диалкилдидтиокарбаматных комплексов меди, поскольку ранее была показана возможность сорбции веществ с фрагментами хинона на комплексах металлов подобного строения [5]. В качестве тестового вещества использован раствор 1,4-нафтохинона в этаноле. Из серии исследованных сорбентов с различной длиной углеводородной цепи в составе диалкилдитиокарбаматного комплекса меди наибольшей селективностью сорбции филлохинона обладает дипропилдитиокарбамат. Сравнение проводили с универсальным полимерным сорбентом тенакс, который часто используют для подобной пробоподготовки [9]. Раствор смеси кислородсодержащих веществ с различными концентрациями использовали в качестве модельного для сравнения эффективности сорбционного концентрирования (табл. 2).
Видно, что хелатсодержащие сорбенты позволяют сорбировать многие кислородсодержащие вещества из индивидуальных растворов более эффективно, чем тенакс, вероятно, вследствие специфичных межмолекулярных взаимодействий электронодонорных атомов кислорода в функциональных группах сорбатов и акцепторными ионами металла в хелатах.
Таблица 2
Газохроматографическое определение кислородсодержащих органических веществ после концентрирования динамическим способом из 50 мл модельного 0,1 % раствора этанола индивидуальных веществ и нафтохинона из полной смеси перечисленных веществ
|
Вещество |
Введено, мг |
Найдено, мг |
|||
|
Tenax GC |
CuDPDTC |
CuDBDTC |
CuDEDTC |
||
|
Ацетальдегид |
0,16 |
0,12 ± 0,05 |
0,15 ± 0,05 |
0,13 ± 0,06 |
0,11 ± 0,05 |
|
Метилацетат |
0,48 |
0,50 ± 0,05 |
0,47 ± 0,04 |
0,44 ± 0,06 |
0,42 ± 0,06 |
|
Этилацетат |
0,48 |
0,49 ± 0,05 |
0,44 ± 0,05 |
0,44 ± 0,07 |
0,45 ± 0,05 |
|
Пропилацетат |
0,48 |
0,48 ± 0,07 |
0,50 ± 0,05 |
0,45 ± 0,07 |
0,40 ± 0,06 |
|
Этилизовалериат |
0,48 |
0,44 ± 0,07 |
0,52 ± 0,06 |
0,42 ± 0,07 |
0,40 ± 0,06 |
|
Изоамилацетат |
0,48 |
0,44 ± 0,07 |
0,47 ± 0,07 |
0,42 ± 0,08 |
0,40 ± 0,05 |
|
Этаналь |
0,16 |
0,11 ± 0,05 |
0,17 ± 0,05 |
0,14 ± 0,05 |
0,12 ± 0,07 |
|
Пропаналь |
0,16 |
0,12 ± 0,05 |
0,17 ± 0,04 |
0,18 ± 0,05 |
0,12 ± 0,08 |
|
Бензальдегид |
0,16 |
0,16 ± 0,06 |
0,15 ± 0,04 |
0,13 ± 0,05 |
0,11 ± 0,08 |
|
Пропанон-2 |
0,64 |
0,60 ± 0,05 |
0,65 ± 0,05 |
0,65 ± 0,05 |
0,60 ± 0,06 |
|
Бутанон-2 |
0,64 |
0,65 ± 0,06 |
0,65 ± 0,05 |
0,66 ± 0,06 |
0,59 ± 0,08 |
|
1,4-нафтохинон |
1,02 |
0,87 ± 0,17 |
0,99 ± 0,08 |
0,85 ± 0,14 |
0,52 ± 0,22 |
Комплекс меди с этиловым фрагментом менее эффективно сорбирует кислородсодержащие вещества, что можно объяснить частичной растворимостью указанного комплекса в этиловом спирте. При элюировании смеси через такой сорбент последний разрушается, и чем длительнее этот процесс, тем менее воспроизводим результат анализа.
При концентрировании из групповой смеси распределение сорбированных веществ для тенакса меняется в сторону преобладания небольших молекул вне зависимости от их нуклеофильности, что соответствует однородной поверхности полимера. Для диалкилкарбаматных комплексов меди наблюдается четко выраженное стремление к сорбции нуклеофильных веществ, причем модельному 1,1-нафтохинону соответствует комплекс меди с пропильным фрагментом. Вероятно, это обусловлено полученной геометрией поверхностного ансамбля меди. Общей закономерностью является факт, что вещества, обладающие склонностью к донорно-акцепторному взаимодействию, к которым относятся большинство кислородсодержащих соединений, более прочно удерживаются на хелатных комплексах вследствие образования ассоциата с электронодефицитной частью комплекса металла.
В литературе предложен ряд методик жидкостной экстракции филлохинона с помощью изопропанола, этанола, гексана и некоторых других распространенных органических растворителей [10, 11], однако отмечена проблема большого количества экстрагируемых веществ, в число которых входят гликозилированные и этерифицированные стероиды, терпеноиды, хиноны и убихиноны. Поскольку в качестве растворителей для предварительного извлечения органических веществ нами использованы гексан, пропанол-2, бутанол, диэтиловый эфир, вода и их смеси, методика была дополнена стадией предварительной экстракции горячей водой. Образец чая неоднократно экстрагировали горячей дистиллированной водой до отсутствия окраски. После этого листья высушивали и проводили экстракцию различными растворителями (табл. 3).
Таблица 3
Извлечение филлохинона различными растворителямии их смесями 1:1 (%), Sr = 0,01–0,04
|
Растворитель |
Этанол |
Пропанол-1 |
Пропанол-2 |
Бутанол-1 |
Гексан |
|
Этанол |
14,3 |
14,5 |
52,9 |
14,2 |
66,3 |
|
Пропанол-1 |
14,5 |
14,0 |
57,8 |
14,7 |
71,4 |
|
Пропанол-2 |
52,9 |
57,8 |
61,2 |
68,7 |
95,2 |
|
Бутанол-1 |
14,2 |
14,7 |
68,7 |
16,6 |
86,5 |
|
Гексан |
66,3 |
71,4 |
95,2 |
86,5 |
88,1 |
Филлохинон растворим в алифатических спиртах линейного строения, однако наилучший результат получен при экстракции смесями спиртов с гексаном. Дальнейшая оптимизация экстракции позволила выбрать в качестве экстрагента смесь пропанола-2 с гексаном в соотношении 2:1.
Указанными растворителями обрабатывали образцы чая по методике, описанной в экспериментальной части. Общую массу экстрактивных веществ определяли взвешиванием сухого остатка после высушивания в роторном испарителе при пониженном давлении (табл. 4). Предложенная методика газохроматографического определения филлохинона с последовательными жидкостной и твердофазной экстракцией апробирована на примере анализа товарных сортов зеленого чая (табл. 5). Достоверность полученных результатов подтверждена методом «введено-найдено» с 1,4-нафтохиноном в качестве эталона.
Таблица 4
Содержание филлохинона в сухом экстракте зеленого чая
|
Наименование |
Масса сухого остатка, г |
Масса филлохинона, мг |
|
Чай «Кертис» |
0,61 ± 0,02 |
5,6 ± 0,1 |
|
Чай «Ява Премиум» |
0,58 ± 0,03 |
5,1 ± 0,1 |
|
Чай «Ява Медиум» |
0,40 ± 0,02 |
7,9 ± 0,1 |
|
Чай «Ахмад» |
0,64 ± 0,02 |
5,9 ± 0,1 |
|
Чай «Сенча» |
0,35 ± 0,01 |
1,1 ± 0,1 |
Таблица 5
Определение филлохинона в чаях методом «введено-найдено»
|
Чай |
Введено, мг |
Найдено, мг |
Sr |
|
«Кертис» |
0 |
6,0 ± 0,1 |
0,10 |
|
15 |
20,0 ± 0,1 |
||
|
30 |
36,0 ± 0,1 |
||
|
«Ява Премиум» |
0 |
5,0 ± 0,1 |
0,11 |
|
15 |
20,0 ± 0,1 |
||
|
30 |
36,0 ± 0,1 |
||
|
«Ява Медиум» |
0 |
7,0 ± 0,1 |
0,13 |
|
15 |
24,0 ± 0,1 |
||
|
30 |
38,0 ± 0,1 |
||
|
«Ахмад» |
0 |
6,0 ± 0,1 |
0,17 |
|
15 |
22,0 ± 0,1 |
||
|
30 |
35,0 ± 0,1 |
||
|
«Сенча» |
0 |
1,0 ± 0,1 |
0,11 |
|
15 |
16,0 ± 0,1 |
||
|
30 |
31,0 ± 0,1 |
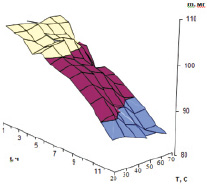
Влияние температуры и УФ-облучения на количество витамина К в модельном растворе
Повышенная температура до 80 °С не влияет на содержание филлохинона в чайных листьях, а УФ-облучение снижает его концентрацию (рисунок).
Установлено, что существенное влияние оказывает снижение рН путем добавления соляной кислоты. При повышении концентрации водородных ионов до рН = 3 витамин К практически полностью можно перевести в недиссоциированное состояние. При повышении концентрации водородных ионов увеличивается число молекул недиссоциированного филлохинона, следовательно, возрастает степень экстракции органическими растворителями.
Рецензенты:
Короткова Е.И., д.х.н., профессор кафедры физической и аналитической химии, заместитель проректора-директора по научной работе и инновационному развитию института природных ресурсов, ФГБОУ ВПО «Национальный исследовательский Томский политехнический университет», г. Томск;
Косинцев В.И., д.т.н., профессор-консультант кафедры общей химической технологии Института природных ресурсов, ФГБОУ ВПО «Национальный исследовательский Томский политехнический университет», г. Томск.
Работа поступила в редакцию 01.07.2013.
Библиографическая ссылка
Гавриленко М.А., Слижов Ю.Г., Бурметьева М.С., Билялов А.А., Гавриленко Н.А. КОНЦЕНТРИРОВАНИЕ ФИЛЛОХИНОНА НА ДИПРОПИЛДИТИОКАРБАМАТЕ МЕДИ // Фундаментальные исследования. 2013. № 8-3. С. 575-579;URL: https://fundamental-research.ru/ru/article/view?id=31960 (дата обращения: 01.03.2026).



