Гепарин – кислый серосодержащий гликозаминогликан, биополимер, состоящий из полисахаридных цепей, связанных с общим белковым ядром. Он является антикоагулянтным и антитромбическим средством, применяемым уже более 60 лет в клинической практике, в частности, при операциях на сердце и кровеносных сосудах, для поддержания жидкого состояния крови в аппаратах гемодиализа и искусственного кровообращения, при профилактике и терапии тромбоэмболических заболеваний [14].
Лабораторный контроль гепаринотерапии необходим для минимизации риска развития кровотечений при передозировке и оптимизации антитромбического лечения. Правильность определения активности гепарина крайне важна для производителей лекарственных форм данного соединения. Результаты измерений активности гепарина в субстанциях, полупродуктах и целевых лекарственных средствах позволяют обеспечить эффективность производства и в дальнейшем дают возможность предлагать клинике точно аттестованные препараты [13]. Благодаря широкому спектру применения гепарина его мониторинг в различных объектах вызывает большой интерес для многих медиков, биологов и химиков.
Анализ гепарина является сложной задачей из-за неоднородности соединения, размера молекулы и распределения в ней заряда дисперсии.
Существует ряд методов определения гепарина в разных объектах искусственного и природного происхождения. В настоящее время можно выделить биологические [2, 4, 10] и химические методы анализа. Химические же в свою очередь включают в себя три основные группы: спектральные [6, 8–9], хроматографические [1, 3, 7] и электрохимические [11–12].
Данная работа посвящена определению гепарина в лекарственной форме с использованием красителя МГ методом вольтамперометрии.
Материалы и методы исследования
Исходным препаратом в исследованиях использовали фармакологический раствор высокомолекулярного гепарина натрия в форме тетранатриевой соли (Na4Hep), для внутреннего и подкожного введения (ФГУП «Московский эндокринный завод», Россия, город Москва), упакованный во флаконы по 5 мл. Каждый миллилитр такого раствора содержал 38,5 мг соли. Раствор красителя МГ с классификацией ч.д.а. готовили растворением его навески 0,3198 г. в 100 мл бидистиллированной воды. Фоновым электролитом выбран фосфатный буферный раствор (эквимолярная смесь KH2PO4 и Na2PO4) с pH 6,86.
Все исследования выполняли на вольтамперометрическом анализаторе ТА–2 (ООО «Томьаналит», Россия, город Томск) с трехэлектродной системой, включающей индикаторный СУЭ, хлорид серебряный электрод сравнения и вспомогательный электрод из платины.
Исследуемый раствор фонового электролита объемом 10 см3 помещали в электрохимическую ячейку, добавляли лекарственную форму гепарина и краситель МГ в соотношении 1:10. Исследования проводили при постоянно-токовой развертке со скоростью 40 мВ/с в анодной области потенциалов от –1,0 до 1,5 В, время перемешивания раствора составляло 50 с, успокоения 60 с. Съемку анодной вольтамперограммы повторяли не менее пяти раз.
Для уменьшения ошибки эксперимента используемый в работе индикаторный СУЭ проходил предварительную поляризацию в области потенциалов от 2 до –2 В методом циклической вольтамперометрии.
Результаты исследования и их обсуждение
В литературных источниках информации о прямом электрохимическом определении гепарина при разных условиях ранее не сообщалось. Кроме того, в работе при поиске аналитического сигнала от гепарина в чистом виде на разных материалах электрода (РПЭ, СУЭ, PtЭ) получено не было. В связи с этим был предложен способ косвенного определения гепарина в комплексе с представителем соединений класса азокрасителей МГ. В исследовании использован нетоксичный и более чувствительный СУЭ, при проведении эксперимента на котором получены более воспроизводимые результаты по определению гепарина в лекарственной форме в комплексе с МГ.
Предварительно исследовались электрохимические свойства МГ методами циклической, катодной и анодной вольтамперометрии. Наиболее воспроизводимый сигнал МГ был получен в анодной области в диапазоне потенциалов от –1,0 до 1,5 В, в катодной области имело место мешающее влияние кислорода на МГ, поэтому область от –1,0 до 1,5 В была выбрана как рабочая.Большой интерес представляло собой исследование по выявлению влияния рН на ток окисления МГ. На рис. 1 представлена зависимость тока окисления МГ от рН фонового электролита на СУЭ.
Из рис. 1 видно, что в нейтральных и щелочных средах ток достигает своего максимума в отличие от кислых. В дальнейших исследованиях рН = 6,86 было выбрано как оптимальное значение.
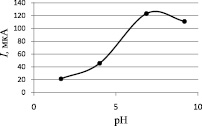
Рис. 1. Зависимость тока электроокисления МГ на СУЭ от рН фонового электролита
При выборе оптимальных условий для определения гепарина в комплексе с МГ были сняты анодные вольтамперограммы МГ в отсутствии и присутствии гепарина, которые представлены на рис. 2.
В таблице представлены данные изменения интенсивности пиков окисления, потенциалов комплекса МГ-Hep в зависимости от концентрации гепарина в системе.
Используя данные, представленные в таблице, была построена зависимость тока окисления комплекса МГ-Hep от концентрации гепарина в электрохимической ячейке (рис. 3).
Из графика, представленного на рис. 3, видно, что с увеличением концентрации гепарина в ячейке уменьшается интенсивность сигнала окисления метиленового голубого в прямолинейной области концентраций от 10–4 до 10–3 мг/мл, что может быть использовано для определения гепарина косвенным методом в лекарственной форме.
Выводы
Подобраны оптимальные условия для определения гепарина в лекарственной форме косвенным методом по уменьшению пика окисления метиленового голубого.
При оптимизированных условиях получена линейная зависимость в диапазоне концентраций гепарина от 3,85∙10–4 до 3,85∙10–3 мг/мл.
Заключение
В фосфатном буферном растворе с рН 6,86 МГ заряжен положительно, а гепарин – отрицательно, взаимодействуя друг с другом электростатически, они образуют комплекс, в результате концентрация свободного МГ в растворе уменьшается, что приводит к снижению тока окисления МГ.
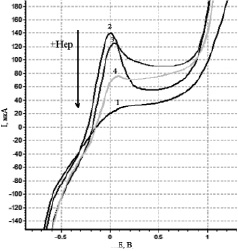
Рис. 2. Вольтамперограмма окисления МГ в отсутствии и присутствии гепарина на СУЭ: 1 – фоновая кривая; 2 – МГ 10–4 моль/дм3; 3 – 3,85∙10–4 мг/мл HepNa4; 4 – 19,25∙10–4 мг/мл HepNa4. W = 40 мВ/с, рН = 6,86
Данные анодной вольтамперометрии окисления комплекса МГ-Hep
|
С (МГ), моль/дм3 |
ЕМГ, В |
С(HepNa4)∙10–4, мг/мл |
∆i, мкА |
ЕHep, В |
|
10–4 |
–0,02 |
19,25 |
1,446651 |
0,01 |
|
38,5 |
1,436584 |
|||
|
192,5 |
1,34398 |
|||
|
385 |
1,158701 |
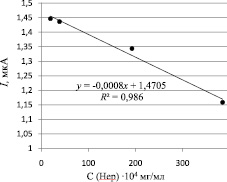
Рис. 3. График зависимости токов окисления комплекса МГ-Hep от концентрации гепарина в электрохимической ячейке
Полученные в ходе исследования данные по уменьшению сигнала комплекса МГ при Е = –0,02 В с увеличением концентрации гепарина в системе могут быть использованы для разработки косвенного метода определения гепарина в лекарственных препаратах.
Работа выполнена в рамках государственного задания «Наука» по теме 3.2702.2011.
Работа выполнена при финансовой поддержке гранта Президента Российской Федерации МК-7366.2013.8.
Рецензенты:
Слепченко Г.Б., д.х.н., профессор кафедры физической и аналитической химии, ФГБОУ ВПО «Национальный исследовательский Томский политехнический университет», г. Томск;
Колпакова Н.А., д.х.н., профессор кафедры физической и аналитической химии, ФГБОУ ВПО «Национальный исследовательский Томский политехнический университет», г. Томск.
Работа поступила в редакцию 01.07.2013.
Библиографическая ссылка
Вишенкова Д.А., Короткова Е.И., Дорожко Е.В. ВОЛЬТАМПЕРОМЕТРИЧЕСКОЕ ОПРЕДЕЛЕНИЕ ГЕПАРИНА В КОМПЛЕКСЕ С КРАСИТЕЛЕМ МЕТИЛЕНОВЫМ ГОЛУБЫМ // Фундаментальные исследования. 2013. № 8-3. С. 561-564;URL: https://fundamental-research.ru/ru/article/view?id=31957 (дата обращения: 02.01.2026).



