Многие аспекты патогенеза тромбоцитопении при ХГС остаются до конца не изученными. Так, например, уменьшение выработки тромбопоэтина и снижение его активности вследствие снижения функциональной активности гепатоцитов при ХГС является доказанным [5], однако роль рецепторов к тромбопоэтину в патогенезе развития тромбоцитопении при ХГС до настоящего времени еще не изучалась [1, 4, 6, 8].
Основным регулятором процесса образования тромбоцитов является тромбопоэтин, в основном вырабатываемый клетками печени. В плазме крови он частично связывается с рецепторами с-Mpl, расположенными на тромбоцитах, а оставшаяся его часть оказывает стимулирующее влияние на пролиферацию мегакариоцитов в костном мозге. Синтез данных рецепторов кодируется геном Mpl [3]. У больных ХГС вследствие снижения функциональной активности гепатоцитов имеет место уменьшение выработки тромбопоэтина и снижение его активности [5]. С другой стороны, в гене Mpl описаны частые соматические мутации W515L иW515K, которые в гетерозиготном состоянии приводят к возникновению эссенциальной тромбоцитемии. Точковая мутация тромбопоэтинового рецептора встречается у 5–10 % больных с эссенциальной тромбоцитопенией [2, 7]. Поэтому механизм развития тромбоцитопении у больных ХГС, возможно, связан не только со снижением синтеза тромбопоэтина в печени, но и с дефектом экспрессии рецептора с-Mpl на тромбоцитах.
Оценка функциональной активности тромбоцитов, а именно состояния их рецепторов к тромбопоэтину, позволила бы более углубленно оценить механизмы формирования тромбоцитопении у больных хроническим гепатитом С и расширить современные представления о патогенетических аспектах этого заболевания.
Целью исследования явилось определение выраженности мутаций в рецепторах тромбоцитов к тромбопоэтину, а также установление взаимосвязи исследуемых показателей с развитием тромбоцитопении у больных хроническим гепатитом С.
Материалы и методы исследования
Объектом настоящего исследования явились больные ХГС, находившиеся на обследовании и лечении в условиях инфекционного боксированного отделения для взрослых № 4 МБУЗ ГБ№ 1 им. Н.А. Семашко г. Ростова-на-Дону.
В исследование вошли 58 больных с ХГС (РНК НCV+), не леченных ранее с использованием комбинированной противовирусной терапии, со степенью фиброза по данным непрямой эластометрии печени не выше F2 и отсутствием явных клинико-лабораторных признаков аутоиммунных заболеваний. Пациенты были разделены на 2 группы в зависимости от наличия (n1 = 29) или отсутствия у них тромбоцитопении (n2 = 28). По основным клинико-лабораторным параметрам (возраст, пол, активность АлАт и АсАт, генотип вируса, уровень виремии, степень выраженности фиброза) группы оказались практически идентичными, что позволило провести их дальнейший статистический анализ. В группу сравнения вошли практически здоровые лица в возрасте от 22 до 55 лет (n3 = 32).
Во всех группах проводилось количественное определение частоты мутаций в гене Mpl (W 515L и 515К), кодирующего с-Mpl рецептор тромбоцитов к тромбопоэтину, с предварительным выделением ДНК тромбоцитов, осуществлялось с помощью количественной ПЦР в реальном времени (RQ-PCR)по технологии TagMAN с использованием Mpl W 515L и 515К-тестов производства «ГеноТехнология». Определялось исходное число копий нормального гена и число копий гена с мутацией W 515L и 515К. Все исследования выполнялись в лаборатории на базе ФБУН «РостовНИИ микробиологии и паразитологии» Роспотребнадзора.
Результаты исследованияи их обсуждение
Состояние с-Mpl рецепторов тромбоцитов к тромбопоэтину при ХГС
Функциональное состояние с-Mpl рецепторов тромбоцитов к тромбопоэтину оценивали по частоте и экспрессии соматических мутаций W515L и W515K в гене Mpl. В группе здоровых лиц, также как и у больных ХГС обеих групп, точковые мутации W515L и W515K встречались практически с одинаковой частотой (рисунок). Их выявление свидетельствовало о возможной предрасположенности к развитию тромбоцитопении. Доминировала во всех группах мутация W515L, составляя соответственно 69,2 % от суммарной частоты встречаемости обеих мутаций у больных ХГС с тромбоцитопенией, 71,4 % у больных ХГС без тромбоцитопении 76,9 % у здоровых лиц.
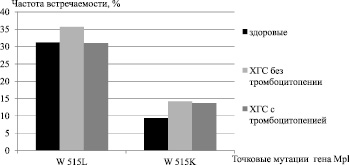
Частота выявления соматических точковых мутаций W 515L и W 515К гена Mpl в исследуемых группах
Таким образом, различий в частоте встречаемости и типе соматической мутации гена Mplво всех исследуемых группах не обнаружено. Вместе с тем совершенно иные данные были получены при изучении степени экспрессии точковых мутаций у здоровых лиц и больных ХГС. Интенсивность мутации оценивалась по частоте замены аминокислоты триптофан в положении W515 на лейцин (W515 L) или лизин (W515 K) и выражалась в процентах. Мутация в пределах 0,0001–1,0 % считалась слабой, от 1,0–50 % – средней и свыше 50 % – сильной мутацией (таблица).
Выраженность соматических мутаций гена Mpl у больных в исследуемых группах (абс./ Х ± S, %)
|
Больные исследуемых групп с мутациями гена Mpl |
Выраженность мутации |
W515L |
W515K |
|
Здоровые лица, n = 13 |
0,0001 % – 1,0 % (1) |
8/61,5 ± 14,0 |
3/23,07 ± 12,1 |
|
< 1,0–50 % (2) |
1/7,7+7,7 |
0/0+7,7 |
|
|
> 50 % (3) |
1/7,7 ± 7,7 |
0/+7,7 |
|
|
Б-е ХГС без тромбоцитопении, n = 14 |
0,0001 % – 1,0 % (4) |
1/7,14 ± 7,14 |
0/0+7,14 |
|
< 1,0–50 % (5) |
3/21,4 ± 11,3 |
1/7,14 ± 7,14 |
|
|
> 50 % (6) |
6/42,8 ± 13,7 |
3/21,4 ± 11,3 |
|
|
Б-е ХГС с тромбоцитопенией n = 13 |
0,0001 % – 1,0 % (7) |
1/7,6 ± 7,6 |
1/7,6 ± 7,6 |
|
< 1,0–50 % (8) |
2/15,3 ± 10,3 |
1/7,6 ± 7,6 |
|
|
> 50 % (9) |
6/46,1 ± 14,3 |
2/15,3 ± 10,3 |
|
|
p 1–4 |
< 0,05 |
> 0,05 |
|
|
p 1–7 |
< 0,05 |
> 0,05 |
|
|
p 2–5 |
> 0,05 |
> 0,05 |
|
|
p 2–8 |
> 0,05 |
> 0,05 |
|
|
p 5–8 |
> 0,05 |
> 0,05 |
|
|
p 3–6 |
< 0,05 |
> 0,05 |
|
|
p 3–9 |
< 0,05 |
> 0,05 |
|
Оказалось, что в обеих группах больных ХГС (как с тромбоцитопенией, так и без таковой), значительно чаще, чем у здоровых лиц, встречалась сильная мутацияW515L (46,1 ± 14,3 и 42,8 ± 13,7 % против 7,7 ± 7,7 % соответственно, p < 0,05). В отношении мутации W515К прослеживалась та же тенденция, но в связи с тем, что она встречалась значительно реже, достоверных отличий в исследуемых группах установить не удалось.
Полученные данные дают основание предполагать, что вирус гепатита С, попадая в организм человека, может усиливать мутацию гена Mpl, кодирующего рецепторы тромбопоэтина у лиц, уже имевших ранее точковые мутации W515L или W515К.
Под воздействием вируса слабая мутация может трансформироваться в выраженную и снижать опосредованное через c-Mpl рецептор связывание тромбоцитов с тромбопоэтином. В этом случае теоретически более значительное количество тромбопоэтина должно идти на стимуляцию пролиферации мегакариоцитов в костном мозге, но в связи с тем, что синтез тромбопоэтина в печени при ХГС снижен [5, 9], стимулирующий эффект по принципу «обратной связи» практически оказывается нивелированным. Объяснимо и отсутствие разницы в частоте выявления выраженных мутаций в группе больных с тромбоцитопенией и без таковой. В данном случае вирус способствует увеличению количества клеток, несущих данные мутации, усиливая выраженность дефектов в рецепторном аппарате тромбоцитов к тромбопоэтину. Проявятся ли эти нарушения клинически, иными словами, разовьется ли у данного конкретного пациента с ХГС тромбоцитопения, зависит не только от выраженности экспрессии данных точковых мутаций гена Мpl, но и от множества других эндогенных факторов, вносящих вклад в развитие тромбоцитопении.
У больных ХГС с тромбоцитопенией отмечались также изменения в коагулограмме. В 86,2 ± 6,52 % случаев (25 больных) эти сдвиги проявлялись в виде удлинения протромбинового времени до 12,20 ± 0,37 с и в 41,38 ± 9,31 % (12 больных) – снижения АЧТВ до 31,50 ± 0,54 с. У всех этих пациентов выявлялись антитела к рецепторам тромбоцитов. Следует отметить, что у больных со сниженным АЧТВ зарегистрировано и удлинение протромбинового времени.
У больных ХГС без тромбоцитопении указанные изменения протромбинового времени и АЧТВ регистрировались соответственно в 21,42 ± 7,90 % (6 больных) и 14,29 ± 6,74 % (4 больных) случаях, что было существенно меньше, чем у пациентов с тромбоцитопенией (p < 0,05 и p < 0,01 соответственно).
Заключение
Под влиянием вируса гепатита С экспрессия точковых мутаций W515L и W515К гена Mpl может усиливаться. Дефект экспрессии рецептора с-Mpl на тромбоцитах приводит к нарушению связывания тромбопоэтина, что в свою очередь ведет к снижению образования тромбоцитов. Вследствие этого наличие точковых мутаций в данном гене у больных ХГС можно рассматривать как один из прогностических факторов по развитию тромбоцитопении.
Рецензенты:
Харсеева Г.Г. д.м.н., профессор, зав.кафедрой микробиологии и вирусологии № 2, ГБОУ ВПО РостГМУ Минздрава РФ, г. Ростов-на-Дону;
Яговкин Э.А. д.м.н., с.н.с. заместитель директора Ростовского научно-исследовательского института микробиологии и паразитологии, г. Ростов-на-Дону.
Работа поступила в редакцию 17.04.2013.
Библиографическая ссылка
Пшеничная Н.Ю., Кузнецова Г.В., Колпаков Д.С. ВЗАИМОСВЯЗЬ НАРУШЕНИЙ В РЕЦЕПТОРНОМ АППАРАТЕ ТРОМБОЦИТОВ К ТРОМБОПОЭТИНУ И РАЗВИТИЯ ТРОМБОЦИТОПЕНИИ У БОЛЬНЫХ ХРОНИЧЕСКИМ ГЕПАТИТОМ С // Фундаментальные исследования. 2013. № 7-2. С. 375-378;URL: https://fundamental-research.ru/ru/article/view?id=31842 (дата обращения: 05.02.2026).



